一个世纪以前,罹患1型糖尿病几乎等同于被判了死刑,而现在,它只是日常疾病。科技的不断进步给了人们更高的期望,“根治糖尿病”是所有人的期待。近期,发表于Nature reviews endocrinology的一篇文章对糖尿病细胞治疗技术的进展进行了总结,我们一起来看一看,这项技术进展到哪一步了?

近年来,虽有多项新技术和多种新型降糖药物相继应用于临床,但目前糖尿病尚无根治方法。有研究表明对于部分2型糖尿病患者的干预(如减重、药物),有“逆转”糖尿病的可能,但对于1型糖尿病以及部分病程较长、β细胞受损严重的2型糖尿病患者来说,外源补充胰岛素仍是疾病治疗的必要选择。
目前,治疗手段愈加丰富,但仍无法解决根本问题
目前的皮下注射胰岛素的治疗方案虽然可以挽救患者生命,但毕竟不能100%模仿人体自身胰腺内生胰岛素β细胞和其他胰岛细胞所提供的精细化血糖控制,无法回避β细胞严重缺乏和功能障碍这一根本问题。
近些年的新技术——连续血糖监测和人工胰腺能够改善患者的预后,但通过对HbA1c的监测发现,这些新技术也不能提供最佳的长期血糖控制。即使1型糖尿病患者采用自动胰岛素给药的方法,血糖维持在目标血糖范围内的时间百分比仍然不理想。并且,患者对这些新技术的接受程度也相当低,因为病人不愿意同时佩戴传感器、泵和监测器等这些笨重的设备。
通过实体胰腺器官移植或胰岛移植的方法来替代β细胞,可以达到不使用胰岛素而使病情获得良好控制的目的。但由于供体组织缺乏,广泛应用显然是不现实的。因此,用干细胞技术等生产出充足分泌胰岛素的细胞资源,用于β细胞替换,以恢复缺失的β细胞或功能障碍,或许才能从根本上治愈糖尿病。
未来,“糖尿病细胞治疗技术”带来根治糖尿病的希望
利用具有正常胰岛素分泌功能的β细胞进行替代是与正常生理条件最接近的治疗方案,既能有效控制血糖、又能防止、逆转并发症。
而糖尿病细胞治疗技术,简单来讲,指的是体外制造出具有良好功能且足够量的β细胞,将其移植到糖尿病患者体内以补充β细胞的缺失或恢复功能障碍的一种糖尿病治疗技术。
进展到哪一步了?
制造出功能成熟且足够量的β细胞是糖尿病细胞治疗技术的重要环节,好消息是,在这个技术环节科学家们已经有了突破。
目前以下2种途径可以从祖细胞中产生功能性β细胞:
➤复制人类胰腺发育过程中控制β细胞形成的信号来实现人多能干细胞的定向分化来得到β细胞,即人多能干细胞定向分化。
➤利用密切相关的内胚层来源细胞的可塑性,如胰腺非β细胞和肝、胃、肠细胞,诱导它们采用β细胞表型,即近缘细胞的转分化。
1.人多能干细胞(hPSCs)定向分化
人类多能干细胞(hPSCs)包括胚胎干细胞(ESCs)和经诱导的多能干细胞(iPSCs)。ESCs来源于囊胚期胚胎的内部细胞团,而iPSCs是通过对患者的体细胞[如外周血单个核细胞(PBMCs)或真皮成纤维细胞等]重新编程获得的。hPSCs可通过调节胰腺形成过程中活跃的信号通路,定向分化为成熟的β细胞。
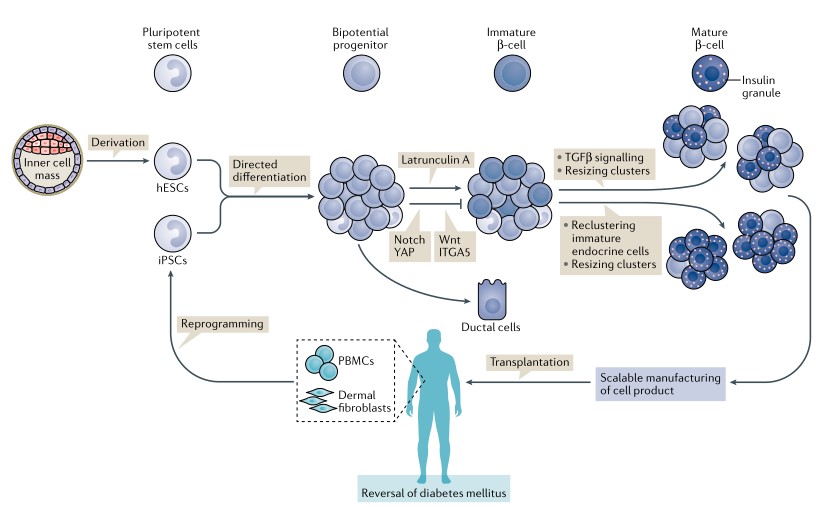
图1 人多能干细胞定向分化过程
从2015年开始,科研人员致力于通过抑制肌动蛋白聚合126,YAP125、145,Wnt146,ITGA5125或Notch等方法,进一步促进双潜能祖细胞的内分泌响应。分离不成熟的内分泌细胞并重新聚集成更小的胰岛样集合,促进β细胞功能和代谢的成熟,使β细胞获得动态胰岛素分泌特性。最终,生产出临床所需规模的成熟β细胞,并移植到人体内,可通过将细胞放置于免疫保护装置和/或使用免疫抑制来实现糖尿病的根治。
由干细胞中衍生β细胞的方案最为核心的一点是,如何获得高纯度的内分泌细胞群。而现在,科研人员已经能够实现从除β细胞外其他相似细胞中生成我们所需要的β细胞,并且实现β细胞的功能重建。这么看来,这种治疗方案似乎距离我们最近。
2.近缘细胞的转分化
利用近缘细胞的转分化,同样可以得到β样细胞。
➤β样细胞同样可以从其他类型的胰腺细胞中获得,如腺泡细胞(通过腺病毒重组PDX1,MAFA,NGN3和PAX4);α细胞(通过PAX4、MAFA、PDX1的过度表达和ARX的抑制作用);
➤或来自表达CD133、CD49fhi、DCLK1和ALDHhi的祖细胞。肝脏和相关肝外组织与邻近胰腺具有相似的发育程序,因此激活一些关键的胰腺标志物如PDX1、TGIF2或Wnt信号足以将肝或胆囊组织转化为β样细胞;
➤另一个来源是与胰腺内分泌细胞高度相似的肠道神经内分泌细胞。
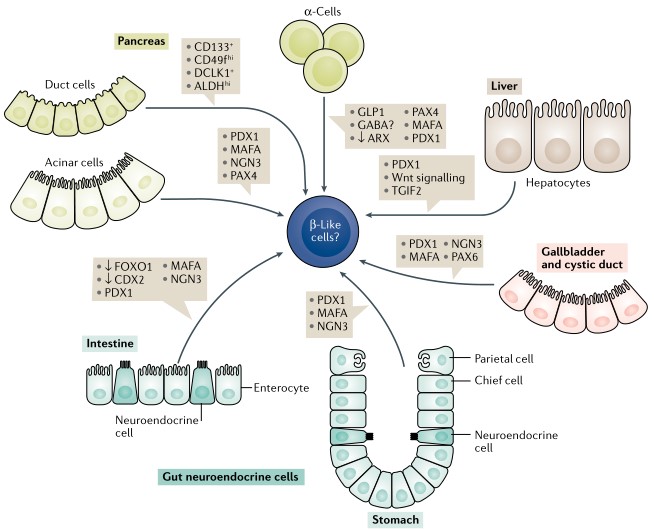
图2 近缘细胞的转分化
应用于临床前,需要解决几道关卡
1.生物加工方面的挑战
从hPSCs中获得功能性β细胞的研究取得了显著的进展,这使得开发糖尿病细胞治疗的生物工艺成为可能。
然而,为了能够以合理的成本和保证高质量的前提下制造这些产品,必须解决几个挑战:目前的生物制造系统是为制造生物制剂而设计和优化的,这与细胞疗法相关的生产技术有很大的不同。在传统的生物制药过程中,细胞是产生重组蛋白或疫苗的手段和工具,而在干细胞定向分化过程中,细胞是实际的产物。此外,用于高滴度生产生物制剂的细胞系的漫长培养过程可能不适用于干细胞生物处理。
2.人体自身免疫和成本
目前来看,功能性β细胞治疗技术最多的应用应该是对1型糖尿病或晚期2型糖尿病患者进行细胞替代治疗,但在这两类人群中面临着不同的难题需要解决。
1型糖尿病患者:“自身免疫性排斥反应”是干细胞分化或转分化治疗方法用于1型糖尿病患者治疗的主要障碍。由于该类患者体内几乎无正常胰岛细胞残存,即便由供体原料培养的功能性β细胞,经移植能显著恢复正常血糖,患者仍需终生免疫抑制,并服用有副作用的药物。
2型糖尿病患者:尽管2型糖尿病患者可以使用自体组织作为原料,特异性诱导多能干细胞以避免移植物排斥反应,但大规模应用将耗费高昂的成本。
小结
恢复人体正常的β细胞数量以及功能是根治糖尿病的核心。因此,体外生产出足够多的功能性β细胞,并将其移植到糖尿病患者体内,通过技术手段减少自身免疫的干扰的“糖尿病细胞治疗技术”非常值得期待。
可喜的是,目前随着生物工艺的改进,可以制造出稳定、功能成熟且足够量的功能性β细胞,但这项技术距离临床实际应用还有诸多关卡要打通。不过随着科学技术的不断发展,相信“根治糖尿病“终会成为现实。
转自医脉通







 糖尿病细胞治疗技术通过体外制造功能性β细胞有望根治糖尿病。科学家已能从人多能干细胞和近缘细胞中产生β细胞,但面临生物加工挑战、免疫排斥和成本问题。目前,生物工艺的进步使得制造稳定、成熟β细胞成为可能,但临床应用还需克服自身免疫反应和经济成本等障碍。
糖尿病细胞治疗技术通过体外制造功能性β细胞有望根治糖尿病。科学家已能从人多能干细胞和近缘细胞中产生β细胞,但面临生物加工挑战、免疫排斥和成本问题。目前,生物工艺的进步使得制造稳定、成熟β细胞成为可能,但临床应用还需克服自身免疫反应和经济成本等障碍。

















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








