
一、碳原子的成键方式
1、单键、双键、叁键
依据成键两原子间共用电子的对数,可以将共价键分为单键、双键和叁键。
两原子间共用一对电子的共价键称为单键,如C—C、C—O、C—H;两个原子间共用两对电子的共价键称为双键,如C=C、C=O;两原子间共用三对电子的共价键称为叁键,如C≡C、C≡N。
甲烷分子为正四面体构型,中心碳原子与4个氢原子形成4个C—H单键,任意两个键之间的夹角都是109.5°。烷烃分子中的碳原子与其它原子形成4个单键,键角接近109.5o,所以烷烃分子中的碳链是折线型的结构。
乙烯是平面型分子,分子中存在C=C双键,2个碳原子和4个氢原子共平面。双键不能转动,双键碳上连接的原子始终与双键共平面,也与碳碳双键周围的氢原子共平面,相邻两个键的键角约为120°。

乙炔是直线型分子,分子中2个碳原子和2个氢原子处于同一条直线上,分子中存在C≡C叁键,相邻键的键角为180°。形成叁键的碳原子以及与之直接相连的原子共线。
键参数——表征化学键性质的物理量,如键能、键角、键长、键的极性等
键长:成键两原子的原子核间的距离。
键角:分子中一个原子与另外两个原子形成的两个共价键之间的夹角。
键能:以共价键结合的气态下的分子,断开单位物质的量的某键时所吸收的能量。
一般键长越短,键能越大,化学键越稳定。
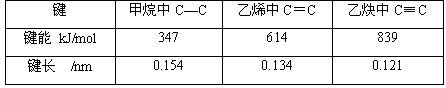
比较各键键能,双键与叁键键能是单键键能的二倍和三倍吗? 为什么呢?
乙烯和乙炔化学性质活泼,是因为只需要较小的能量就能使双键中的一对共用电子或叁键中的两对共用电子断裂。双键和叁键中存在容易断裂的不稳定的——π键。
认识σ键、π键和大π键
原子轨道重叠形成共价键,“头碰头”式重叠形成σ键,“肩并肩”式重叠形成π键。σ键比s键比π键重叠程度大,键能高,更稳定。
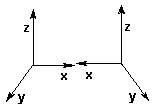
两个碳原子间形成单键时,总是形成较稳定的σ键,当两个碳原子形成双键或叁键时,受轨道在空间的延展方向的影响,只能有一对成键轨道以“头碰头”式重叠形成σ键,其他轨道只能以“肩并肩”式重叠形成π键。双键中只有一个σ键和一个π键,叁键中有一个σ键和二个π键。
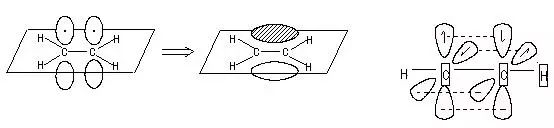
苯分子中的碳原子的三个原子轨道采取SP2方式杂化,6个碳原子形成平面正六边形结构,分子中的12个原子共平面。每个碳原子中都有一个垂直于苯环的未参与杂化的原子轨道,其中各有一个电子,这6个轨道以“肩并肩”的方式形成一个特殊的共价键,6个电子被6个碳原子共用,形成特殊的大π键。
2、极性键和非极性键
(1)非极性共价键(简称非极性键)
成键两原子相同,共用电子不偏向任何一方,因此参与成键的两个原子不显电性。非极性共价键可存在于单质、无机化合物、有机物中。
(2)极性共价键(简称极性键)
成键的两原子不同,它们吸引电子的能力不同,共用电子对因一方吸引电子的能力较强(电负性大)而偏向该方,使该方的原子带部分负电荷,另一方原子带部分正电荷。两原子吸引电子的能力相差越大(即电负性差值越大),该共价键的极性越强。
电负性——元素的原子成键时吸引电子能力的相对强弱。元素的电负性越大,相应的原子成键时吸引电子的能力越强。F元素的电负性最大。
二、有机化合物的同分异构现象
同分异构现象:我们把分子式相同,结构不同的现象称为同分异构现象。
同分异构体:具有同分异构现象的化合物称为同分异构体。
思考:
1、同分异构体具有相同的分子式,必然具有相同的相对分子质量。是否具有相同分子质量的化合物一定是同分异构体?
2、最简式相同的物质是否为同分异构体?
(解答:1、不一定,例如C9H20和C10H8;2、不是,如苯和乙炔最简式均为“CH”,但二者分子式不同,不是同分异构体。)
同分异构体的类型:
1、碳骨架异构:碳原子之间连接成不同的骨架结构而造成的异构。
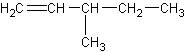 与
与 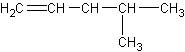
2、官能团位置异构:官能团在碳链上位置不同而造成的异构。
 与
与 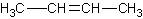
3、官能团类型异构:官能团的种类不同,或有机物类别不同而造成的异构。
例如:
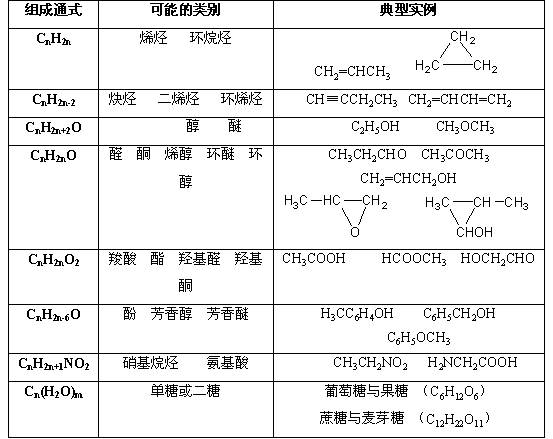
书写有机物的同分异构体时,一般情况下按照:
官能团位置异构→碳骨架异构→官能团类别异构
注意:芳香族化合物的同分异构体,取代基在苯环上的位置具有邻、间、对三种。
*立体异构:组成相同、结构相同,原子在分子中的排列状况不同而产生的异构体。
顺反异构:单键可以沿着碳碳键轴旋转,而双键不能沿着双键旋转。但是含双键的有机化合物不一定存在着顺反异构。
例如:CH2=CHCH3 无顺反异构,而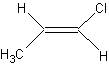 和
和 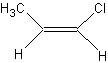 则是顺反异构。
则是顺反异构。
对映异构:有机物分子中的饱和碳原子上连接4个不同的原子或原子团时,可以有两种互为镜像,但不能彼此重合的四面体空间结构,这两种构型互为同分异构体。
这两种结构呈镜像关系,就仿佛人的左右手,看似相同,实则不能重合,我们把连有四个不同基团的碳原子形象地称为手性碳原子。
辨析比较:
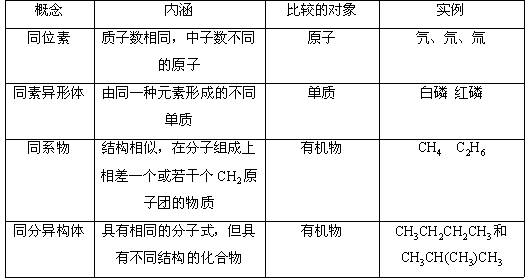
同位素 同素异形体 同系物 同分异构体 四个概念之间的关系
三、有机化合物结构与性质的关系
1、官能团与有机物性质的关系
一些官能团含有极性较强的键,如-OH,或者官能团中含有不饱和的碳原子,易发生相关的化学反应。
官能团与有机物性质的关系

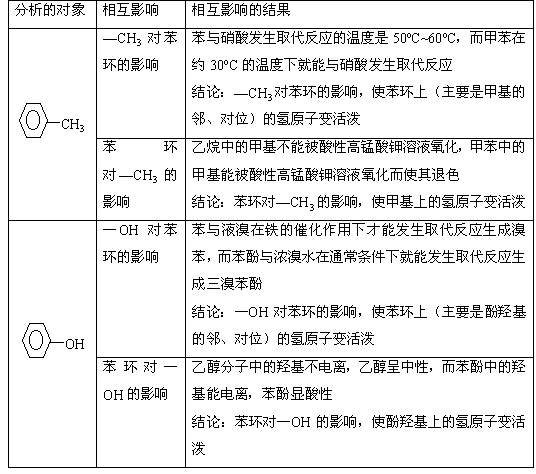
2、不同基团的相互影响与有机化合物性质的关系
由于推电基的推电作用或吸电基的吸电作用,使有机物分子中的邻近基团往往存在着相互影响,从而导致有机物表现一些特性。例如:
典型例题
例1. 描述H3C-CH=CH-C≡C-CF3分子结构的下列叙述中,正确的是( )
A. 6个碳原子有可能都在一条直线上
B. 6个碳原子不可能都在一条直线上
C. 6个碳原子有可能都在同一平面上
D. 6个碳原子不可能都在同一平面上
解析:由乙烯分子的构型可知原子团的结构为:
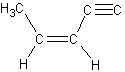 或
或 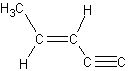
它的4个碳原子一定不在同一条直线上,而是在同一个平面上。 是直线型构型,2个碳原子与2个氢原子都在同一条直线上,所以
是直线型构型,2个碳原子与2个氢原子都在同一条直线上,所以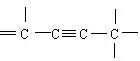 中4个碳原子也在一条直线上。
中4个碳原子也在一条直线上。
答案:BC
依据乙烯、乙炔分子的构型进行联想、迁移、归纳、综合就可得出结论。
例2. 已知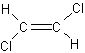 和
和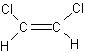 互为同分异构体(称作“顺反异构体”),则化学式为C3H5Cl链状的同分异构体共有( )
互为同分异构体(称作“顺反异构体”),则化学式为C3H5Cl链状的同分异构体共有( )
A. 3种 B. 4种 C. 5种 D. 6种
解析:①H3C-CH=CH-Cl ②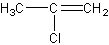 ③
③ 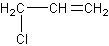
其中①又存在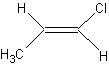 和
和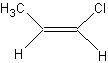 顺反异构体
顺反异构体
答案:B
注意不是所有的含双键物质都有顺反异构现象。
例3. 已知二甲苯有3种同分异构体,则四氯苯有________种同分异构体。
解析:四氯苯的苯环上有两个H,二甲苯的苯环上有两个甲基,则H和甲基的异构种类完全相同,又因二甲苯有3种同分异构体,故四氯苯也有3种同分异构体。
答案:3
熟悉由于苯环上位置不同带来的异构方式,同时要注意灵活迁移。
例4. 写出C6H14所有同分异构体的结构简式,写出分子式为C6H12的所有环烷烃的结构简式。
解答:烷烃:没有支链的: H3C-CH2-CH2-CH2―CH2-CH3
主链上少1个碳原子,支链上有1个甲基的: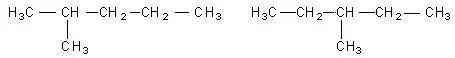
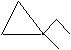
主链上少2个碳原子,支链上有2个甲基的:
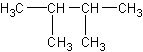 和
和 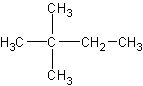
环烷烃:6个碳的环烷烃: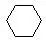 5个碳的环烷烃:
5个碳的环烷烃: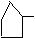
4个碳的环烷烃: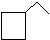
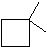
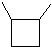
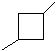
3个碳的环烷烃: 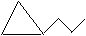
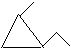
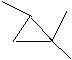
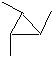
同分异构体的书写是一项重要技能,应该反复训练。
资源下载:
01.2020年4月各地高三理综化学模拟卷(180套)
02. 初、高中化学全部新课、复习教学视频分享!
03. 高三化学二轮复习全部微课+课件!
04.初中化学全册精品微课
05. 高考二轮复习资源包及高一、二同步习题集!
06. 高中化学必修1、2+选修3、4、5精品微课
07. 高中化学选修3知识点总结+学习资源
08.高中化学选修5知识点总结+学习资源
09. 高中化学必修2知识点总结+学习资源
10.高中化学学习资料大全+初、高中化学思维导图集合
11.高中化学各版本(人教版、鲁科版、苏教版)全套电子课本
12. 2020高考化学突破二轮复习(课件+教师用书+专题集训)
13. 高中化学必修1、2选修3、4、5名师课堂实录
14. 第七届全国中小学实验教学说课活动化学作品集
15. 高中化学新教材培训视频、教师用书、课件、等级性测试
16. 2019年高考各套化学试题和各地模拟题分类汇编
17. 三年高考(2017-2019)化学题分类汇编
18. 高中化学必备1000个flash动画
19. 高中化学学业水平考试复习课件
20. 2019高考全部九套试卷化学题答案+解析
21. 2019全国各地中考化学试卷(共180份打包)
22. 九年级化学说课稿、教案、导学案(上下册全套)
23. 高中化学公开课大赛课件、教学设计
24. 初高中化学衔接资料合集(教材+作业+学案+实验+课件)
25. 高中化学必修1、2+选修4说课稿、课件等
26. 2020届高考化学一轮复习课件学案练习课件(两套)
27. 各地2019届高三4月理综化学模拟卷精选
28. 各地2019届高三5月理综化学模拟卷精选
29. 各地2019届高三3月理综化学模拟卷精选
30. 2018全国同课异构总决赛高中化学冠军赛课件
31. 高中化学选修 + 必修共七册全部教案
32. 高中化学教材全部实验和模型视频!
33. 高中化学三版本各模块全套电子课本
 更多资源,点击
更多资源,点击




















 4421
4421











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








