 点击蓝字↑↑↑“微生态”,轻松关注不迷路
点击蓝字↑↑↑“微生态”,轻松关注不迷路

生科云网址:https://www.bioincloud.tech
编译:微科盟梦梦,编辑:微科盟居居、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
背景:益生菌在人类健康中发挥着至关重要的作用,已引起科学界和公众的广泛关注。人工智能(AI)与益生菌研究的整合,有望在菌株发现、健康结果和食品工业创新领域引发革命性变革。
方法:本综述探讨了人工智能与益生菌研究的交叉领域,重点关注通过AI驱动的机器学习模型革新菌株筛选、生物标志物预测和代谢物分析的技术进展。人工智能能够通过预测炎症性肠病和肠易激综合征等疾病的生物标志物,实现早期诊断和个性化营养干预。同时,AI可识别关键益生菌代谢物(如抗菌肽、胞外多糖和酚类化合物),推动发酵技术进步并增强益生菌功效。文中还讨论了该领域面临的挑战,包括数据质量、计算资源需求和实验验证等问题。
结论:相较于传统方法,人工智能展现出显著优势,能够实现快速高精度的菌株筛选、可扩展的大数据分析以及自动化的菌株优化。案例研究表明,AI模型在细菌鉴定中达到超过97%的准确率,并显著加速了代谢物发现进程。然而,数据质量参差不齐、计算成本高昂以及模型可解释性不足等挑战仍然存在。克服这些障碍将增强AI在精准营养、功能性食品开发和个性化医疗中的应用价值。本综述最后提出未来展望,强调人工智能在革新肠道微生物组研究和益生菌疗法方面的巨大潜力,为基于益生菌的精准治疗开辟新途径。

图文摘要
论文ID
原名:Synergizing Artificial Intelligence and Probiotics: A Comprehensive Review of Emerging Applications in Health Promotion and Industrial Innovation
译名:人工智能和益生菌的协同作用:对健康促进和产业创新中新兴应用的全面回顾
期刊:Trends in Food Science & Technology
IF:15.1
发表时间:2025.2
通讯作者:张文羿
通讯作者单位:内蒙古农业大学
DOI号:https://doi.org/10.1016/j.tifs.2025.104938
综述目录
1.前言
2 利用人工智能进行益生菌筛选和鉴定
2.1益生菌筛选标准
2.2 益生菌鉴定技术
2.3 人工智能,机器学习,深度学习
2.4 AI技术在益生菌筛选和鉴定中的应用
3 利用人工智能和益生菌促进肠道健康
3.1 人工智能驱动的肠道微生物群和人类疾病见解
3.2 AI支持的益生菌临床应用
3.3 AI用于疾病诊断和治疗
3.3.1 IBD和IBS的AI增强诊断
3.3.2 AI改善其他疾病的诊断
3.4 AI驱动的个性化营养干预
4 利用AI进行益生菌代谢物预测
4.1 抗菌肽发现中的AI
4.2 胞外多糖优化中的AI
4.3 酚类化合物研究中的AI
5 将AI整合到发酵产品创新中
6.未来展望
6.1 新兴研究方向
6.2 挑战和考虑因素
6.3 对益生菌行业和医疗保健的未来影响
7 结论
主要内容
1.前言
益生菌是一类活的微生物,当其以足量摄入时可为宿主赋予健康益处。这类微生物具有高度多样性,主要包括乳酸菌(Lactobacilli)、双歧杆菌(Bifidobacteria)和酵母菌(Saccharomyces)等菌属。随着全球对健康生活方式的日益重视,益生菌作为膳食补充剂和功能性食品已获得广泛普及,尤其受到健康意识较强的消费者群体及特定患者人群的青睐。大量基础研究与临床证据表明,益生菌具有促进肠道稳态的潜力,既能对胃肠道疾病产生治疗益处,也可对神经系统疾病发挥预防作用。
尽管益生菌行业蓬勃发展,仍存在重大挑战。当前菌株筛选技术主要依赖于耗时费力的体外实验。基因组学、代谢组学、蛋白质组学和表观基因组学等高通量组学技术的进步,已彻底革新了益生菌的鉴定与微生物组分析。然而,这些技术产生的数据复杂度与规模对充分挖掘其潜力构成了挑战,限制了我们批判性分析和解读海量数据集的能力。此外,益生菌功效具有菌株特异性和疾病特异性,而个体化因素(如饮食、年龄及微生物组构成)会导致异质性结果。这些挑战凸显了开发高质量、个性化益生菌菌株的必要性,以满足不同人群的精准需求。
人工智能(AI)已成为微生物组学领域的变革性工具,为解决上述挑战提供了新机遇。通过提升益生菌筛选的速度与精度,AI不仅实现了基因组数据的快速大规模功能分析,还为益生菌的开发和产业化开辟了新路径。例如,机器学习(ML)模型已识别出转移RNA序列信息是区分益生菌与肠道病原体的关键基因组特征,为创新性益生菌开发策略奠定了基础。这一突破既揭示了AI解析微生物功能的潜力,也确立了tRNA作为靶向益生菌研究新型生物标志物的价值。肠道微生物群在维持健康和调控疾病进展中具有核心作用。益生菌通过与肠道菌群密切互作,发挥增强肠道屏障功能、调节免疫系统、与病原体竞争营养及肠道结合位点的多重机制。其产生的抗菌代谢物可减轻抗生素副作用并改善宿主健康。此外,精神活性益生菌能够通过调控微生物-肠-脑轴,为神经性和代谢性疾病提供潜在治疗价值。这些特性使益生菌成为管理炎症性肠病、肠易激综合征、抗生素相关性腹泻及代谢综合征等疾病的前沿候选方案。人工智能通过精准识别肠道微生物群特征谱,进一步提升了益生菌的临床价值——其支持的个性化治疗方案可最大化益生菌疗效,为个体化医疗提供科学依据。
近期研究进一步专注于细菌代谢物在食品与人类健康领域的重要性,这为乳酸菌(LAB)在食品工业和制药行业的应用开辟了新方向。在众多代谢产物中,抗菌肽(AMPs)作为新一代抗菌剂脱颖而出,其独特优势在于能够对抗多重耐药菌且不会诱发耐药性风险。人工智能驱动的后生元筛选技术(如针对AMPs的筛选)显著加速了此类化合物的开发进程,实现了从多样微生物组中高通量挖掘功能性代谢物。与此同时,AI技术正在优化益生菌胞外多糖(EPS)的生产工艺,并通过提升酚类化合物(PCs)的合成水平,在提高生产效率的同时降低资源消耗。胞外多糖凭借其独特的生理活性与功能特性,正被探索作为药物载体以增强药物稳定性与生物利用度,为药物制剂研发提供了创新性解决方案。
人工智能正通过提升功能性食品与发酵益生菌产品的开发能力及品质,推动食品工业的革新。本综述重点阐述了AI在益生菌精准筛选领域的最新进展,尤其是在肠道微生物组研究中的应用突破。通过借助强大的计算工具解析复杂微生物组数据,AI为个性化疾病预防与治疗提供了科学依据。此外,本文还探讨了AI在功能性产品创新中的新兴应用场景,揭示其在食品工业中发挥的变革性作用。
2 利用人工智能(AI)进行益生菌筛选和鉴定
2.1 益生菌筛选标准
益生菌的分离来源广泛,涵盖粪便样本、土壤、发酵食品及果蔬等天然基质。依据国际权威机构制定的指导标准,潜在益生菌需接受严格的体外实验评估其功能特性。核心筛选指标包括:1) 胃酸耐受性;2) 胆盐水解酶活性及胆盐耐受能力;3) 肠道上皮细胞粘附与肠道定植能力;4) 对病原菌的潜在抑菌与拮抗效应。此外,候选菌株的安全性与有效性须通过动物实验和人体临床试验进行验证。
益生菌实现定植并发挥功能的前提是具备耐受胃酸环境的能力。例如,植物乳杆菌(Lactiplantibacillus plantarum)作为食品发酵领域广泛应用的益生菌,其高耐酸性显著提升了该菌株在胃肠道内的存活率与定植能力。胆盐水解酶活性是另一项关键筛选指标:此类由肠道菌群产生的酶通过代谢胆汁酸参与维持宿主稳态。胆盐水解酶活性在双歧杆菌与乳杆菌中尤为突出,尤其是从肠道或粪便样本中分离的菌株。肠道上皮细胞粘附能力则是益生菌成功定植的重要影响因素,增强的粘附特性不仅提高了益生菌在胃肠道内的存活率,更使其得以持续发挥有益健康效应。
除上述基础筛选标准外,针对具有独特健康益处的益生菌还需进行特定功能测试。例如,部分菌株展现出降胆固醇效应,而多菌株复合制剂的功效常优于单一菌株益生菌,这归因于菌株间的协同增效作用。其他功能性指标(如抗氧化能力、γ-氨基丁酸生成量及抗生素敏感性)亦需被评估,以确保对菌株特性进行全面表征。
2.2.益生菌鉴定技术
传统细菌鉴定方法高度依赖于表型特征分析,包括形态学与生化特性表征。在益生菌评估中,常通过表型特征分析(如酶谱分析、碳源利用分析、耐酸测试及细胞脂肪酸组成分析)进行功能评价。然而,微生物的庞大多样性与菌落形态的复杂性对传统方法构成了显著挑战:仅基于表型特征准确鉴定微生物分类需要深厚的专业知识储备,且过程通常耗时费力。这一局限性在区分形态相近菌株时尤为突出,尤其当采用传统微生物学方法在特定培养条件下进行鉴别时,其效率与准确性更受制约。
自动化表型鉴定系统(如API系统和VITEK 2系统)的问世标志着微生物鉴定领域的重大进步。近二十年来,光谱质谱技术的应用进一步革新了该领域——基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)、拉曼光谱与傅里叶变换红外光谱等关键方法显著提升了微生物鉴定的准确性与效率。然而,这些方法的有效性受制于物种差异与参考数据库的完备程度:现有数据库中部分细菌类群代表性不足,而培养条件差异、样品制备方法、光谱仪技术参数等技术因素也会影响鉴定准确性。此外,传统微生物培养方法无法培养不可培养菌种,这限制了对微生物多样性及其丰度的全面认知。此类方法通常步骤繁琐、耗时费力且成本高昂,所获样本往往难以反映微生物群落的真实组成特征。
为突破传统方法局限性,新型微生物检测技术应运而生,其中基因型鉴定方法逐渐占据主导地位。与表型鉴定不同,基因型技术基于微生物基因序列且无需依赖培养过程。微生物基因型在生长条件变化下仍保持稳定,只要获得纯菌落即可实现精准分析。基因型鉴定具有相对完备的数据库支持,兼具高效率、高通量、高精度等优势。脉冲场凝胶电泳、核糖体分型、单核苷酸多态性分析、多位点序列分型及全基因组测序等技术已被广泛应用于微生物鉴定。其中,16S rRNA基因作为常见鉴定靶标,存在于所有细菌与古菌中,其包含的九个高变区(V1-V9)为物种鉴别提供了遗传标记。近年来,全基因组测序因具备高分辨率与灵敏度,在菌株水平研究中日益普及,为深入解析微生物种群特征提供了技术支撑。微生物基因组注释技术的整合与已知益生菌基因组数据库的持续扩展,进一步强化了人类探索有益微生物多样性及其功能潜力的能力。
微生物培养与鉴定技术在疾病诊断、预防、治疗及科学研究领域仍具有不可替代的核心价值。现代微生物筛选技术正逐步采用"先筛选后培养"的创新策略,有效突破了传统培养方法的局限性。此外,人工智能与生物信息学工具的整合应用显著加速了微生物研究的数据分析进程,在检测速度、灵敏度及成本效益方面展现出显著优势。
2.3 人工智能,机器学习,深度学习
人工智能的核心目标是开发能够模拟人类思维与行为(如感知、推理、规划与预测)的智能系统。机器学习作为人工智能的专门化分支,而深度学习(DL)则是机器学习领域内的进阶技术方向(图1)。这些技术通过采用不同算法架构,显著提升了数据处理与信息解析能力,从而在运算速度、操作便捷性及结果准确性方面实现突破性提升。
 图1.人工智能、机器学习和深度学习之间的层次关系。在最广泛的层面上,人工智能(AI)包括模拟人类智能的技术,使机器能够执行认知任务。机器学习(ML)是AI的一个子集,开发算法,使计算机能够从数据中学习并随着时间的推移提高性能,而无需显式编程。深度学习(DL),作为机器学习的一个专门子集,它利用多层神经网络来分析大型数据集中的复杂模式,在图像和语音识别等任务中表现出色,并且通常优于传统的机器学习方法。此图说明了DL如何作为机器学习和人工智能中的高级技术,突出了它们的相互联系和计算智能的发展。
图1.人工智能、机器学习和深度学习之间的层次关系。在最广泛的层面上,人工智能(AI)包括模拟人类智能的技术,使机器能够执行认知任务。机器学习(ML)是AI的一个子集,开发算法,使计算机能够从数据中学习并随着时间的推移提高性能,而无需显式编程。深度学习(DL),作为机器学习的一个专门子集,它利用多层神经网络来分析大型数据集中的复杂模式,在图像和语音识别等任务中表现出色,并且通常优于传统的机器学习方法。此图说明了DL如何作为机器学习和人工智能中的高级技术,突出了它们的相互联系和计算智能的发展。
机器学习的工作流程(图2a)可分为监督学习与无监督学习两大类别,二者在肠道微生物组分析中均有广泛应用。监督学习需要预先标记的数据集来训练算法,使模型能够基于历史数据中提炼的规律生成预测结果。该方法强调依托已有信息对新数据进行分类与回归分析:分类模型用于预测不同类别标签,回归模型则用于估算数值型结果。该领域常用技术包括决策树、规则学习、基于实例的学习、遗传算法、人工神经网络、朴素贝叶斯分类器、随机森林、纵向回归及支持向量机等。这些技术通过迭代建模不断优化模型在特定任务中的性能表现。相比之下,无监督学习算法则通过分析无标签数据集自主推导预测结果。其核心算法包括降维方法与聚类分析:降维方法(如主成分分析、主坐标分析及t-分布随机邻域嵌入)广泛应用于从高维特征空间提取关键变量以实现组学数据可视化;聚类方法(如k均值聚类与层次聚类)则依据对象间的相似性或差异性将其归入特定群组。当前,无监督聚类技术已被用于微生物组数据分析以探索人类肠道菌群特征。机器学习的算法模型及其潜在未来应用方向可分别参考图2b与图2c。
 图2.机器学习在益生菌筛选和开发中的工作流程和潜在应用。(a)流程图说明了开发机器学习预测模型的过程。最初,检索和预处理数据,包括数据清理,通过修改,更新或从原始数据集中删除有问题的条目来识别和纠正错误。接下来,进行特征选择,使用适当的算法将原始数据转换为相关特征。这导致生成最合适的预测模型。性能评估通过混淆矩阵等方法评估训练的ML模型的准确性和灵敏度,受试者工作特征(ROC)分析,包括曲线下面积(AUC)、均方根误差(RMSE)和交叉验证。最后,评估模型的可解释性。(b)用于开发预测模型的不同ML算法,包括线性回归、逻辑回归、k-最近邻(KNN)算法、决策树、深度神经网络(DNN)、随机森林、支持向量机(SVM)、朴素贝叶斯分类器、主成分分析(PCA)和k均值聚类。(c)该模型在益生菌研究中的潜在应用方向包括:益生菌精准筛选、微生物群落分析、基于临床数据的预测性AI建模以及益生菌产品创新。
图2.机器学习在益生菌筛选和开发中的工作流程和潜在应用。(a)流程图说明了开发机器学习预测模型的过程。最初,检索和预处理数据,包括数据清理,通过修改,更新或从原始数据集中删除有问题的条目来识别和纠正错误。接下来,进行特征选择,使用适当的算法将原始数据转换为相关特征。这导致生成最合适的预测模型。性能评估通过混淆矩阵等方法评估训练的ML模型的准确性和灵敏度,受试者工作特征(ROC)分析,包括曲线下面积(AUC)、均方根误差(RMSE)和交叉验证。最后,评估模型的可解释性。(b)用于开发预测模型的不同ML算法,包括线性回归、逻辑回归、k-最近邻(KNN)算法、决策树、深度神经网络(DNN)、随机森林、支持向量机(SVM)、朴素贝叶斯分类器、主成分分析(PCA)和k均值聚类。(c)该模型在益生菌研究中的潜在应用方向包括:益生菌精准筛选、微生物群落分析、基于临床数据的预测性AI建模以及益生菌产品创新。
深度学习作为机器学习与人工智能领域的重要分支,其核心特征是采用受人工神经网络(ANN)启发的算法,通过多层互连的神经元结构处理信息。自20世纪90年代末,随着卷积神经网络(CNN)等多种神经网络算法的兴起,深度学习模型开始系统性发展。多数深度学习算法基于人工神经网络架构构建,可适用于监督学习与无监督学习两种模式,并在图像识别、自然语言处理等应用场景中展现出显著优势。
2.4 AI技术在益生菌筛选和鉴定中的应用
微生物组研究已取得显著进展,其快速发展主要得益于微生物测序技术的进步。高通量测序技术产生了海量基因组数据,推动建立了益生菌及其他乳酸菌(LAB)的大规模基因组数据库。传统益生菌筛选方法通常成本高昂且耗时费力,但随着大数据时代的到来,各类创新技术不断涌现并逐步整合至现代微生物研究中。机器学习(ML)、深度学习(DL)、神经网络等技术的突破性进展拓宽了人工智能在微生物组研究中的应用范畴,而大数据分析技术的进步为此提供了进一步支撑。
温度对微生物生长具有显著影响,而确定最适生长温度(OGT)是培养传统不可培养菌种的关键。机器学习模型已成功应用于基于基因组序列预测古菌与细菌的OGT,以及通过细菌、古菌和真核生物蛋白质组的二聚体氨基酸组成推断OGT。该领域的重要工具CnnPOGTP是一种基于深度学习的微生物OGT预测器,仅需利用基因组序列的k-mer分布即可实现预测。该工具无需预先注释基因组信息,用户通过CnnPOGTP网站提交基因组序列即可获取预测结果。此类预测工具对于从极端环境(如嗜冷菌与嗜热菌)中分离微生物具有重要价值,同时也为益生菌筛选提供了理论依据。此外,机器学习模型还可用于在具有抗菌特性的潜在益生菌乳酸菌中筛选具有生物防治应用价值的益菌株。
基于人工智能的宏基因组数据分析擅长识别大规模数据的复杂模式,使训练有素的模型能够生成精准预测结果。为深化对各类环境中微生物多样性及功能的理解,研究者开发了名为CheckM2的先进机器学习方法,用于预测宏基因组组装基因组(MAGs)的质量。此外,通过机器学习分析益生菌基因组可识别与有益功能相关的基因。例如,研究者曾采用四种机器学习算法(包括神经网络、支持向量机、广义线性模型及随机森林模型),基于DNA特征精准鉴定益生菌。其中神经网络算法表现最优,在区分益生菌与非益生菌时准确率超90%。同年开发的在线生物信息学工具iProbiotics(http://bioinfor.imu.edu.cn/iprobiotics/public/Home)利用机器学习算法,从现有全基因组测序数据中预测乳酸菌各类益生特性的功能基因。该工具创新性地基于k-mer特征构建支持向量机预测模型,结合全基因组寡核苷酸组成特征分析,实现了菌株水平的候选益生菌预测。
iProbiotics工具允许用户将分离菌株的基因组序列提交至数据库,预测该菌株成为益生菌的可能性。然而,iProbiotics存在一定局限:尽管可对完整基因组进行预测,但其对宏基因组草图基因组的效果尚未明确。为突破此限制,新型益生菌预测工具metaProbiotics应运而生——该工具采用自然语言处理技术与新型计算方法,可快速检测宏基因组数据中的益生菌组分。这种方法规避了传统方法(如依赖繁琐实验室研究与临床试验)的局限性,为微生物群落中益生菌的特性表征提供了更高效、系统化的解决方案。此外,metaProbiotics在物种水平的跨物种预测中展现出强大的分辨能力:以乳杆菌属为例,研究者评估了metaProbiotics对同一属内不同物种益生菌的预测能力,测试集中乳杆菌属组分的曲线下面积(AUC)达到94.31%。总体而言,人工智能在预测特定菌株对肠道菌群的影响及识别可改善肠道微生物群落平衡的菌株方面展现出巨大潜力。
图像分析人工智能(IAAI)作为新兴技术工具,在微生物研究的图像分析与筛选领域展现出巨大潜力。例如在细菌菌落检测中,IAAI可通过分析培养皿照片实现自动化识别,大幅缩短人工检视微生物所需时间。该技术既能减少主观判断偏差,又可提升微生物生长状态判读的准确性。随着人工智能、自动化技术与机器人学的快速发展,自动化菌落工作站正引领益生菌研究进入新时代——此类工作站可全流程自动化完成微生物菌落培养皿的转移、开盖、挑取、涂布、移液及计数等操作流程。菌落形态评估在初筛过程中同样至关重要:IAAI的效果已在常规细菌学自动化设备中得到验证,其能够从超过10万块琼脂平板的图像中识别耐万古霉素肠球菌菌落。除菌落形态外,AI在细菌鉴定领域亦发挥关键作用。值得关注的是,《细菌物种数字图像》数据集收录了涵盖33个菌种的660张图像,通过采用卷积神经网络进行特征提取,构建的计算机辅助细菌分类系统实现了97.24%的高精度鉴定。该系统还整合支持向量机与随机森林算法对微生物图像纹理进行解析分类,进一步提升了鉴定精确度。
为进一步加速微生物鉴定流程,用户友好的网络化机器学习建模工具Teachable Machine®应运而生,该工具旨在实现微生物实验室中分离的肠道微生物与非发酵菌的快速、低成本鉴定。传统从复杂微生物生态系统中分离单一菌种的方法通常耗时费力、难以规模化,且存在表型与基因型信息割裂的缺陷。为解决这些挑战,开源型高通量机器人菌株分离平台CAMII应运而生:该平台可按需高效生成微生物分离物,利用机器学习技术基于菌落形态与基因组数据最大化分离微生物多样性,并促进特定菌属的靶向筛选。CAMII具备每小时处理2,000个菌落、单次最大处理量达12,000个菌落的作业能力,其工作效率较人工菌落分选提升逾20倍。
此外,研究者已建立一套针对16S rRNA与全单细胞基因组的低成本高通量测序流程,其完整操作流程成本仅需7.28美元,显著低于商业化测序方案。面对全球日益严峻的抗生素耐药性公共卫生问题,显微图像数据被用于构建机器学习工具以识别抗生素耐药性相关模式。通过将细菌图像数据输入多种机器学习算法训练模型,系统可识别区分耐药菌与敏感菌的关键特征。结果显示,该系统在区分环丙沙星耐药菌与敏感菌时达到约87%的准确率。值得注意的是,即使在无抗生素暴露条件下,耐药菌与敏感菌仍呈现差异化视觉特征,使得AI能够捕捉此类差异。该算法仅需对培养6小时的菌株进行分析即可判定其对环丙沙星的敏感性,相较传统方法大幅缩短检测周期。检测结果可在数小时内获取,有助于改善临床疗效并遏制耐药菌传播。总体而言,AI通过解析海量细菌图像数据,实现了菌种快速精准鉴定与分类,在提升鉴定效率与准确性的同时显著降低人为误差风险。
此外,人工智能可通过将机器学习算法与光谱成像技术结合,快速精准识别商业数据库中常难以区分的微生物菌株。2020年,研究者提出了一种结合卷积神经网络(CNN)与拉曼光镊技术的方法,可在细胞水平实现微生物的快速精确鉴定,对不同微生物物种的区分达到高精度。相关研究中开发的自动分选系统EasySort AUTO,采用基于AI的目标检测模型进行细胞表型筛选。该系统通过跨界面接触式单细胞输出方法,对单个微生物细胞进行分类,随后将其封装至微液滴中,并以精确索引的"单细胞单管"模式自动导出。基于AI的目标检测模型可在混合样本中高精度识别目标细胞,自动化流程的准确率高达80%。
基于此,研究者开发了一种无需培养、单细胞分辨率的"表型-基因组联合策略"(整合单细胞鉴定、活力与生存力检测及溯源追踪技术),用于快速评估益生菌产品质量。该策略较传统方法效率提升逾20倍、成本降低超10倍,具备活力可视化、异质性解析及自动化兼容等优势。近期,针对乳酸菌(LAB)种与亚种的快速鉴定,研究者基于机器学习模型构建了参考拉曼光谱数据库。此外,质谱技术与机器学习的融合亦被证实为菌株鉴定的有效手段:例如通过结合机器学习与基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)数据,可成功区分食物魏斯氏菌(W. cibaria)与混杂魏斯氏菌(W. confusa)这两个关键物种。该方法不仅能分类近缘菌种,更提升了微生物鉴定的准确性。结合MALDI-TOF MS技术,机器学习还可快速精准区分长双歧杆菌(Bifidobacterium longum)的两个婴儿亚种——婴儿亚种(subsp. infantis)与长亚种(subsp. longum),这对产品开发与质量控制具有重要价值。
当前,人工智能在基因组分析、高通量筛选、代谢组学等领域的相关研究具有深远意义。尤其在益生菌筛选与开发领域,AI展现出高效性、精准性及个性化等核心优势。这一技术革新可大幅提升研发效率、降低开发成本,最终推动益生菌产业创新并促进其高质量发展。
3 利用人工智能和益生菌促进肠道健康
3.1 人工智能驱动的肠道微生物群和人类疾病见解
肠道微生物组在人类健康中扮演着至关重要的角色,其功能涵盖营养物质的消化吸收、免疫系统调控、肠道屏障完整性维护以及多种生物活性物质的代谢过程。这些功能显著影响宿主的生理状态及疾病发生风险。然而,肠道微生物组易受多种因素影响而失衡,导致其无法有效发挥健康促进作用。人工智能技术的出现为肠道微生物组研究提供了新机遇——其高效处理与分析海量微生物组数据的能力,可精准揭示与健康和疾病相关的微生物特征谱。微生物组工程通过设计、改造与调控微生物群落,优化肠道微生物多样性并恢复其平衡状态,促进有益微生物的定植优势。这一技术路径不仅深化了对微生物组功能的理解,更为疾病预防与个性化健康管理提供了创新解决方案。
高通量测序技术的出现显著推动了微生物组研究的进步。然而,传统分析方法在数据获取与解析方面常显力不从心,主要依赖t检验与方差分析等统计学方法。这些传统技术在处理高维度、稀疏且复杂的数据集(如真菌群落数据)时存在明显不足,且难以识别精确的真菌群落生物标志物。此外,传统方法在从微生物组数据集中提取功能信息(尤其是针对序列短、多样性高、相似性低的功能肽表征)时,可能受限于实验手段与生物信息学方法。人工智能技术的兴起有效解决了上述问题,使得微生物组功能研究更高效精准。AI技术(尤其是机器学习与深度学习)能够处理复杂数据集,并通过自动化特征提取与模式识别提升数据处理效率。同时,AI借助数据增强与无监督学习策略应对数据量不足的挑战,为微生物组研究提供了创新性解决方案。
人工智能技术能够构建复杂模型以阐明微生物与宿主间的动态互作关系。例如,通过分析肠道菌群特征的机器学习算法,可精准预测个体对体力活动的血糖反应,从而指导个性化健康管理策略的制定。AI技术整合网络可视化手段,可深入探索饮食对肠道生态系统的影响,并识别与特定疾病或健康状态相关的微生物标志物。基于粪便微生物组分析构建的多分类诊断模型已被开发用于诊断结直肠癌、心血管疾病与糖尿病等多种疾病。人工智能不仅提升了疾病诊断的准确性,还通过机器学习模型结合高通量实验筛选识别出新型疾病治疗药物,为个性化医疗奠定重要基础。
3.2 AI支持的益生菌临床应用
益生菌在维护肠道健康中发挥着关键作用,其核心机制在于调节肠道微生物群落结构。研究证实其可通过增强肠道黏膜屏障功能、平衡肠道菌群稳态、缓解炎症反应等途径,有效缓解炎症性肠病(IBD)与肠易激综合征(IBS)等肠道疾病症状。此类益生菌能够提升肠道有益微生物的比例,从而优化肠道微生态环境。此外,益生菌通过产生短链脂肪酸等代谢产物,在增强肠道屏障功能、降低氧化应激水平、调控免疫应答等方面发挥重要作用,持续维护胃肠道健康。日益增多的证据表明,肠道菌群结构改变与IBD的发病机制密切相关。IBD的免疫病理机制及其潜在益生菌干预策略如图3所示。
 图3. 炎症性肠病的免疫致病机制与益生菌的潜在效益。益生菌与肠道共生菌协同,通过与宿主建立互利关系,促进黏膜免疫系统的发育、成熟与调控,同时抑制结肠内致病菌。益生菌及其代谢物可通过直接作用或间接调节内源性菌群及免疫系统影响肠道功能。炎症性肠病(IBD)以肠上皮屏障改变及炎性细胞浸润肠黏膜为特征,引发细胞因子、趋化因子、活性氧(ROS)与一氧化氮(NO)释放。克罗恩病中,由转录因子信号转导及转录激活因子4(STAT-4)与T-box转录因子(T-bet)介导的辅助性T细胞(Th)1型免疫反应占主导,导致干扰素-γ(IFN-γ)、白细胞介素(IL)-12与肿瘤坏死因子-α(TNF-α)水平升高。而溃疡性结肠炎则呈现非典型Th2型免疫反应,由转录因子STAT-6与GATA结合蛋白3(Gata-3)驱动,引发IL-4、IL-5与IL-13产量增加。两种疾病均存在Th17细胞异常活化及效应细胞与调节性T细胞(Treg)亚群间失衡现象,Treg细胞数量减少导致疾病活动期免疫调控不足。AMPs:抗菌肽;APC:抗原呈递细胞;B cells:B淋巴细胞;BAs:胆汁酸;IgA:免疫球蛋白A;(OONO-):过氧亚硝酸阴离子;SCFAs:短链脂肪酸。
图3. 炎症性肠病的免疫致病机制与益生菌的潜在效益。益生菌与肠道共生菌协同,通过与宿主建立互利关系,促进黏膜免疫系统的发育、成熟与调控,同时抑制结肠内致病菌。益生菌及其代谢物可通过直接作用或间接调节内源性菌群及免疫系统影响肠道功能。炎症性肠病(IBD)以肠上皮屏障改变及炎性细胞浸润肠黏膜为特征,引发细胞因子、趋化因子、活性氧(ROS)与一氧化氮(NO)释放。克罗恩病中,由转录因子信号转导及转录激活因子4(STAT-4)与T-box转录因子(T-bet)介导的辅助性T细胞(Th)1型免疫反应占主导,导致干扰素-γ(IFN-γ)、白细胞介素(IL)-12与肿瘤坏死因子-α(TNF-α)水平升高。而溃疡性结肠炎则呈现非典型Th2型免疫反应,由转录因子STAT-6与GATA结合蛋白3(Gata-3)驱动,引发IL-4、IL-5与IL-13产量增加。两种疾病均存在Th17细胞异常活化及效应细胞与调节性T细胞(Treg)亚群间失衡现象,Treg细胞数量减少导致疾病活动期免疫调控不足。AMPs:抗菌肽;APC:抗原呈递细胞;B cells:B淋巴细胞;BAs:胆汁酸;IgA:免疫球蛋白A;(OONO-):过氧亚硝酸阴离子;SCFAs:短链脂肪酸。
人工智能技术与益生菌临床应用的整合为个性化治疗与高效菌株筛选提供了创新路径。研究者开发了集成机器学习算法的智能肠道芯片系统,用于益生菌菌株的高通量筛选。该系统通过模拟肠道微环境评估不同菌株与宿主细胞的互作效应,并借助无监督机器学习算法识别菌株间细微的疗效差异。例如,长双歧杆菌3-14(Bifidobacterium longum 3-14)在体外与体内实验中均展现出缓解肠道炎症、增强上皮屏障功能的显著效果。该技术不仅为益生菌筛选提供了新型体外评价平台,更突破了传统方法的技术瓶颈,有力推动了功能性益生菌的研发进程。此外,AI与纳米技术的结合被用于设计与优化益生菌-益生元复合纳米杂化物:通过机器学习算法解析代谢物生成与利用效率,促进开发更具稳定性的纳米制剂,从而提升益生菌的生物利用度与靶向递送效率。最新研究采用深度学习技术预测个体对膳食干预的代谢物响应特征,构建了基于耦合多层感知器的代谢物响应预测模型,为开发微生物组导向的个性化营养策略、推动精准营养学发展提供了方法学支持。与此同时,通过AI技术分析肠道微生物组数据发现,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)补充剂的功效与个体肠道菌群基线丰度存在强相关性,这为制定个性化益生菌干预方案提供了重要科学依据。
益生菌与药物的策略性联用可协同提升疗效、减轻药物副作用并调控肠道菌群,从而优化整体健康管理效果。在2型糖尿病管理中,益生菌与二甲双胍等常规药物联合应用可显著降低患者空腹血糖、餐后2小时血糖及糖化血红蛋白水平。该联合疗法通过增加肠道有益菌(如乳杆菌属、双歧杆菌属)丰度,同时抑制潜在有害菌(如肠杆菌科、肠球菌属)增殖来重构菌群结构。此外,研究证实该方案可降低慢性炎症水平并改善胰岛素敏感性,其综合疗效优于二甲双胍单药治疗。针对溃疡性结肠炎(UC),益生菌与中药联合治疗方案较单一疗法更具优势:其通过协同抑制炎症反应、降低疾病复发率、提升患者生活质量,为UC管理提供了新策略。
人工智能技术的应用为优化联合治疗策略提供了新思路。机器学习模型可定量评估纳米酶的抗氧化性能、酸稳定性、Zeta电位等可量化特性,通过与高通量筛选技术结合,还能评估肠道屏障修复效应与生物安全性等不可量化属性。这种协同策略加速了治疗溃疡性结肠炎(UC)的有效纳米酶的发现进程。在癌症治疗领域,AI技术通过解析临床试验数据与分子生物标志物,优化抗体-药物偶联疗法的治疗效果,其通过提升靶向癌细胞能力并减少副作用,为患者带来更优预后。
3.3 AI用于疾病诊断和治疗
大数据时代,通过测序、代谢组学、转录组学等技术开展的肠道微生物组研究产生了海量且复杂的数据集。分析与解读这些大规模数据需要借助机器学习(ML)的精确性与灵活性,以有效识别数据模式并提取有价值的信息。因此,机器学习已成为管理肠道微生物组数据集群不可或缺的工具。深度学习(DL)与机器学习在疾病诊断、治疗及精准医疗促进中的应用正日益凸显其重要性(图4)。这些技术使临床医生能够从复杂数据集中获取可操作的深刻洞见,从而提升疾病诊断与治疗水平,并为临床决策制定提供坚实基础(表1)。
 图4.人工智能(AI)在疾病诊断、治疗、检测和精确治疗中的潜在应用。ANN,人工神经网络; CNN,卷积神经网络; CT,计算机断层扫描; MRI,磁共振成像; NPL,自然语言处理; SVM,支持向量机。
图4.人工智能(AI)在疾病诊断、治疗、检测和精确治疗中的潜在应用。ANN,人工神经网络; CNN,卷积神经网络; CT,计算机断层扫描; MRI,磁共振成像; NPL,自然语言处理; SVM,支持向量机。
表1 人工智能(AI)在肠道微生物组相关疾病中的应用



3.3.1 IBD和IBS的AI增强诊断
生物标志物在监测疾病进展中的应用对有效管理疾病至关重要。例如,粪便钙卫蛋白、抗酿酒酵母抗体与抗中性粒细胞核周抗体等生物标志物在克罗恩病与溃疡性结肠炎的鉴别诊断中具有重要价值。然而,由于遗传与环境因素的复杂交互作用,理想的单一生物标志物仍难以确定。随着代谢组学在临床实践中的广泛应用,其已成为发现复杂代谢标志物的重要工具:基于人工智能的代谢组学数据建模有助于识别潜在代谢生物标志物,助力实现更精准的疾病诊断与治疗。此外,机器学习模型(尤其是随机森林算法)在预测炎症性肠病方面展现出高精度,其曲线下面积(AUC)超90%。
值得注意的是,由于肠道微生物物种命名体系具有动态演变特性,仅通过检测物种丰度可能无法精准反映微生物功能特征。这一局限性促使科学研究专注于微生物基因及其多态性所蕴含的诊断潜力。为填补该研究空白,研究者基于物种、基因及微生物单核苷酸变体(SNV)鉴定出具有高度通用性与可靠性的克罗恩病诊断生物标志物。依托这些研究成果,学界持续探索肠道微生物组在IBD诊断中的应用潜力:通过采用粪便样本16S rRNA测序数据构建随机森林预测模型,解析肠道菌群特征以区分IBD患者与健康人群。该模型实现91%的高AUC值,而基于前500个高变异操作分类单元(OTU)构建的优化模型AUC值进一步提升至92%。
新兴研究揭示了肠道菌群与代谢疾病及膳食摄入间的关联性,而膳食摄入对宿主代谢具有显著调节作用。人工智能识别的IBD相关代谢物可能与膳食差异存在相关性,因为营养物质调控着体内多种代谢过程。尽管既往研究已探索饮食与IBD的关联,但IBD患者饮食与代谢间的直接互作机制仍待深入解析。一项研究通过代谢组学与可解释人工智能技术,整合分析英国生物样本库与人类微生物组计划数据,鉴定出血浆与粪便中的关键代谢物。结果显示,相较于血浆代谢物(AUC=74%),粪便代谢物展现出更强的预测能力(AUC=93%)。这些发现不仅验证了已知关联,更揭示了IBD对肠道菌群与饮食互作的影响。为深入解析不同消化系统疾病中肠道微生物的普适性调控规律,该研究方法被拓展至肠易激综合征(IBS)分析:通过整合全基因组宏基因组测序与非靶向粪便代谢组学分析,发现IBS患者存在菌群-代谢轴系统性紊乱,其特征表现为普氏梭杆菌(Flavonifractor plautii)、毛螺菌科细菌(Lachnospiraceae bacterium)等关键菌种丰度异常,同时伴随次级胆汁酸与甾醇代谢通路的显著失调。通过筛选27个具有高区分度的菌群-代谢联合特征,构建的随机森林模型可高效区分IBS患者与健康人群,其AUC达93%、准确率达80%。日益增多的证据支持机器学习通过肠道菌群分析识别IBS患者的应用价值,其中粪便短链脂肪酸作为非侵入性生物标志物,在排除性诊断中展现出可靠的区分效果。
尽管在肠易激综合征(IBS)患者肠道菌群中可观察到显著改变,但迄今尚未建立具有一致性的微生物组模式。现有IBS研究结果存在显著异质性,这种差异可归因于多种因素:肠道菌群分析技术的多样性、菌群组成的个体化差异、研究纳入标准不一致以及样本量参差不齐。这些挑战凸显了鉴定IBS相关可靠微生物标志物的难度,同时也强调需要基于大规模、高质量特征化队列开展严谨研究,以验证IBS症状与微生物组特征间存在的关联并建立可复现的关联性结论。
3.3.2. AI改善其他疾病的诊断
日益增多的证据表明,肥胖与心血管疾病(CVD)等代谢异常状态与肠道微生物组的结构改变存在密切关联。一项针对10项研究的荟萃分析首次采用机器学习方法系统探究肠道菌群对肥胖的影响。益生菌干预可通过重塑肠道菌群组成,进而改善宿主代谢水平、缓解炎症反应、增强免疫功能并强化肠道屏障作用。人工智能通过整合多组学数据,可全面解析肠道菌群的功能动态及其对宿主代谢的调控效应。这些先进技术不仅有助于识别与肥胖相关的微生物标志物,更为制定个性化营养策略、推进精准健康管理奠定基础。例如,机器学习模型已证实其在精准识别肥胖相关微生物标志物及预测长期减重成功率方面的有效性。
尽管将肠道微生物组数据与人工智能结合用于疾病风险预测已成为常见方法,但其在心血管疾病(CVD)领域的应用仍相对有限。益生菌通过调控肠道菌群可改善脂质代谢,降低血清胆固醇与甘油三酯水平:特定菌株如罗伊氏粘液乳杆菌CCFM8631(Limosilactobacillus reuteri CCFM8631)已被证实可降低血浆总胆固醇与低密度脂蛋白胆固醇水平,从而预防动脉粥样硬化性心血管疾病。值得关注的是,AI基于粪便菌群组成特征在心血管疾病的诊断与筛查中展现出巨大潜力。通过分析菌群组成特征,人工智能可区分心血管疾病患者与非患者。此外,AI能够整合基因信息、电子健康档案、影像数据等异质性多源数据,预测个体患者对特定益生菌的响应特征。例如,机器学习算法可被训练用于预测益生菌对心血管健康指标的影响。在心血管疾病诊断方面,AI通过解析复杂心电图数据识别临床医生难以察觉的细微变化,提升心力衰竭与心房颤动等疾病的诊断准确性;同时优化计算机断层扫描、超声心动图等影像学检查效率,精准评估心脏功能并通过患者分层优化个体化治疗方案。展望未来,机器学习算法可通过模拟益生菌菌株与益生元等其他有益基质的组合效应,筛选最能有效降低心血管疾病风险因子的最优组合,最终推动开发更具靶向性心血管健康补充剂。
人体流行病学研究与动物模型实验证实,肠道菌群可能在自闭症谱系障碍(ASD)的发病机制中发挥作用。已知益生菌通过增强肠道屏障功能、降低肠道通透性,可限制脂多糖等外源性组分进入血液循环系统,从而可能减轻中枢神经系统的炎症反应。人工智能技术可用于解析肠道菌群对多种精神障碍与神经系统疾病的潜在影响机制。
3.4 AI驱动的个性化营养干预
个性化营养作为一种新兴医疗模式,通过整合个体特征(如年龄、胰岛素敏感性、肠道菌群组成)制定定制化营养建议,旨在促进饮食行为向长期有益方向转变。例如,基于个体特征参数设计的个性化益生菌配方,可针对性地满足个体特定需求,有效改善肠道炎症状态并缓解腹部不适症状。
个性化营养的潜力在炎症性肠病(IBD)与肠易激综合征(IBS)管理中体现尤为显著。专注抗炎饮食的临床试验可系统识别有效缓解肠道炎症的食物类型,从而为IBD患者提供科学依据支撑的营养干预方案。例如,机器学习技术被用于基于患者的基因特征、生活习惯及肠道菌群组成制定个性化膳食建议。这种多维视角综合考虑膳食摄入、肠道菌群与宿主健康间的互作关系,其核心目标在于促进有益菌增殖的同时,维持肠道菌群多样性及生态平衡。
宏基因组指导的营养干预通过恢复肠道菌群平衡状态,在缓解肠易激综合征(IBS)症状方面展现出显著疗效。此类干预可通过两种机制发挥作用:补充肠道共生菌群缺失组分或激活现有菌群特定功能模块,从而恢复或部分恢复菌群功能完整性并缓解相关症状。当前益生菌研究面临的核心挑战在于缺乏精准且实用的胃肠道动态模型。为解决该问题,研究者开发了人工胃模拟肠道模型系统ABIME(A Bioreactor Imitation of the Microbiota Environment),该创新模型结合机器学习工具,用于预测益生菌配方的代谢活性并评估其治疗潜力。通过该模型系统,临床医生可预测并评估不同益生菌配方对特定胃肠道疾病的治疗效果,辅助选择最优治疗方案,在提升治疗成功率的同时减少无效尝试。
人工智能驱动的合成生物学技术的兴起为提升益生菌的治疗与营养效能提供了新方向。基于成簇规律间隔短回文重复序列(CRISPR)相关Cas2蛋白系统的精准修饰技术,可对益生菌进行定向改造,赋予其诊断、治疗与营养功能。这一技术革新有望将人类肠道转化为有益菌储存库,显著增强机体免疫力、消化功能、认知水平及整体健康状态。随着此类技术的持续演进,其将有力支撑胃肠道健康研究,推动开发靶向性益生菌与微生物组疗法。AI强大的数据分析能力结合益生菌的生物调控效应,可为患者提供更个性化、更具疗效的营养干预方案。
人工智能通过应用统计模型、机制模型及混合型AI模型,在构建"微生物-营养-健康"轴模型方面取得重要进展。这些模型可预测患者对特定膳食、益生元及益生菌干预的响应特征,为个性化营养策略提供科学依据。此外,元蛋白质组学技术与人工智能、机器学习算法的整合为筛选有益益生菌微生物提供了强大工具:这种协同作用既提升潜在益生效应的预测准确性,又促进针对特定疾病或健康状态的新型候选益生菌的发现。该技术体系还支持以调控肠道菌群为目标的益生菌疗法的理性设计,满足日益增长的个性化医疗需求。
随着生物传感器技术的进步,其与人工智能的融合正在彻底变革医疗领域。人工智能驱动的生物传感器能够实时监测患者的健康状况并提供个性化治疗建议。这些先进设备可实时解析肠道微生物组与代谢物数据,并通过深度学习算法优化治疗方案。配备AI的智能可穿戴设备能够监测心率、血糖水平等生理参数,为用户提供及时的健康预警。有研究者开发了一种表皮电生理传感器电极的创新设计方法,推动了在佩戴舒适性与移动性方面表现卓越的优化传感器的研发,使其能够快速测量肌电图、皮肤电活动、心电图等多种生物信号。例如PhysioSkin方法为可无缝融入人体的新一代生理设备快速制造开辟了新路径,此类设备在医疗监测、人机交互等领域具有广泛应用潜力。人工智能与生物传感器技术的协同发展正推动精准医学进步——AI赋能的生物传感器通过整合分析基因组、蛋白质组与代谢组数据,实现疾病的早期检测与个性化治疗策略的制定。
随着生物技术与信息科学的深度融合,人工智能(AI)与机器学习(ML)正在重新定义人类对肠道微生物组的认知与应用方式。通过益生菌补充干预,AI为心血管疾病、肥胖、糖尿病、免疫系统疾病及神经系统疾病等多种疾病的管理提供了前所未有的可能性。AI强大的分析能力将推动医疗实践迈入个性化新时代——高度定制化的益生菌疗法不仅基于个体微生物组特征与遗传背景设计,更整合了生活方式与环境因素的综合考量。这种医疗模式有望提升治疗效果、减少副作用,确保医学干预的精准性与高效性。
4.利用AI进行益生菌代谢物预测
人工智能技术在益生菌代谢产物研究中正变得日益重要,其核心价值在于着重解析益生菌代谢产物及其生理功能(图5)。生物信息学的最新进展已能使研究者预测不同益生菌菌株合成次级代谢产物的能力,这些代谢产物具有显著的医学与工业应用潜力。特别值得关注的是抗菌肽(AMPs)与胞外多糖(EPS)等关键代谢产物,二者对维持肠道健康与支持免疫功能具有重要作用。
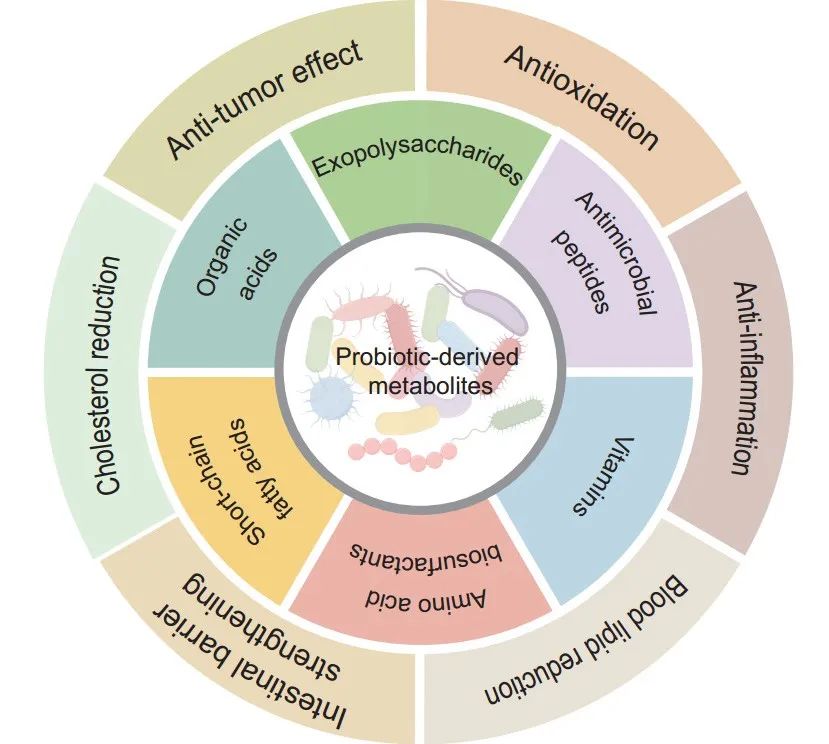 图5.益生菌衍生代谢物的生物活性和生理功能。益生菌衍生的代谢产物,包括短链脂肪酸、抗菌肽和胞外多糖,对维持肠道健康和调节免疫反应至关重要,这些代谢产物支持各种生理过程,增强宿主代谢和整体健康。它们的多种作用突出了益生菌通过与宿主的有益相互作用促进健康和预防疾病的重要性。
图5.益生菌衍生代谢物的生物活性和生理功能。益生菌衍生的代谢产物,包括短链脂肪酸、抗菌肽和胞外多糖,对维持肠道健康和调节免疫反应至关重要,这些代谢产物支持各种生理过程,增强宿主代谢和整体健康。它们的多种作用突出了益生菌通过与宿主的有益相互作用促进健康和预防疾病的重要性。
4.1 抗菌肽发现中的AI
抗菌肽(AMPs)是多种生物体免疫系统的重要组成部分,其功能包括防御致病微生物侵袭及调节肠道微生物组平衡。与传统抗生素相比,抗菌肽具有更不易诱发耐药性等显著优势,这一独特属性使其成为替代传统抗生素疗法的潜在候选者。由于特定益生菌具备大量合成天然抗菌肽的能力,微生物发酵技术已被用于部分抗菌肽的大规模工业化生产。
为充分挖掘抗菌肽(AMPs)的潜力,系统收集并维护定期更新的数据库至关重要。目前抗菌肽数据库(AMP Database,https://aps.unmc.edu/)收录5,099种肽类物质,涵盖其序列、结构与功能活性等详细信息。然而据估算,天然抗菌肽总量可能达数百万种,这使得传统新抗菌肽发现与设计方法耗时且成本高昂。因此需要创新策略加速发现进程。近年来,人工智能(尤其是深度学习技术)在生物学研究中获得广泛关注:快速计算筛选使抗菌肽发现速度实现量级提升,可在数小时内完成海量蛋白质组与微生物组数据分析。值得注意的是,自然语言处理技术能够从序列数据中自动学习特征,即使面对同源性低的短序列也能通过识别基因组序列中的独特特征锁定候选抗菌肽。由此可见,AI与ML技术正加速抗菌肽的发现与优化进程,为应对抗耐药性感染提供新解决方案。
人类肠道微生物组编码着丰富的抗菌肽(AMPs)资源。先前研究利用先进神经网络模型自主学习AMP序列特征并结合大规模人类微生物组数据集,成功鉴定并合成了216种潜在新型抗菌肽。实验验证显示其中181种(83.8%)具有显著抗菌活性,证实该计算策略在功能性抗菌肽发现中的高效性。此项研究构建了包含近百万候选AMP序列的AMPSphere数据库(https://ampsphere.big-data-biology.org/),为揭示抗菌肽的来源与作用机制提供重要资源。AMPSphere还支持原核生物隐肽的发现与分析,通过MMseqs2搜索工具将其数据库与proGenomes2基因组数据集比对,成功识别超5万种潜在隐肽。此外,AMPSphere数据库可评估不同宏蛋白质组学工作流程对AMP鉴定的影响:通过将其与小鼠肠道微生物肽序列结合,分析数据依赖性采集-平行累积连续碎裂(PASEF)与数据非依赖性采集-PASEF数据集,发现数据非依赖性采集-PASEF能更有效识别与定量更多AMP。除肽段鉴定功能外,AMPSphere为预测AMP活性提供全面数据支持:该数据库涵盖约870万条肽段,从中鉴定出15,711条独特高质量肽段(长度≤50氨基酸),形成"HQ_AMP_DS"数据集。该数据集已被AntiBP3、DRAMP 3.0等机器学习与深度学习工具用于AMP活性预测。AMPSphere通过加速新型抗菌肽的发现,为开发应对耐药菌感染的新型抗生素、推动个性化医疗发展作出重要贡献。
最新研究利用自主研发的高通量AI工具AMPidentifier,在致病性蟑螂德国小蠊(Blattella germanica)肠道微生物组中筛选抗菌肽候选物。该工具从共生菌Blattabacterium cuenoti中鉴定出具有保守序列特征的抗菌肽AMP1。实验证实AMP1具有广谱抗菌活性,使其成为开发新型抗菌药物的潜在候选者。
当前,人工智能正日益应用于优化食用益生菌筛选,以实现抗菌肽(AMPs)的高效合成与增产。研究者开发了先进的AMP识别模型COMDEL(Comparing and Optimizing Multiple DEep Learning),该模型整合了基于神经网络算法的训练方法与高通量AMP筛选策略。COMDEL展现出卓越的识别精度与准确度,可精准鉴定具有广谱抗菌活性且高产AMP的食用作物与益生菌。为进一步提升AMP产量,研究者采用定向进化技术与无细胞AMP合成系统,显著提高了AMP的合成效率。COMDEL模型为AMPs的规模化生产与实际应用奠定了坚实基础。
4.2 胞外多糖优化中的AI
胞外多糖(EPS)是由益生菌等多种微生物在生长代谢过程中分泌的高分子量、结构多样性长链糖分子。尽管许多乳酸菌(LAB)可合成EPS,但其生产效率通常处于25-800 mg/L范围,难以满足大规模工业化应用需求。为实现工业化生产,研究者采用人工智能建模技术优化植物乳杆菌(L. plantarum)的培养基成分与接种剂量以提升EPS合成效率。在一项代表性研究中,通过结合基于AI的方法与支持向量机(SVM)策略优化培养基组成,使一株嗜热性地衣芽孢杆菌(Bacillus licheniformis)的EPS产量显著提升:最大EPS浓度达64±1.1g/L,较未优化培养基产量提升约五倍。该策略不仅促进微生物生长,同时增强EPS分泌能力。
人工神经网络(ANN)已被应用于提升嗜热短芽孢杆菌(Brevibacillus borstelensis)的胞外多糖(EPS)产量,其通过预测并优化葡萄糖浓度、谷氨酸单钠、酵母提取物与硫酸镁等关键参数实现增效。在此研究中,ANN模型结合Plackett-Burman设计法与遗传算法,成功优化了EPS生产的培养基成分与接种条件:Plackett-Burman法确定乳糖、酪蛋白水解物与柠檬酸三铵为核心组分,而ANN模型实现平均误差4.8%、相关系数0.999的高精度预测。遗传算法优化预测EPS产量为7.01g/L,实验验证值达7.14g/L。此外,ANN与模糊建模方法在优化葡聚糖与果聚糖(EPS定义为葡萄糖与果糖复合物)产量方面展现出有效性,尤其适用于肠膜明串珠菌DL1(Leuconostoc mesenteroides DL1)的EPS生产。研究者构建了基于培养时间、蔗糖浓度、温度与初始果聚糖浓度等多参数的EPS生产模糊逻辑模型,实现EPS产量的精准预测。类似地,ANN技术被用于构建EPS-NN2模型,该模型基于蔗糖、酵母提取物、蛋白胨与生物量四个输入变量优化芽孢杆菌属EPS003菌株的EPS产量。该模型配置含7个神经元的隐藏层,展现出高预测精度(R²=0.98,标准化均方根误差0.024),其中生物量数据的引入显著提升了预测准确性。
人工神经网络(ANN)与遗传算法的整合应用成功优化了发酵蓝莓汁的胞外多糖(EPS)产量。在最优条件下,EPS产量达2.2±0.1g/L,增幅达32.5%。该研究还创新性地开发了结合紫外-可见光谱与近红外光谱技术的随机森林增强预测模型,并整合化学计量学方法。该模型展现出高相关系数(0.936)与预测系数(0.835),表明其对发酵过程中EPS含量具有强预测能力。值得注意的是,研究明确了pH值与碳源等影响EPS产量的关键因素,揭示了微生物特性、糖类物质与酚类化合物(尤其是花青素)等生化参数对蓝莓汁发酵过程中EPS生物合成的复杂调控效应。
人工智能技术在胞外多糖(EPS)生产中的日益广泛应用正通过提升生产效率、推动医疗设备升级、通过精准医学改善健康结果。益生菌代谢物在促进胃肠道健康、调节代谢紊乱、调节免疫反应、控制感染及促进伤口愈合等方面展现出巨大潜力。这凸显了益生菌代谢产物的多维健康效益,并为这一前景广阔领域的未来研究与应用奠定基础。
4.3 酚类化合物研究中的AI
酚类化合物通过清除自由基、阻断自由基链式反应及螯合金属离子等机制展现出强抗氧化活性。此外,其兼具抗菌与抗炎作用,使其成为开发功能性食品的理想成分。研究证实多酚与肠道菌群存在相互作用:多酚经肠道菌群代谢后发挥益生元效应。
水果与蔬菜是酚类化合物(PCs)的丰富来源,以果汁为替代基质进行益生菌发酵可在改变果实感官特性的同时提升其营养价值。通过序贯单纯形格子混合设计、回归建模与遗传算法优化研究发现,以0.5:0.5比例接种发酵粘液乳杆菌(Limosilactobacillus fermentum)与植物乳杆菌(Lactiplantibacillus plantarum)的混合菌种,可使发酵后蓝莓汁总酚含量较发酵前提升82.2%。该优化方法不仅显著提高了蓝莓汁多酚浓度,同时改善其营养与感官特性。这一创新性优化策略为提升发酵食品营养价值提供了新思路,并为后续研究奠定坚实基础。
人工神经网络(ANN)同样是预测天然提取物中总酚类化合物(PCs)的卓越工具,其通过确定输入变量(提取时间、溶剂/植物比例、乙醇浓度)与输出响应(总PCs及2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)抗氧化能力)间的非线性关系实现预测。相较于响应面法(RSM),人工神经网络展现出更优的拟合度与预测能力。
该领域近期也取得一项突破性进展:研究者开发了一种含有副干酪乳杆菌XN18(Lacticaseibacillus paracasei XN18)的Lallemantia royleana植物粘液涂层,旨在延长新鲜开心果货架期并增强其抗氧化活性。研究同时采用高斯过程回归模型预测关键参数(如失重率、脂肪含量、微生物存活率及酚类化合物产量),其展现出高精度预测能力,证实高斯过程回归在优化益生菌强化食品开发、降低实验室成本、加速分析流程方面的应用潜力。
5 将AI整合到发酵产品创新中
益生菌是食品中具有多种健康促进作用的生物活性成分,其在食品与健康产业中具有不可替代的应用价值。人工智能技术的快速发展为益生菌及发酵食品开发提供了新方法——通过菌株筛选与优化显著提升产品质量。此类AI驱动的方法在益生菌关联产品的研发、设计与生产环节正变得日益关键(图6)。

图6.使用机器学习开发益生菌发酵剂菌株的工作流程。该工作流程首先对理想的功能性发酵乳制品的理化参数进行表征,然后通过高通量方法对菌株进行初步筛选,以确定有希望的候选菌株。迭代优化循环利用机器学习(ML)来优化发酵条件,促进小规模发酵和配方测试。从这些测试中获得的结果指导进一步调整,提高菌株性能。最终,成功的配方进行工业测试和传播,从而根据消费者的偏好和需求量身定制创新的发酵乳制品。
了解微生物动力学和优化发酵过程是该领域取得成功的关键。新兴组学技术与数字孪生系统通过实时微生物监测与生产效率提升,推动微生物食品生产发展:组学技术生成多维数据集,而数字孪生利用计算科学与先进建模工具将数据转化为可操作的洞察。二者融合可对发酵状态、工艺优化及质量评估产生更深入的预测与洞见。通过应用机器学习算法分析海量数据集,益生菌制剂的功效与适应性得以显著提升。以AlphaFold2为代表的算法能够预测蛋白质结构,这对益生菌制剂中关键蛋白的设计与优化至关重要。人工智能的应用不仅限于结构预测——其还可促进新型蛋白质设计与药物发现,助力开发具有增强健康效益或更高生物活性的益生菌。此外,AI系统能快速评估抗菌素敏感性并优化抗生素组合方案,这对开发针对耐药病原体的有效益生菌尤为重要。
发酵剂间的相互作用显著影响乳制品的特性与感官品质。常用发酵剂如德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)与嗜热链球菌(S. thermophilus)存在协同生长效应,其互作关系直接影响发酵效率与产品质量。传统实验筛选最优菌株组合耗时费力,为此研究者构建了两个半监督学习模型,用于预测德氏乳杆菌保加利亚亚种与嗜热链球菌362株菌株/分离株间的互作关系(共生成32,761种组合)。通过两个模型预测结果的交集确定最优菌株比例,并深入解析其代谢互作机制,该策略为其他微生物研究(尤其标记样本有限时)提供宝贵参考。此外,AI应用可强化乳制品生产质量控制:例如一项研究监测了含有副干酪乳杆菌431(Lacticaseibacillus paracasei 431)的酸奶饮料在40°C储存21天期间pH值、酸度、乳酸与乙酸含量、抗氧化活性及菌落数的动态变化;基于支持向量回归模型预测该菌株存活率,并量化菊粉与石榴汁浓度对其存活与活性的影响,证实该模型在食品中益生菌含量精准预测方面的应用潜力。
人工智能技术在发酵产品生产与管理中的整合应用显著提升了企业运营效率与产品质量。例如,通过深度学习与脑电波分析技术的结合,益生菌食品感官评价的准确性与效率得到显著提升:深度学习方法可自动化提取专家评定的感官属性特征,并利用支持向量机(SVM)将其与消费者偏好关联以预测酸奶产品接受度。这不仅提升了模型性能,还为制造商的产品设计决策提供了科学依据。人工智能、传感器技术、机器人技术、计算机视觉与增强感官分析技术等数字技术的持续进步,对维持食品饮料行业标准、提升竞争力具有关键作用。其中发酵产品领域特别适合应用这些技术实现原料分析与生产工艺的优化。
此外,人工智能通过与生物信息学的整合显著提升了益生菌产品的生产,其通过优化微生物过程与食品安全实现增效。AI还通过高级分析预测市场需求、调整生产计划及减少库存浪费优化供应链管理,最终提升运营效率并降低成本。人工智能在食品质量实时监测方面具有巨大潜力。光学成像技术与AI算法的结合可实现细菌污染的快速检测,从而显著提升食品安全。多层神经网络与卷积神经网络(CNNs)可促进益生菌产品外观的自动识别与分类,这对检测包装缺陷或异常、确保市场接受度与消费者安全至关重要。
人工智能技术同样应用于酒精饮料酿造领域。针对白葡萄酒发酵过程,研究者开发了三阶段控制系统以监控关键发酵阶段并确保质量控制。随机森林(RF)与支持向量机(SVM)等技术已被用于高精度预测葡萄酒陈酿阶段。发酵是可可豆加工的核心环节,其过程显著影响产品风味与质地。发酵可可豆多酚含量降低导致颜色变化,而多酚氧化形成不溶性高分子量单宁;该过程同时降低pH值并使风味形成酶失活。传统发酵评估方法依赖Magra切割器剖切豆粒并进行主观视觉检查,存在可靠性不足的缺陷。结合机器学习技术,计算机视觉能有效区分发酵与未发酵可可豆,建立便携式发酵指数测量系统以服务更广泛群体。
益生菌因其安全性被广泛认可,并常用于发酵食品中以提升风味。传统上,食品风味研究依赖湿实验室实验方法,这些方法需要直接操作样本并与其互动;然而,人工智能与现有技术的整合为在数字化环境中探索与开发新型风味化合物开辟了新途径,显著减少了时间与资源投入。食品源生物活性肽在营养与健康中发挥关键作用:例如,鲜味肽对塑造发酵产品风味轮廓至关重要。利用瑞士乳杆菌Lh191404发酵大西洋鳕鱼释放出高水平鲜味肽。通过结合质谱肽组学、虚拟筛选与机器学习(采用三种预测模型),研究者从发酵鳕鱼中鉴定出大量鲜味肽。值得注意的是,机器学习干预简化了虚拟筛选流程,解决了精度限制问题并提升了整体准确性。
复杂基质中苦味肽(BPs)的高通量筛选对营养研究与药物开发具有重要意义。超高温灭菌乳在储存过程中会产生苦味,其机制可能与蛋白质降解生成苦味肽相关。然而大规模筛选苦味肽仍存在耗时与成本高昂的问题。为应对这一挑战,研究者建立了肽组学与机器学习协同的综合性苦味肽鉴定体系:通过扩展苦味肽数据集并整合新型苦味肽特征,开发了CPM-BP分类预测模型,用于精准识别变质乳与新鲜乳中的苦味肽。在724种样本间显著差异肽段中,模型预测出180种潜在苦味肽,其中11种已获文献验证。这种肽组学与机器学习的整合为苦味肽发现提供了高效解决方案。目前,人工智能技术已成为发酵食品风味研究不可或缺的组成部分。多种机器学习算法的联合应用可提升风味研究的系统性,代表该领域未来发展的核心趋势。
益生菌与发酵产品凭借其功能性及对人体健康的积极促进作用,在产品开发中具有显著优势。然而目前其在相关领域的应用仍相对局限。人工智能技术的进步为该领域突破性发展提供了契机,有望彻底改变益生菌与发酵产品的开发模式。这种技术整合将推动创新配方的诞生与健康效益的强化,为扩大应用场景、优化消费者健康结果铺平道路。
6.未来展望
随着人工智能的不断发展,其在益生菌研究和应用中的整合有望大幅扩大,改变菌株筛选、发酵、精准医学和肠道健康管理。虽然本文概述了人工智能目前的贡献,但未来将有重大机会扩大其在益生菌创新和临床应用中的作用。
6.1.新兴研究方向
人工智能在解析复杂微生物互作及宿主-微生物组动态中的应用是一个极具前景的途径。通过预测益生菌菌株间的代谢互作及其与共生微生物的相互作用,可合理设计具有增强健康效益的下一代益生菌。深度学习算法与计算机辅助基因分型技术将在优化预测能力方面发挥关键作用,从而实现更精准的菌株筛选与功能表征。人工智能与多组学方法(如宏基因组学、转录组学、代谢组学、蛋白质组学及表观基因组学)的整合,支持开发高度靶向的益生菌制剂,以满足个体特定的代谢与免疫需求。AI驱动的多组学整合还将促进多种疾病相关肠道微生物组标志物的识别,为个性化营养及基于益生菌的干预措施提供更多数据驱动的方法。
人工智能将进一步通过强化基于肠道微生物组的诊断与精准营养应用,重新定义临床益生菌的应用场景。在医疗机构中应用AI驱动的肠道微生物组分析技术,可实现实时健康监测、疾病早期预警以及基于个体微生物组特征的个性化膳食干预。这些技术进步将弥合微生物组研究与临床实践间的鸿沟,确保益生菌疗法在炎症性肠病(IBD)、肠易激综合征(IBS)、肥胖症及代谢紊乱等特定患者群体中获得最优化的治疗效果。
人工智能在药物发现与功能性益生菌代谢物预测中的作用是未来探索的另一关键领域。高级深度学习模型将简化新型抗菌肽(AMPs)及其他生物活性化合物的发现流程,加速其在应对抗生素耐药性感染与解决肠道相关疾病中的应用。此外,AI驱动的分子对接与计算机虚拟筛选技术将进一步赋能基因增强型益生菌的精准工程化改造,优化其治疗应用相关的功能特性。
总之,这些新兴的研究方向预示着益生菌的变革性未来,其中人工智能的整合不仅增强了科学理解,还改善了临床结果和整体健康管理。
6.2 挑战和考虑因素
尽管人工智能在益生菌研究中展现出巨大潜力,但其应用仍面临诸多挑战。核心问题在于缺乏标准化数据集,这导致不同研究间的可重复性与可比性不足。因此,构建大规模、高质量且经过严格质控的数据集对训练可靠的人工智能模型至关重要,此类模型需能提供具有生物学意义的见解。为此,需建立统一的数据共享平台并开发专为益生菌研究定制的开放获取人工智能模型,以突破当前的技术瓶颈。
另一个紧迫问题在于人工智能模型的可解释性与透明度。当前许多AI驱动的益生菌筛选与疾病预测算法以"黑箱"模式运行,导致其生物学意义验证困难。为解决这一局限,未来的研究应优先开发可解释性AI框架,使研究者能够理解AI推导结论的生成机制,确保这些结论既具有生物学意义又具备临床适用性。
人工智能驱动的益生菌研究所涉及的伦理与监管框架需要审慎考量。随着人工智能系统日益融入临床实践与个性化健康管理,必须优先关注隐私保护、数据安全及负责任的AI部署。建立明确的监管指南与伦理标准对培育公众信任、确保公平获取AI赋能的微生物组干预措施至关重要。人工智能在益生菌领域的应用需在优先保障数据安全、减少偏见、提升算法透明性的框架下开展。
6.3 对益生菌行业和医疗保健的未来影响
人工智能的持续进步有望重塑益生菌行业,在菌株发现、发酵优化与工业化生产等多领域实现效率提升。AI驱动的自动化与机器人实验室系统将推动高通量益生菌筛选,实现功能优势菌株的快速鉴定。这种技术革新将显著加速新型益生菌的商业化进程,此类产品将具备更强的生存能力、代谢活性与健康效益。
此外,人工智能驱动的合成生物学方法可以促进益生菌的生物工程,以解决新出现的类似从代谢紊乱到免疫相关疾病的健康问题。人工智能在益生菌创新中的实际应用可能会超越传统的功能性食品,包括用于临床治疗、膳食补充剂和药用益生菌的新制剂。
在医疗健康领域,人工智能有望成为个性化微生物组医学的重要组成部分,提供可基于个体肠道菌群组成、生活方式与遗传倾向动态调整的AI辅助益生菌处方方案。开发整合微生物组数据、电子健康记录与可穿戴生物传感器的AI驱动平台,将实现实时精准干预,标志着肠道健康管理与疾病预防策略的重大进步,为更有效、个性化的医疗解决方案铺平道路。
7 结论
人工智能在益生菌研究中的整合应用正在彻底改变菌株筛选、功能表征与代谢物预测的技术格局,推动更快速、更精准的益生菌发现与应用进程。AI驱动模型显著增强了肠道微生物组分析、生物标志物识别及个性化益生菌干预能力,为精准营养与微生物组医学开辟了新的可能性。在工业生物技术领域,人工智能通过优化发酵工艺、提升菌株工程效率、推动功能性食品开发,加速了下一代益生菌的创制进程。尽管取得了这些进展,但仍存在一些挑战,包括数据标准化的需求,改进算法的可解释性,并仔细考虑伦理影响。应对这些挑战对于确保在益生菌研究中可靠和负责任地实施人工智能技术至关重要。展望未来,微生物学家、生物信息学家和人工智能专家之间的跨学科合作将是释放人工智能在这一领域全部潜力的关键。随着计算微生物组分析与自动化技术的持续进步,AI驱动的益生菌技术将有望改变肠道健康管理、疾病预防与工业创新,有效弥合基础微生物学与实际应用间的差距。
原文链接:https://doi.org/10.1016/j.tifs.2025.104938
获取此篇微文原文pdf请扫描下方二维码联系微科盟多组学老师即可。
微科盟更多推荐
满血DeepSeek不卡顿!基于DeepSeek打造的全方位科研客服「WekeAI」已上线!随问随应,科研加速!
微科盟智能客服WekeAI限额体验网址https://www.bioincloud.tech/mini/wekeai/
宏基因组推荐
本公众号现全面开放投稿,希望文章作者讲出自己的科研故事,分享论文的精华与亮点。投稿请联系小编(微信号:yongxinliu 或 meta-genomics)
猜你喜欢
iMeta高引文章 fastp 复杂热图 ggtree 绘图imageGP 网络iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。























 7728
7728

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








