阿尔茨海默症 (Alzheimer’s disease, AD)作为一种进行性神经退行性疾病,一直是神经科学领域研究的核心课题。AD的主要特征是Aβ蛋白沉积、以及Tau蛋白过度磷酸化导致的神经纤维缠结(NFTs),并破坏神经元微管运输。动物模型是研究AD、解析其疾病机制和验证分子靶点的核心工具。主流的动物种类以啮齿类动物、灵长类动物、无脊椎动物为主[1];主要的造模方法包括人为诱导造模、转基因造模、衰老造模等技术。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
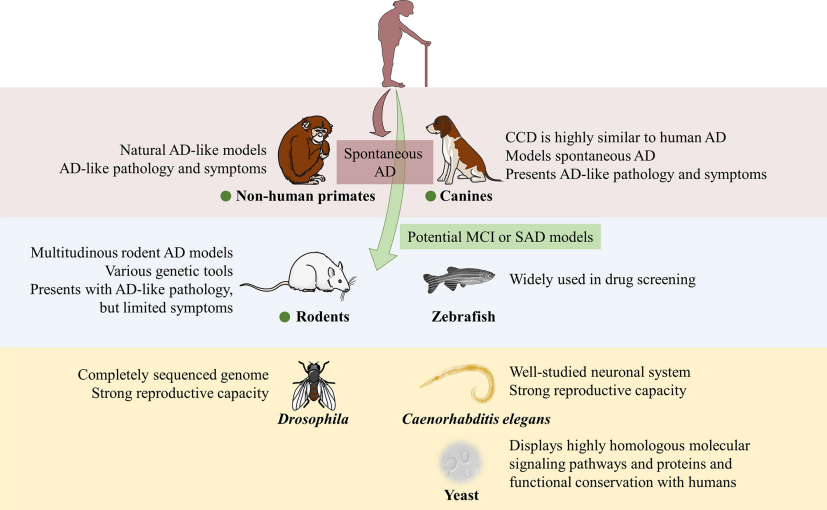
图 1. 用于构建AD模型的模式生物[1]
一、诱导构建动物Alzheimer’s disease(AD)模型
在阿尔茨海默症(AD)的研究中,诱导剂诱
1.Aβ蛋白注射诱导的动物AD模型
Aβ蛋白是一种常用的阿尔茨海默症(AD)动物模型造模剂,可用于多种动物,包括啮齿动物和非人灵长类动物。一般Aβ 寡聚体如Aβ1-42(β-Amyloid 1-42,AbMole,M1555)、Aβ25-35(β-Amyloid 25-35,AbMole,M9071)、Aβ1-40(β-Amyloid 1-40,AbMole,M10194)等蛋白,适合构建短期急性AD模型;而Aβ 纤维则更适合构建长期AD动物模型,其对突触的破坏能力要小于Aβ1-42肽。在大鼠和小鼠模型中,通常采用脑内注射的方式注入Aβ肽或者纤维,分布区域包括海马体或皮层等关键脑区。例如在大鼠海马体CA1区域注射Aβ1-42,可诱导认知障碍和神经细胞凋亡。在小鼠侧脑室内注射Aβ25-35或Aβ1-42,可导致学习记忆能力下降和神经炎症反应[2]。上述模型均能够模拟AD的部分特征,包括知障碍和神经细胞损伤。Aβ蛋白也可用于非人灵长类动物(如恒河猴)构建AD模型。将Aβ1-42注射到猕猴的侧脑室时,它们会在多个区域扩散和积累,并表现出突触丧失、Tau蛋白过度磷酸化和神经胶质的激活[3]。
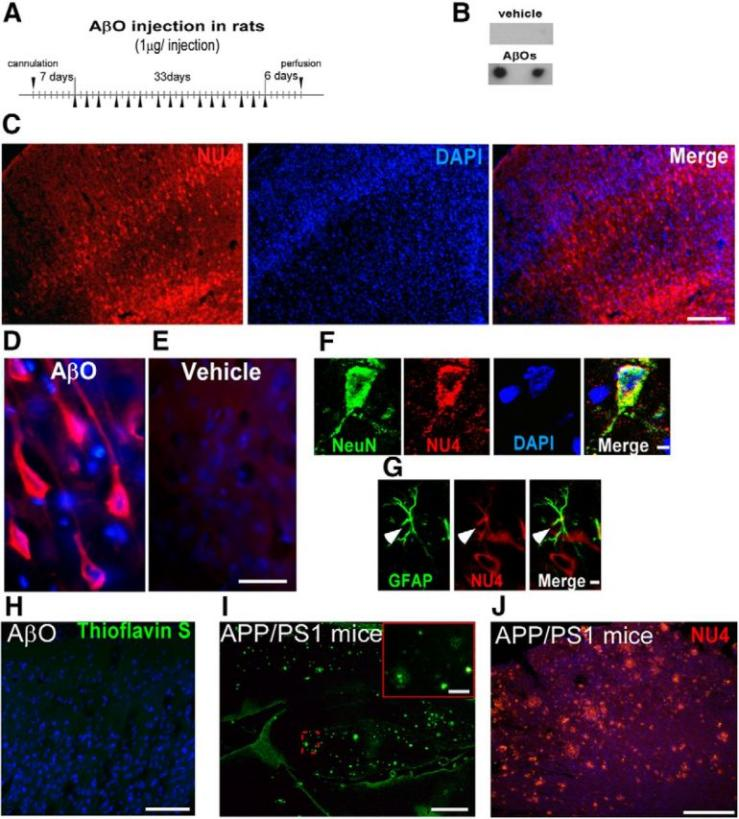
图 2. Aβ蛋白注射后在大鼠额叶皮层中扩散和积累[3]
2.链脲佐菌素(Streptozotocin)诱导的动物AD模型
链脲佐菌素(Streptozotocin,STZ,M2082) 本身是一种胰岛素信号抑制剂,Streptozotocin通过侧脑室注射可特异性损伤脑内胰岛素受体(IR),抑制PI3K/Akt通路活性,进而导致糖原合成酶激酶 3β(GSK-3β)过度激活,该激酶是Tau蛋白磷酸化的关键调控因子。研究显示,STZ模型在注射后4-8周即可检测到Tau Ser396/404 磷酸化水平升高,同时伴随 Aβ清除相关蛋白(如LRP1)表达下调,也有文献报导在注射STZ的第2周开始,大鼠的新型物体识别(NOR)任务评分明显下降,提示AD模型的成功构建。
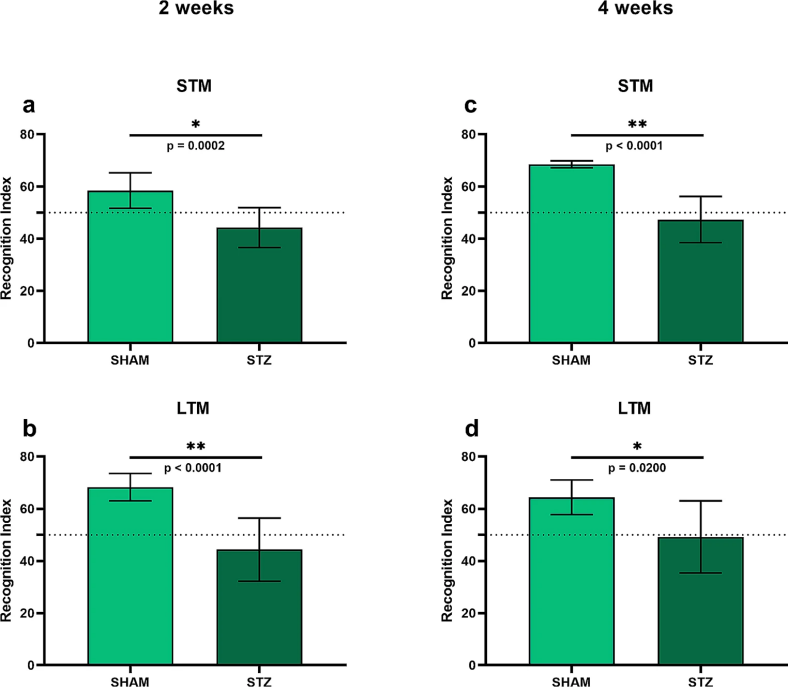
图 3. STZ 诱导的 AD 模型的大鼠的认知表现。
3.冈田酸(Okadaic acid,OKA)诱导的动物AD模型
冈田酸(Okadaic acid,AbMole,M5195)是一种聚醚毒素,可选择性地抑制丝氨酸/苏氨酸磷酸酶1和2A( PP1/2A)。有证据表明,PP2A的活性在AD中有所降低,并且这种变化与Tau蛋白的磷酸化有关[4]。有研究证实在注射OKA(200 ng)后的第15天,在大鼠中观察到记忆障碍并伴有AD样变化[5]。另一项研究报告称,海马内注射OKA(100 ng)12天后,大鼠出现海马星形胶质细胞增多症,表现为GFAP表达增加,氧化应激的增多,此外大鼠还表现出空间认知障碍[6]。冈田酸(Okadaic acid)的优势在于可以快速诱导Tau蛋白的磷酸化,且这种磷酸化位点与真实AD中的位点高度相似(如Ser202、Thr205)等。该模型因病理进程迅速,常用于筛选抑制Tau蛋白磷酸化的小分子化合物。另外,OKA还适用于斑马鱼AD模型的构建,冈田酸处理的斑马鱼表现出几种类似AD的认知和行为表现,例如对惊吓的习惯受损[7]。值得注意的是,以斑马鱼为模式生物的AD模型在药物筛选方面具有天然的优势,待筛选化合物可以添加到水箱中并通过皮肤吸收进行全身给药或输送到特定部位。已通过斑马鱼模型筛选出了Donepezil(E2020,AbMole,M3601)、Memantine(AbMole,M3326)等潜在的AD抑制剂。
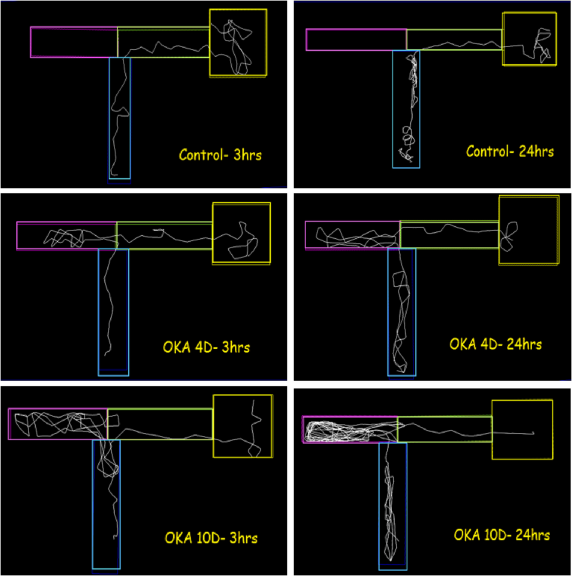
图 4. OKA处理4天和10天的斑马鱼T型迷宫轨迹图案[8]
4.Poly(I:C)(Polyinosinic:polycytidylic acid)诱导的动物AD模型
Poly(I:C) (聚胞苷酸,AbMole,M5062)是一种合成的双链 RNA,可诱导先天免疫反应。在中枢神经系统中,Poly(I:C)(Polyinosinic-polycytidylic acid)通过模拟病毒感染引发神经炎症。在 Poly(I:C)诱导的模型中,神经炎症通常在给药后数周内开始,而认知障碍和Tau蛋白的过度磷酸化则通常在数月后出现,这种生理变化非常符合AD的炎症假说。此外, Poly(I:C)诱导的神经炎症可以导致长期的认知障碍。因此,Poly(I:C)非常适合构建迟发型的长期AD模型。例如,暴露于Poly(I:C)的大鼠在16个月后仍表现出空间记忆障碍。Poly(I:C)还可通过腹腔注射引起小鼠的全身性炎症反应,这种炎症变化被证实可造成小鼠海马体中磷酸化Tau蛋白的聚集,并诱发AD相关的生理变化和小鼠认知障碍[9]。
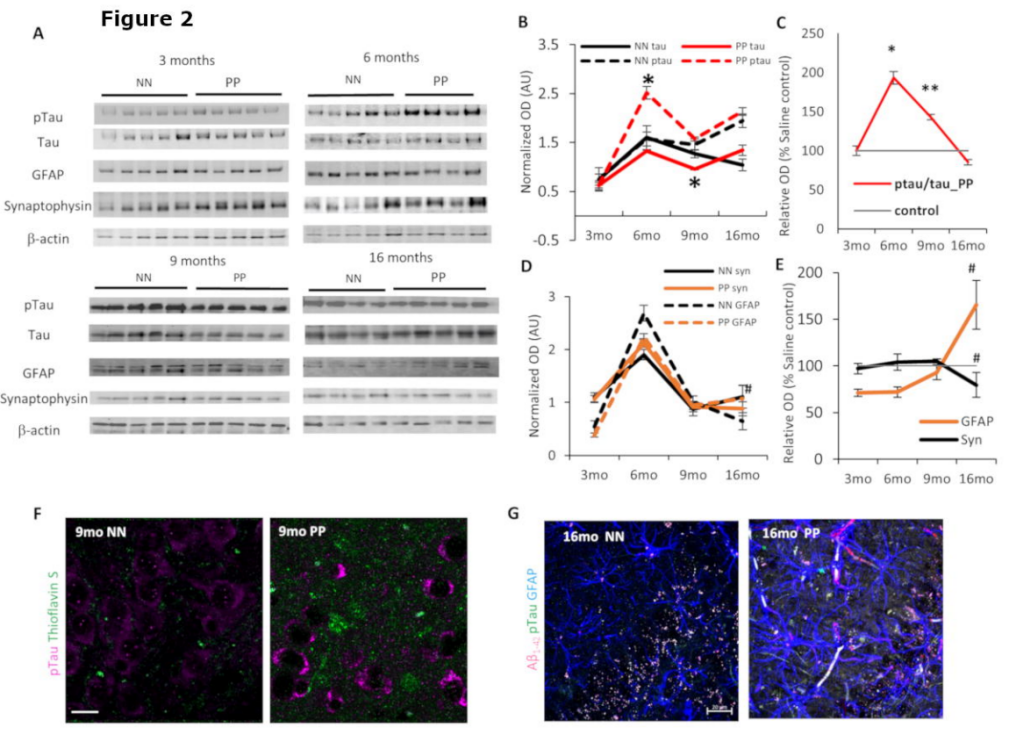
图 5. PolyI:C注射后引起小鼠海马体中磷酸化Tau蛋白的聚集[9]
5.秋水仙碱(Colchicine)诱导的动物AD模型
秋水仙碱(Colchicine,AbMole,M3460)注射也同样可诱发动物产生AD相关的病理特征,并伴有认知障碍和AD样行为改变。秋水仙碱的作用机理是破坏微管的稳定性,导致Tau蛋白过度磷酸化,形成神经纤维缠结;并且秋水仙碱可阻断轴原体转运,对海马体中的颗粒细胞和苔藓纤维造成严重损伤。以Wistar大鼠为例,通过立体定向手术向脑室内注射Colchicine诱导AD,在注射后数周至数月内均观察到明显的AD特征(如大量Aβ斑块的产生)和认知障碍[10]。
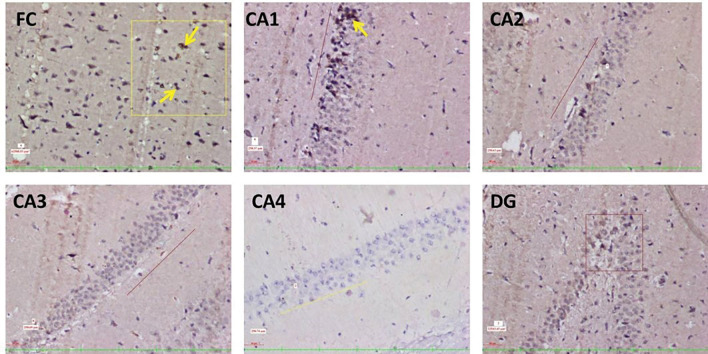
图 6. 秋水仙碱引起大鼠脑组织中Aβ斑块的沉积[10]
6.D-半乳糖(D-gal,D-Galactose)诱导的动物AD模型
半乳糖(D-Galactose,AbMole,M9976)是一种天然单糖,通过长期系统性给药可诱导动物形成类似阿尔茨海默症(AD)的变化。D-Galactose的核心机制在于其代谢过程中产生的过量活性氧(ROS)和诱导细胞衰老。当用D-半乳糖(D-gal)处理动物时,半乳糖的代谢中间产物(如半乳糖醛酸)可通过自氧化产生超氧阴离子,同时抑制线粒体呼吸链复合体Ⅰ和Ⅲ的活性,导致线粒体来源的ROS大量释放。过量的ROS可导致淀粉样前体蛋白(APP)构象改变,使其更易被β分泌酶BACE1切割,促进Aβ1-42生成。同时,Tau蛋白的半胱氨酸残基在被ROS氧化可增强其与GSK-3β的相互作用,加速Tau蛋白的磷酸化。另外一方面,由于D-gal的水平升高,动物体内半乳糖激酶(GALK)的催化能力饱和,导致大量未代谢的D-半乳糖在细胞内蓄积。这些过剩的半乳糖通过醛糖还原酶转化为半乳糖醇,后者因难以透过细胞膜而在细胞内累积,导致细胞代谢紊乱、衰老和死亡。因此,D-半乳糖(D-gal)是研究氧化应激与衰老/神经退行性病变之间关联的经典工具。在小鼠模型中,D-Galactose以450 mg/kg/天的剂量皮下注射,在连续8周的处理后,Y字形迷宫实验测试表明小鼠的学习和空间记忆出现障碍,并且观察到炎症细胞因子的产生和iNOS 的表达增加,阿尔兹海默症的经典抑制剂Donepezil(E2020,AbMole,M3601)在该实验中被用作阳性对照,结果显示DON可在一定程度上改善小鼠的生物学行为[11]。此外,D-半乳糖(D-gal)一般与铝氯化物(AlCl3)联用以快速诱导AD模型。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine
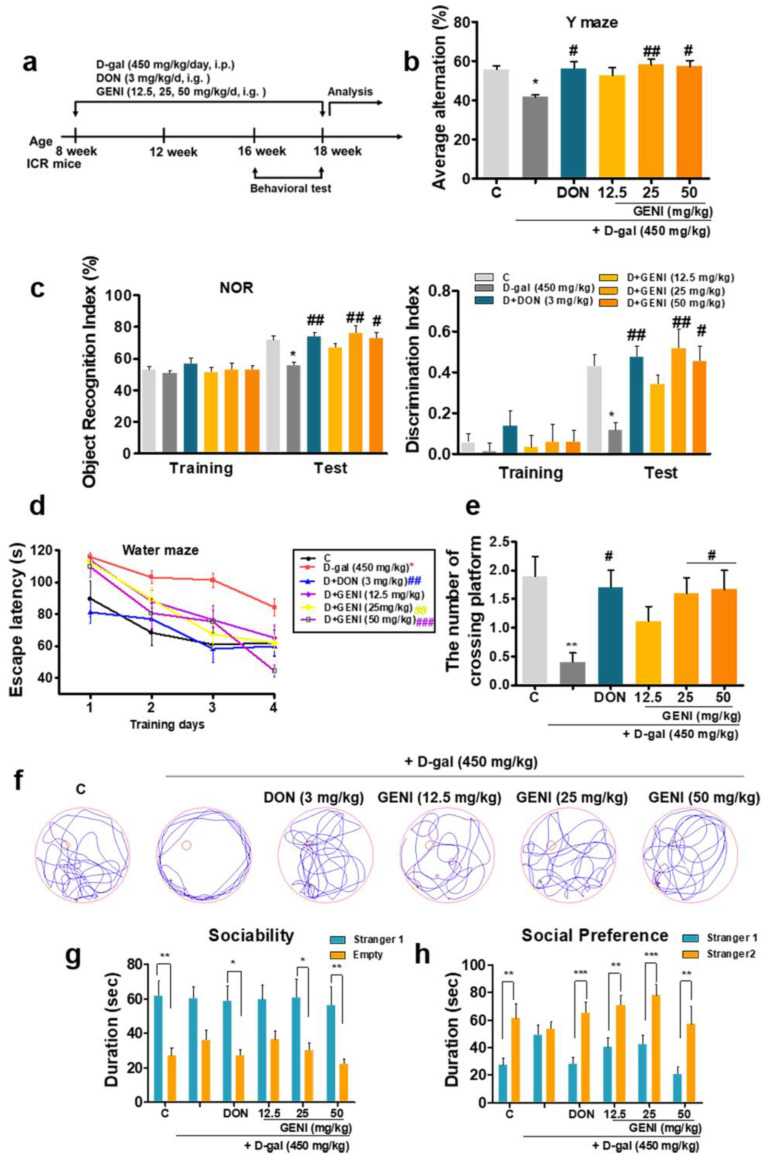
图 7. D-gal(450 mg/kg)诱导小鼠的AD模型[11]
7.诱导的动物AD模型
三氯化铝(AlCl₃)诱导的AD模型是通过使实验动物长期暴露于铝离子(Al³⁺)构建的经典化学诱导模型,其核心机制基于铝的神经毒性与AD病理特征的关联性。Al³⁺可抑制乙酰胆碱转移酶(ChAT)活性,降低脑内乙酰胆碱水平,影响突触传递和认知功能。另外一方面,Al³⁺可抑制 Tau 蛋白磷酸酶(如 PP2A)的活性,或激活激酶(如 GSK-3β),导致 Tau 蛋白过度磷酸化,进而形成神经原纤维缠结(NFTs)样结构。该模型因操作简便、成本较低且能稳定模拟AD相关的部分病理及行为学改变,在AD的神经病理机制研究中被广泛应用。
二、转基因技术构建动物AD模型
转基因技术构建的阿尔茨海默病(AD)动物模型是通过将AD相关致病基因导入动物基因组,使其稳定表达并模拟AD病理特征的模型。AD 的形成与多个基因突变密切相关,其中家族性 AD(FAD) 的致病基因已明确。FAD基因包括APP(淀粉样前体蛋白)基因突变,该突变会导致 Aβ 前体蛋白异常切割,产生淀粉样斑块;PSEN1(早老素 1) 或PSEN2(早老素 2)突变,该突变会影响 γ-分泌酶活性,进一步促进 Aβ₄₂生成;MAPT(Tau 蛋白基因)突变,该基因突变会导致Tau 蛋白过度磷酸化,形成神经原纤维缠结(NFTs)。转基因模型通过显微注射、病毒载体介导等技术,将上述突变基因导入实验动物(多为小鼠)的受精卵或胚胎干细胞,使其在神经细胞中特异性表达,最终引发类似AD的病理改变。
三、利用衰老构建动物AD模型
衰老是 AD 最主要的风险因素,通过模拟或加速动物的衰老过程,使其自发或更易出现 AD 的特征。这类模型尤其适用于研究衰老与AD的关系。根据衰老诱导方式的不同,可分为自然衰老模型和加速衰老模型两大类。自然衰老模型利用正常动物随年龄增长自然出现的衰老及 AD 样改变,无需额外干预。该模型的缺点是一致性差、周期长。加速衰老模型则通过基因修饰、化学诱导或环境干预等手段加速动物衰老,使其在较短时间内出现显著衰老表型及 AD 样病理。SAM(Senescence-Accelerated Mouse)是通过近亲繁殖筛选出的自然突变品系,分为快速衰老型(SAMP)和正常衰老对照型(SAMR)。其中SAMP8是研究 AD 最常用的亚系。SAMP8小鼠衰老速度是正常小鼠的2-3倍,6月龄即可出现明显衰老特征。此外,也可以通过基因编辑技术构建端粒酶敲除小鼠加速小鼠衰老。或者使用前文所述的D-半乳糖(D-gal,AbMole,M9976)、氯化铝(AlCl₃)诱导小鼠的衰老。
AbMole是ChemBridge中国区官方指定合作伙伴。

参考文献及鸣谢
[1] Zhi-Ya Chen, Yan Zhang, Animal models of Alzheimer’s disease: Applications, evaluation, and perspectives %J Zoological Research, 43(6) (2022) 1026-1040.
[2] 潘琼, 胡馨予, 郭科. 中南大学学报(医学版), β-淀粉样蛋白调控miR-15a激活Bag5在阿尔茨海默病神经细胞凋亡中的作用, 49(7) (2024) 1109-1119.
[3] L. Forny-Germano, N. M. Lyra e Silva, A. F. Batista, et al., Alzheimer's disease-like pathology induced by amyloid-β oligomers in nonhuman primates, The Journal of neuroscience : the official journal of the Society for Neuroscience 34(41) (2014) 13629-43.
[4] J. M. Sontag, E. Sontag, Protein phosphatase 2A dysfunction in Alzheimer's disease, Frontiers in molecular neuroscience 7 (2014) 16.
[5] Pradeep Kumar Kamat, Santoshkumar Tota, Shivika Rai, et al., A study on neuroinflammatory marker in brain areas of okadaic acid (ICV) induced memory impaired rats, 90(19-20) (2012) 713-720.
[6] A. P. Costa, A. C. Tramontina, R. Biasibetti, et al., Neuroglial alterations in rats submitted to the okadaic acid-induced model of dementia, Behavioural brain research 226(2) (2012) 420-7.
[7] J. D. Best, S. Berghmans, J. J. Hunt, et al., Non-associative learning in larval zebrafish, Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology 33(5) (2008) 1206-15.
[8] Aisha Siddiqui, Syafiq Asnawi Zainal Abidin, Zahoor A. Shah, et al., Behavioural, genomics and proteomic approach to examine Alzheimer's disease in zebrafish, Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 271 (2023) 109636.
[9] Praveen Bathini, Isabel Dupanloup, Elena Zenaro, et al., Systemic inflammation causes microglial dysfunction with a mixed AD-like pathology, (2021).
[10] Y. L. Rao, B. Ganaraja, P. K. Suresh, et al., Outcome of resveratrol and resveratrol with donepezil combination on the β-amyloid plaques and neurofibrillary tangles in Alzheimer's disease, 3 Biotech 14(8) (2024) 190.
[11] Y. Wang, L. Li, D. Chen, et al., GENI as an AMPK Activator Binds α and γ Subunits and Improves the Memory Dysfunction of Alzheimer's Disease Mouse Models via Autophagy and Neuroprotection, Antioxidants (Basel, Switzerland) 14(1) (2025).




















 2176
2176

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








