本文内容速览:

生物信息学工具通常基于蛋白序列中的定位信号预测其亚细胞定位,然而,这些预测通常反映稳态条件,未考虑环境或信号诱导的动态变化。伯小远在“穿越茫茫‘质’海,只为与你相见”一文中主要讲了定位在细胞质膜和各细胞器膜的一些蛋白,受生物胁迫或非生物胁迫后,发生转录本剪接变化、蛋白酶的切割或翻译后修饰而进入细胞核,进而调控转录反应以应对胁迫。
在本文,伯远生物(https://plant.biorun.com)将带大家了解那些定位在细胞质基质中的蛋白是否也会如膜蛋白一样,受到胁迫后转移至细胞核(后文将此过程简称为“质核转移”)?此外,我们还将讨论,除了亚细胞定位实验,还有哪些方法能佐证质核转移现象的存在?又该如何深入研究这一过程的分子机制?最后,质核转移机制研究还能与哪些科研热点结合呢?
免疫-GTP酶GBPL3
2021年,霍华德休斯医学研究所John D. MacMicking团队在Nature杂志上发表了一篇题为“A phase-separated nuclear GBPL circuit controls immunity in plants”的研究论文,该研究发现拟南芥中两种鸟苷酸结合蛋白样GTP酶GBPL1和GBPL3通过动态空间调控形成核内功能凝聚体,其中GBPL3从细胞质迁移至细胞核的重定位在免疫激活中发挥关键作用。
在稳态条件下,GBPL1作为分子伴侣将GBPL3锚定于细胞质中,维持其失活状态。当病原体侵染植株触发免疫信号时,GBPL3会发生显著的亚细胞重定位——从细胞质迁移至细胞核,总GBPL3含量未变但核内GBPL3浓度增加,并通过液-液相分离(LLPS)快速形成特异的GBPL防御激活凝聚体GDACs。值得注意的是,删除内部无序区即IDR区(相分离蛋白的典型结构)的GBPL3不仅无法形成凝聚体,且失去了对植物免疫的调节作用。
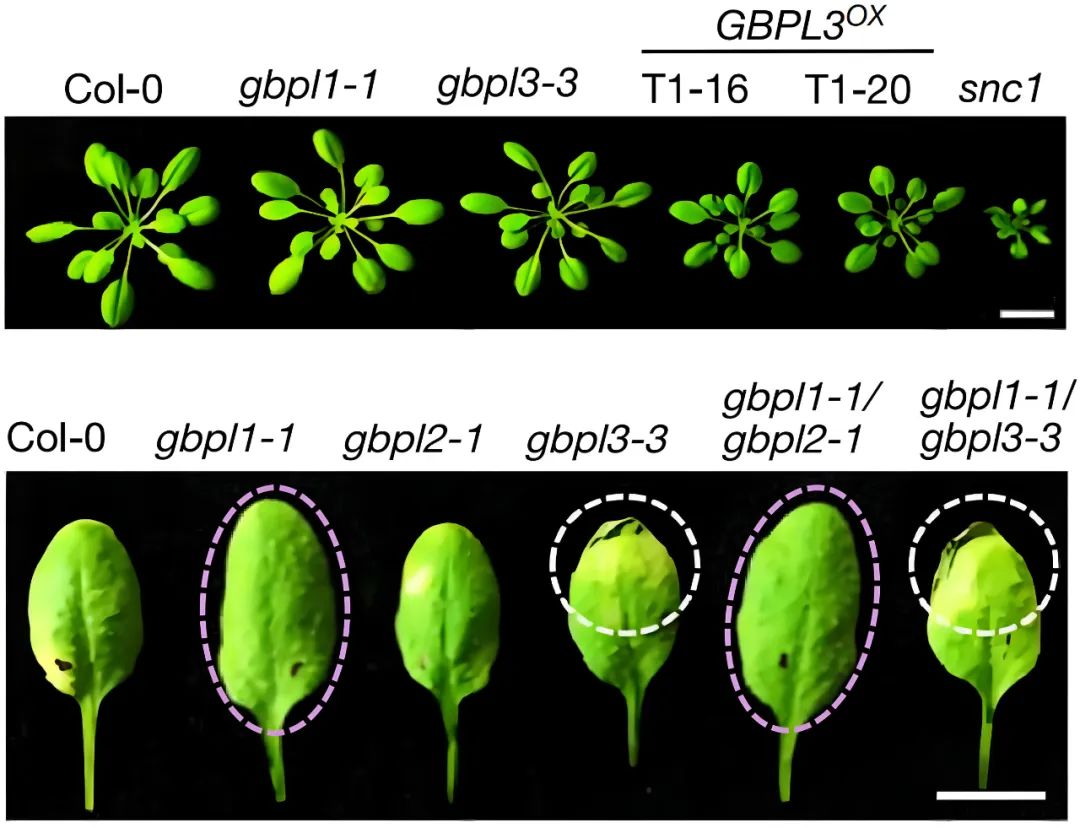
图1 GBPLs对植物免疫至关重要(Huang et al., 2021)。结果显示,当存在病原体感染时,GBPL3过表达植株清除病原体的效果比对照显著,但生长受到了抑制;gbpl3突变体显著易感,gbpl1突变体则表现出更强的抗性。

图2 四周大的eGFP-GBPL3植株经不同处理后的活体成像图(Huang et al., 2021)。结果显示,水杨酸(SA)、哌啶酸(Pipecolic acid)以及丁香假单胞菌Psm ES4326可诱导GBPL3形成凝聚体。
进入核内的GBPL3通过双重分子机制激活免疫程序:一方面直接结合植物防御基因的启动子区域,另一方面招募转录共激活复合体和RNA聚合酶II复合体,协同驱动免疫相关基因的转录重编程。这种由细胞质至细胞核的空间转移与相分离凝聚体的形成,构成了植物响应病原攻击的“分子开关”,显著增强了植物的抗病能力。该研究首次揭示了GTP酶通过相变调控植物免疫的分子机制,为理解真核生物抗病信号传导提供了新思路。
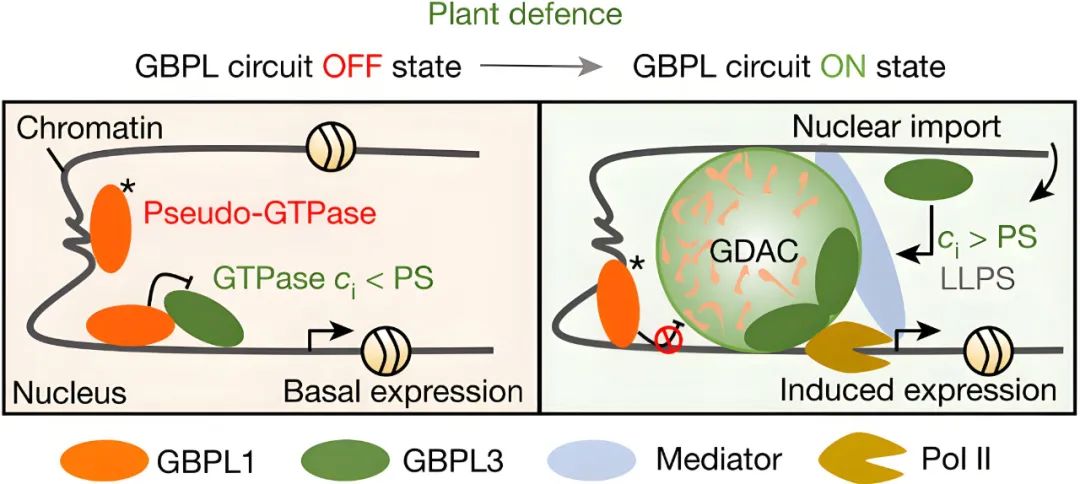
图3 在稳态和诱导条件下,植物细胞核中GBPL调控免疫的模型(Huang et al., 2021)。星号,GBPL1的G2-box突变导致其无GTP酶活性;Ci,GBPL3的细胞浓度;PS,相分离阈值。
激素-转录因子BZR1
经过多年研究,油菜素内酯(BR)信号转导分子机制得到了较清楚的解析。当BR信号通路失活时,蛋白激酶BIN2磷酸化BZR1家族转录因子(BZRs),从而阻止它们调节其靶基因的表达,进一步在14-3-3蛋白的帮助下,促进了BZR1的核输出,从而导致磷酸化的BZR1在细胞质中的积累;当BR信号通路激活时,BIN2被降解,进而通过蛋白磷酸酶PP2A促进BZR1的去磷酸化,致使去磷酸化的BZR1在细胞核中积累,在那里它与下游BR调控基因的启动子结合以调节它们的转录。由此可见,BZR1在细胞质和细胞核中的亚细胞定位及转录活性受到可逆蛋白磷酸化的严格调控,而这也是BR信号转导的核心事件。

图4 BR对BZR1在根细胞中定位的影响(Srivastava et al., 2020)。结果显示,用芸苔素内酯(BL,天然BRs中最具生物活性的化合物)处理转基因幼苗,会引起细胞核中BZR1水平的显著增加、细胞质定位的BZR1相应减少。
在BR信号激活通路中,BZR1由细胞质迁移至细胞核,然而这其中的细节仍不清楚,例如去磷酸化是在BZR1入核前还是入核后发生的,再例如核中积累的BZR1是来自于细胞质还是从头翻译的亦或是均有?
2021年,河北师范大学汤文强团队在PANS杂志上发表了一篇题为“Nucleocytoplasmic trafficking and turnover mechanisms of BRASSINAZOLE RESISTANT1 in Arabidopsis thaliana”的研究论文,作者详细研究了BZR1质核转移的机制。
针对“去磷酸化是在BZR1入核前还是入核后发生的”这一问题,作者创制了不同的转基因材料:见下图5中的(A)对照组BZR1pro:BZR1-YFP,(B)14-3-3结合缺陷型BZR1pro:BZR1S173A-YFP,(C)推测的NLS序列突变型BZR1pro:BZR1TTTT-YFP,(D)PP2A结合的PEST结构域被移除型35Spro:BZR1ΔPEST-YFP。这些转基因植株经过BR处理后,观察荧光信号的亚细胞定位情况并做WB实验检测蛋白的磷酸化情况。结果显示,对照组BZR1在无BR处理时位于细胞质,处于磷酸化状态,BR处理后位于细胞核,处于去磷酸化状态(图5A);实验组BZR1S173A一直定位于细胞核,且与对照组类似,在BR处理前后表现为磷酸化和去磷酸化状态(图5B);实验组BZR1TTTT一直定位于细胞质,只存在去磷酸化状态(图5C);实验组BZR1ΔPEST响应BR由细胞质迁移至细胞核,且只存在磷酸化状态。这些结果表明,BZR1磷酸化和去磷酸化步骤都发生在细胞核内,而且,当BR通路激活时,细胞质内磷酸化的BZR1移动到细胞核,然后被定位于细胞核中的PP2A去磷酸化。
针对“核中积累的BZR1是来自于细胞质还是从头翻译的亦或是均有”这一问题,详见小远之前的文章“如何验证一个基因是转录因子”,里面有较为详细的解释,针对该问题,作者最终得出的结论是,当BR通路激活时,核中积累的BZR1来自于细胞质。

图5 BZR1的磷酸化和去磷酸化均发生在细胞核中(Wang et al., 2021)。
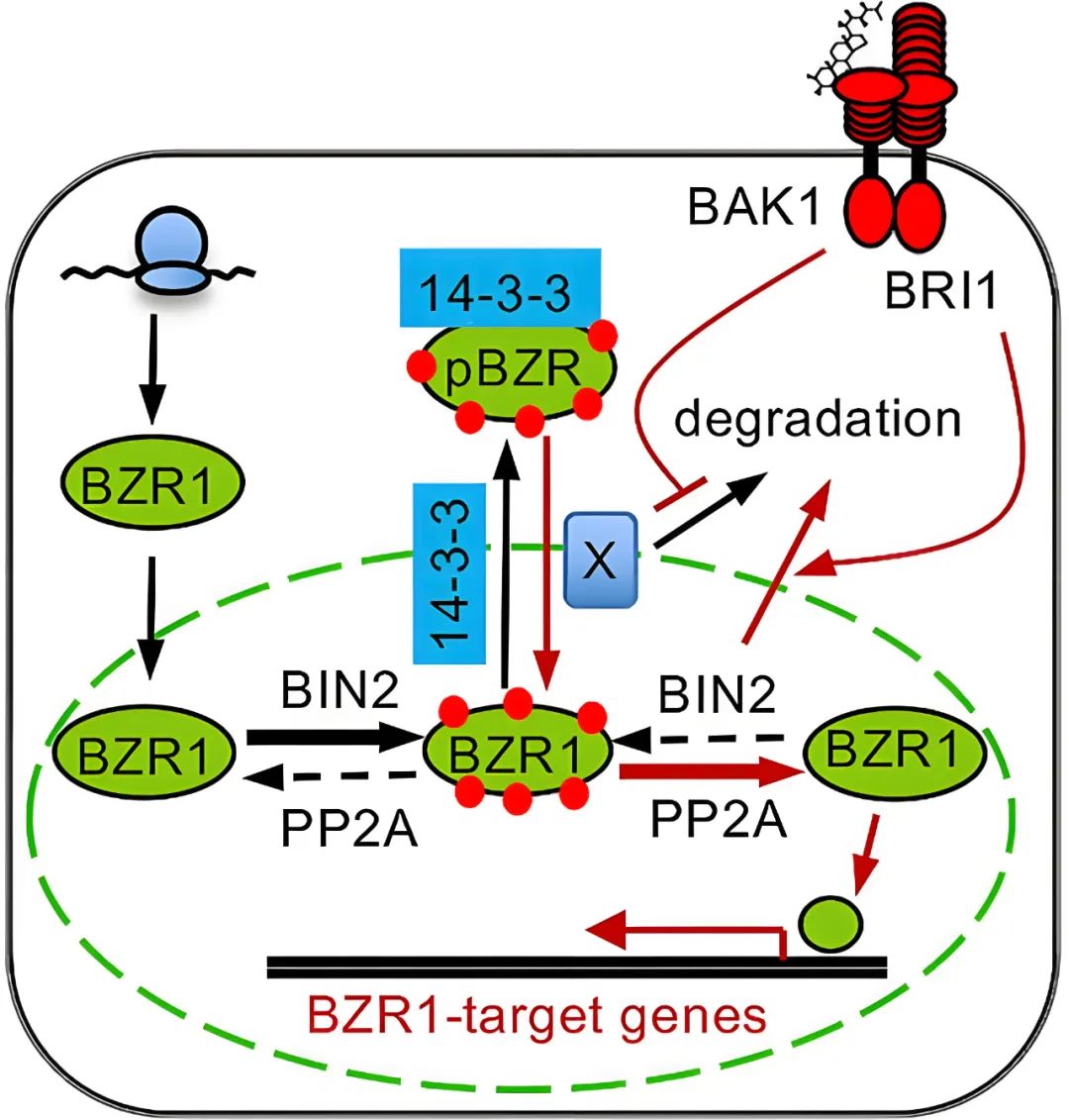
图6 响应BR信号的BZR1磷酸化/去磷酸化和BZR1质核运输的模型(Wang et al., 2021)。当体内BR水平较低时,细胞内的BZR1通过从头合成和26S蛋白酶体非依赖性降解来平衡。新翻译的BZR1首先被迁移至细胞核,在那里它被BIN2磷酸化。反过来,这启动了BZR1和14-3-3蛋白之间的相互作用,通过未知的机制在14-3-3的帮助下BZR1被促进磷酸化并从细胞核中输出。BR信号通路的激活使BIN2失活并促进其被26S蛋白酶体降解。与此同时,BR信号稳定调节因子X,其可能与14-3-3竞争与磷酸化BZR1的相互作用,并帮助将胞质中磷酸化的BZR1募集到细胞核,在细胞核中,BZR1被PP2A去磷酸化。
热胁迫-糖酵解酶GAPC
甘油醛-3-磷酸脱氢酶(GAPDH)是一种糖酵解酶,可将甘油醛-3-磷酸转化为1,3-二磷酸甘油酸。编码GAPDH的GAPC基因被证明在植物非生物和生物胁迫中起着重要作用,GAPC主要定位于细胞质,但当植物遭受胁迫后,其会转移至细胞核,但由于其本身不具有核定位信号,因而具体的质核转移机制仍不明确。
2020年,密苏里大学圣路易斯分校王学敏团队在Nature Communications杂志上发表了一篇题为“Nuclear moonlighting of cytosolic glyceraldehyde-3-phosphate dehydrogenase regulates Arabidopsis response to heat stress”的研究论文,该研究发现GAPC与转录因子NF-YC10互作,这种互作对热胁迫下GAPC的质核转移是必需的,且GAPC的过表达能增强NF-YC10与热胁迫相关基因的启动子结合的能力,进而增强植株的耐热性。

图7 热胁迫引起GAPC在细胞核内积累(Kim et al., 2020)。(a、c)过表达GAPC-GFP的5日龄拟南芥幼苗在未处理或40℃下处理6h后,拍摄其叶肉细胞的荧光图像;(b)具有核GAPC的细胞数量;(d、e)GAPC在胞质和核中的免疫印迹检测及条带强度比较。结果显示,经热胁迫处理后,许多叶表皮细胞的细胞核中能检测到显著的GAPC1-GFP和GAPC2-GFP信号,免疫印迹检测实验也证实了这一点。
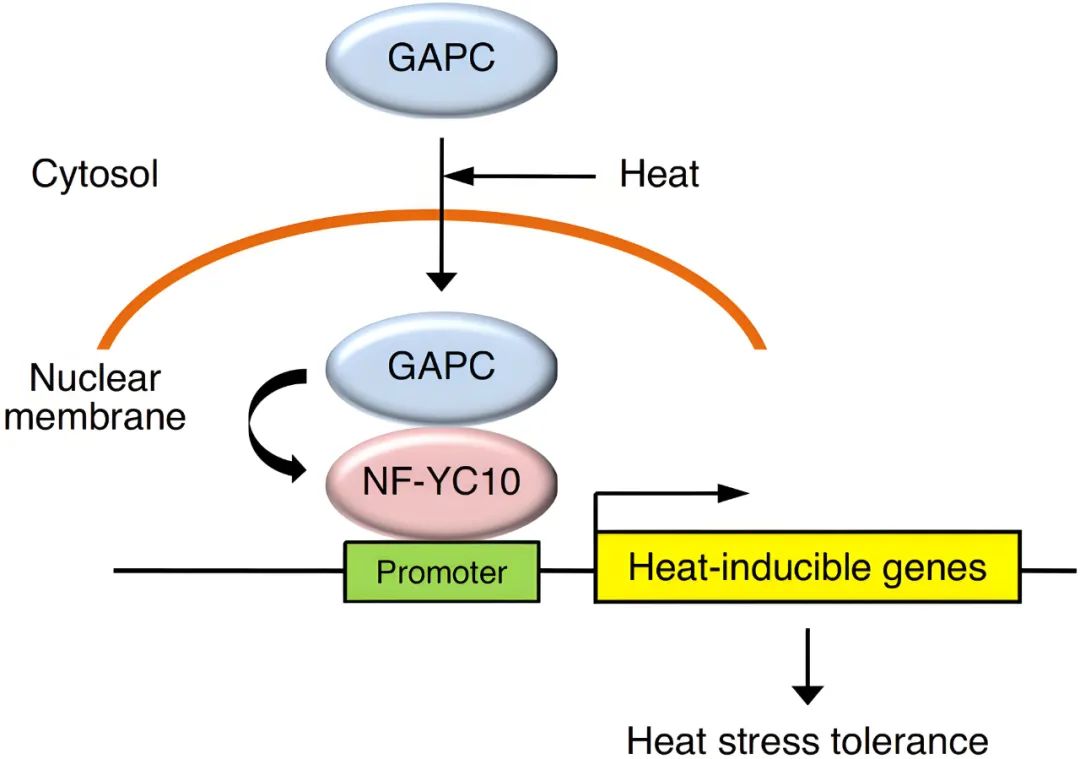
图8 拟南芥中GAPC介导的热胁迫响应模型(Kim et al., 2020)。GAPC通常存在于细胞质基质中,经热胁迫后进入细胞核。在细胞核中,GAPC与转录因子NF-YC10结合,增加热诱导基因的表达,使拟南芥对热胁迫具有耐受性。
冷胁迫-分子伴侣14-3-3
2017年,中国农业大学杨淑华团队在Molecular Cell杂志上发表了一篇题为“Plasma membrane CRPK1-mediated phosphorylation of 14-3-3 proteins induces their nuclear import to fine-tune CBF signaling during cold response”的研究论文,该研究较完整地讲述了冷胁迫信号从细胞膜传递至细胞核的过程。作者发现,冷胁迫能激活冷响应蛋白激酶1(CRPK1,一种质膜蛋白)磷酸化磷酸肽结合蛋白14-3-3,使磷酸化的14-3-3蛋白发生质核转移,在细胞核中,14-3-3与冷反应C-重复序列结合因子(CBF)蛋白相互作用并使其不稳定,从而调节植物的耐冷性。

图9 冷胁迫诱导14-3-3从细胞质迁移至细胞核(Liu et al., 2017)。(A、B)在野生型(A)或crpk1-1突变体(B)中表达14-3-3λ-GFP的6日龄拟南芥幼苗,在4℃下处理0或3h后,观察14-3-3λ的亚细胞定位情况;(C、D)野生型(C)或crpk1-1突变体(D)的12日龄幼苗,在4℃下处理0或3h后,提取总蛋白(T)、核蛋白(N)或可溶性蛋白(S),用14-3-3的抗体做免疫印迹实验。结果显示,冷胁迫诱导14-3-3蛋白由胞质迁移至核,且这一过程依赖CRPK1蛋白;冷胁迫不影响野生型和crpk1-1突变体中14-3-3蛋白的总量。
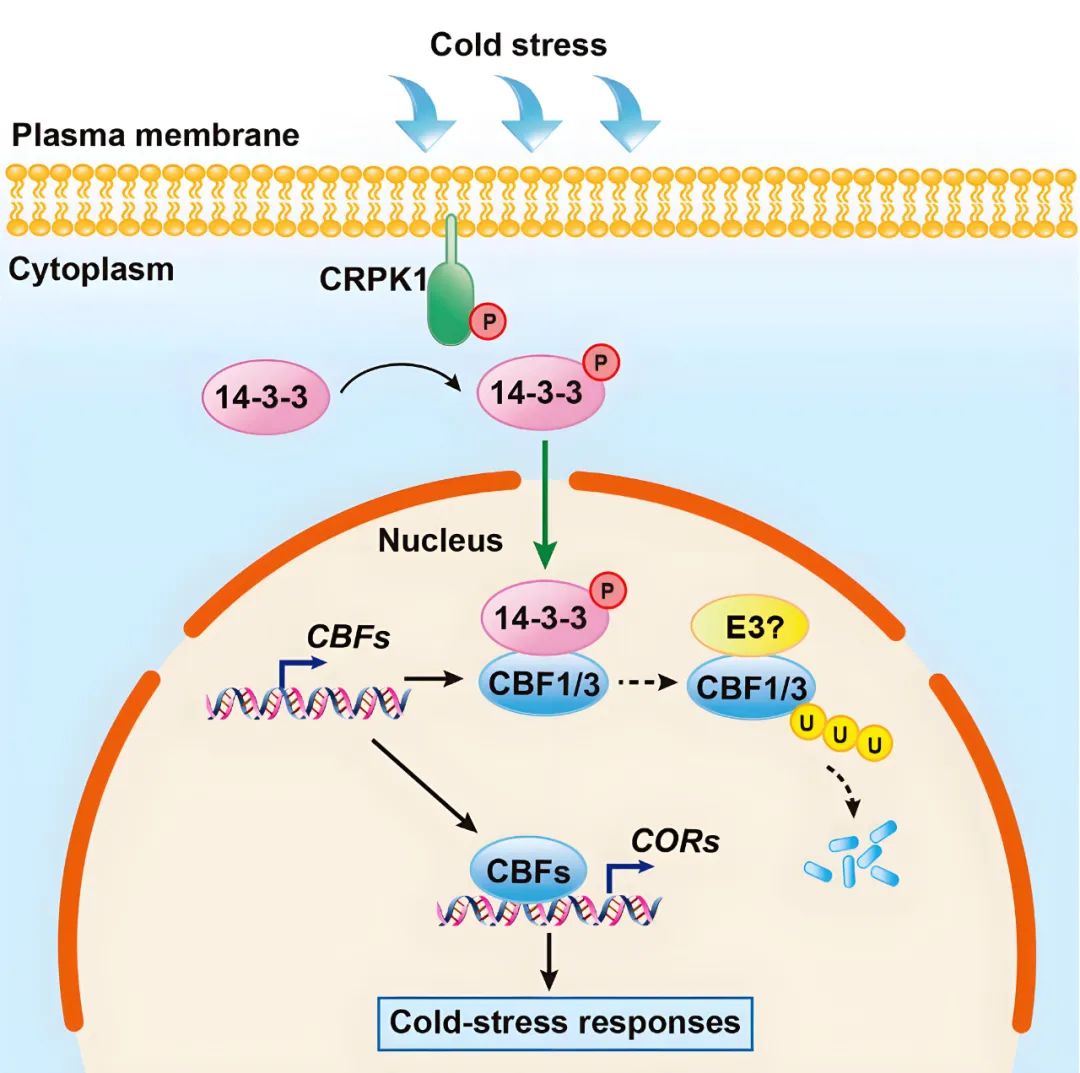
图10 CRPK1和14-3-3蛋白调控CBF信号通路的模型(Liu et al., 2017)。未知的RLK可能参与冷信号感知,并在冷胁迫下磷酸化CRPK1,之后CRPK1磷酸化14-3-3蛋白,使其由细胞质迁移到细胞核,促进26S蛋白酶体介导的CBF1和CBF3的降解,从而负向调节冷调节基因COR的表达和耐冷性。
光/热-CRY1/HsfA1d
提到光,就不得不提到光受体。小远在之前的文章“植物的‘眼睛’——光受体”以及“植物中的温度感受器-知热篇”提到了植物的光敏色素具有红光吸收型(Pr)和远红光吸收型(Pfr)两种构象形式,黑暗中植物的光敏色素主要为无活性的Pr,定位于细胞质,性质稳定,不易降解,但在红光照射或高温条件下,Pr转换为具有生物活性的Pfr,Pfr会进入细胞核。这部分质核迁移的内容大家可以参考之前的文章,小远就不多讲了。今天主要给大家分享另一种受到光诱导后发生质核迁移的蛋白。
2023年,河南农业大学郑旭、矫永庆、史勇团队和怀特海德生物医学研究所David Pincus团队在Cell Reports杂志上发表了一篇题为“Blue light receptor CRY1 regulates HSFA1d nuclear localization to promote plant thermotolerance”的研究论文,作者定义了“光诱导耐受性(Light-induced thermotolerance,LIT)”即蓝光预处理能使植物热耐受性增强这一概念,并且通过实验解释了这一现象产生的分子机理:蓝光受体CRY1是LIT产生所必需的,而CRY1与热休克转录因子HsfA1d相互作用,CRY1通过核转运蛋白IMPα1促进HsfA1d从细胞质迁移至细胞核,且CRY1与HsfA1d共享超过一半的染色质结合位点,因而在细胞核中,CRY1与HsfA1d分别或共同占据靶启动子结合位点,激活热胁迫相关基因的转录,最终提高植物在高温下存活的概率。
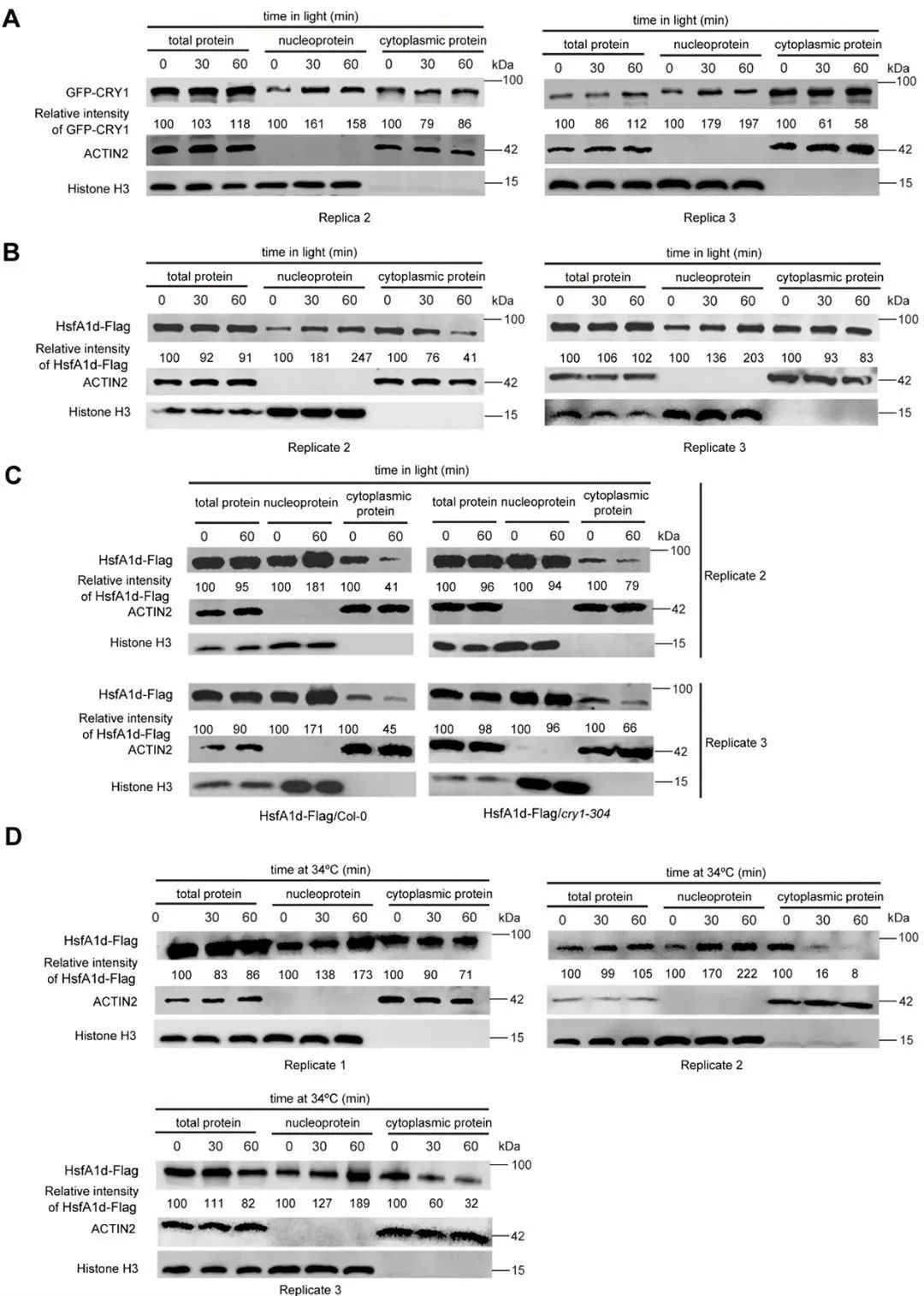
图11 蓝光、高温对CRY1和HsfA1d的核定位影响(Gao et al., 2023)。(A、B)CRY1和HsfA1d在受到蓝光照射后会从细胞质转移至细胞核;(C)在cry1突变体中,HsfA1d在受到蓝光照射后不会转移至细胞核;(D)高温处理同样也会触发HsfA1d向核转移。
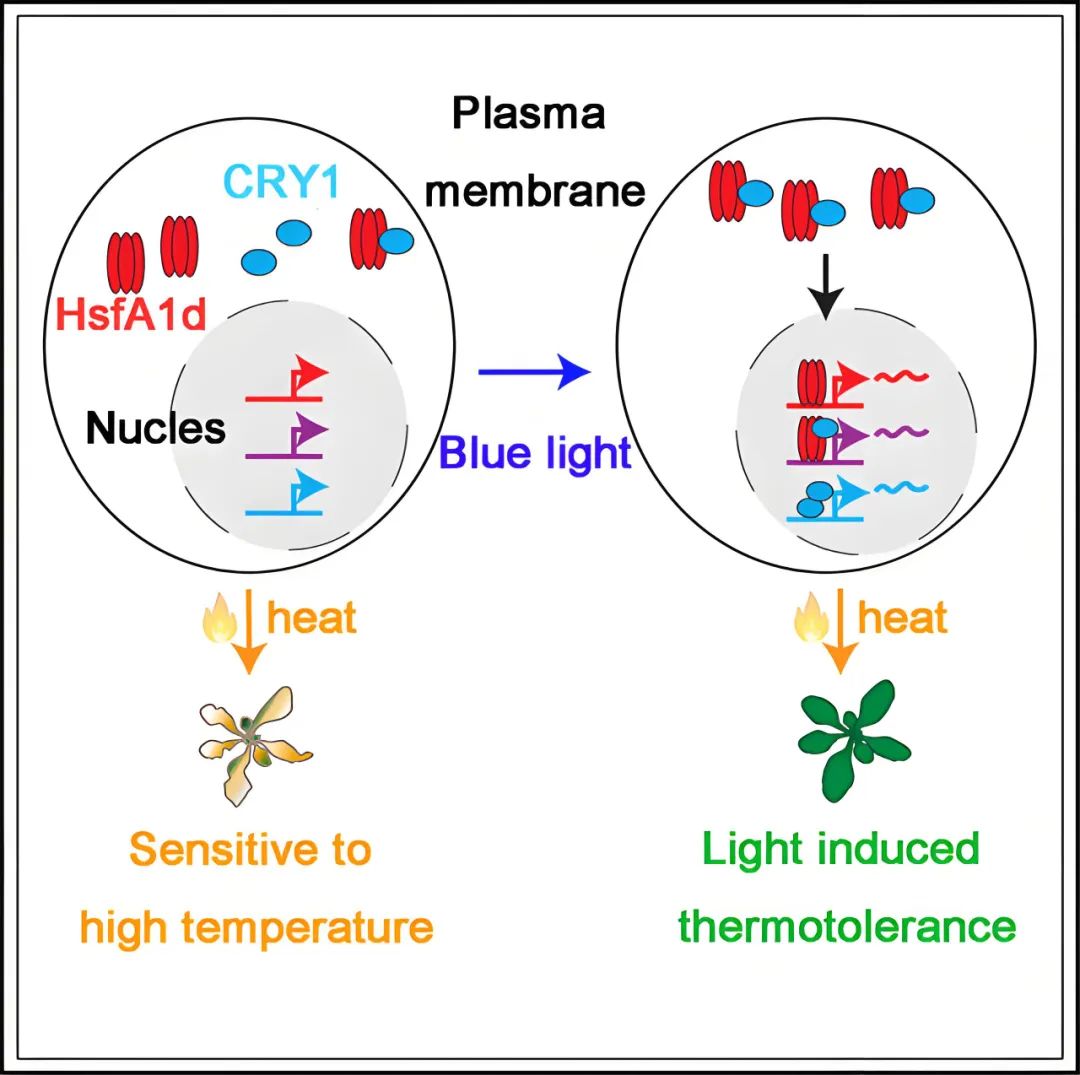
图12 CRY1和HsfA1d转录因子介导了光诱导耐受性的产生(Gao et al., 2023)。红色三聚体表示HsfA1d,青色椭圆表示CRY1,在细胞核中,红色、紫色和青色基因表示由HsfA1d、CRY1和HsfA1d、仅CRY1调控。
伯远生物(https://plant.biorun.com)给大家介绍了多个由质入核的蛋白案例,让我们再来回忆一下:病原菌侵染导致GBPL3向核迁移,通过IDR结构域形成GDACs凝聚体,直接结合防御基因启动子且招募转录复合体;当BR通路激活时,细胞质内磷酸化的BZR1迁移至细胞核后发生去磷酸化;热胁迫诱导GAPC通过与NF-YC10蛋白互作入核,且增强了NF-YC10与热胁迫相关基因的启动子结合的能力;冷胁迫促使CRPK1激酶磷酸化14-3-3,导致其迁移至核,在核内降解CBFs,负调控植物耐冷性;蓝光触发CRY1通过IMPα1转运HsfA1d入核,共享染色质结合位点激活热胁迫基因,光温耦合调控提升作物的适应性。不难看出,翻译后修饰、蛋白相互作用和相分离这些分子机制在质核转移中的关键作用,这些机制使植物能够快速响应病原体、激素、光和温度等胁迫,调控基因表达以适应环境变化。
最后,根据以上这些文章,我们来梳理一下可以从哪些实验来探究植物基因由质入核的分子机制。
从蛋白互作角度,可参考图8的文章:
1,亚细胞定位实验:发现A受到某种胁迫后发生质核转移。
2,可从A的互作蛋白入手解析质核转移机制:先筛选出A的互作蛋白B(B可能是核内与该胁迫相关的转录因子、核转运蛋白家族成员、分子伴侣等),再点对点验证A和B的互作关系(体外和体内实验均需涉及到)。

3,转基因株系的表型及生理生化实验:A、B过表达和敲除株系的表型测定、生理生化指标测定、转基因株系的定量PCR检测等,由此可判断A、B对该胁迫反应是正向还是负向调控。
4,A和B的遗传学实验/表型拯救实验:确认A和B的上下游关系或A在质核转移过程中B存在的必要性。
5,升级版亚细胞定位实验、核质分离WB实验:在非胁迫与胁迫处理后,检测A、B在胞质、细胞核中的含量变化情况。
6,转基因实验、体外WB检测、体内WB检测:检测A的关键位点突变对胁迫耐受性的影响、对A质核转移的影响以及对B互作情况的影响。
7,ChIP、EMSA实验:检测B对核内该胁迫相关基因启动子的结合能力。
8,得出结论:受某种胁迫后,A发生质核转移,A和B的互作/B的存在是A发生质核转移的必要条件,A进入细胞核后影响其下游该胁迫相关基因的表达或其互作蛋白的降解,进而使植物更适应/更不适应该胁迫。
从蛋白修饰角度,可参考图10的文章:
1,转基因株系的表型及生理生化实验:发现A负调控某种胁迫。
2,从A的互作蛋白入手:先筛选出A的互作蛋白B(B可能是核内与该胁迫相关的转录因子、核转运蛋白家族成员、分子伴侣等),再点对点验证A和B的互作关系(体外和体内实验均需涉及到)。
3,若A是一种激酶,可从蛋白修饰进一步研究A和B的关系:以磷酸化为例,由体内、体外磷酸化WB实验证实在胁迫条件下,A能磷酸化B。
4,转基因实验、体外WB检测、体内WB检测:检测A的关键位点突变对胁迫耐受性的影响,以及对B磷酸化的影响。
5,IP-MS、体外WB检测、体内WB检测:确认B被磷酸化的位点,该位点突变对磷酸化的影响。
6,转基因实验、亚细胞定位实验、核质分离WB实验:在非胁迫与胁迫处理后,检测B及B关键位点突变后在胞质、细胞核中的含量变化情况,发现B受到该胁迫后发生质核转移。
7,转基因实验、表型拯救实验:确认B在质核转移过程中A磷酸化B的必要性。
8,B影响了C的靶基因表达,因而深入研究了B和C的关系:发现B与C互作,并促进了C的泛素化降解。
9,得出结论:受某种胁迫后,A磷酸化B,B进入细胞核后泛素化降解C,进而使植物更适应/更不适应该胁迫。
如果已经发现了某蛋白的核质转移现象,可参考图6的文章,深入研究核质转移的细节;如发现核质转移与相分离有关,可参考图3的文章。如果有其他能参考研究思路的文献,欢迎大家分享给伯远生物(https://plant.biorun.com)呦!
References:
Huang S, Zhu S, Kumar P, MacMicking JD (2021) A phase-separated nuclear GBPL circuit controls immunity in plants. NATURE 594: 424-429
Kim SC, Guo L, Wang X (2020) Nuclear moonlighting of cytosolic glyceraldehyde-3-phosphate dehydrogenase regulates Arabidopsis response to heat stress. NAT COMMUN 11: 3439
Liu Z, Jia Y, Ding Y, Shi Y, Li Z, Guo Y, Gong Z, Yang S (2017) Plasma Membrane CRPK1-Mediated Phosphorylation of 14-3-3 Proteins Induces Their Nuclear Import to Fine-Tune CBF Signaling during Cold Response. MOL CELL 66: 117-128
Srivastava M, Srivastava AK, Orosa-Puente B, Campanaro A, Zhang C, Sadanandom A (2020) SUMO Conjugation to BZR1 Enables Brassinosteroid Signaling to Integrate Environmental Cues to Shape Plant Growth. CURR BIOL 30: 1410-1423
Wang R, Wang R, Liu M, Yuan W, Zhao Z, Liu X, Peng Y, Yang X, Sun Y, Tang W (2021) Nucleocytoplasmic trafficking and turnover mechanisms of BRASSINAZOLE RESISTANT1 in Arabidopsis thaliana. P NATL ACAD SCI USA 118
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








