这种六肽 FRET 底物来源于病毒 gag-pol 多蛋白的 p24/p15 切割位点。已经开发出一种简单、连续的 HIV 蛋白酶荧光测定法,可以筛选潜在的 HIV 蛋白酶抑制剂。Km (2.1 μM) 和 kcat (7.4 s⁻¹) 的值由低酶浓度下的稳态数据计算得出。激发波长为 280 nm,发射波长 > 435 nm。
This hexapeptide FRET substrate is derived from the p24/p15 cleavage site of the viral gag-pol poly-protein. A simple, continuous fluorometric assay for HIV protease has been developed, which allows the screening of potential HIV protease inhibitors. Values for Km (2.1 μM) and kcat (7.4 s⁻¹) were calculated from steady-state data at a low concentration of the enzyme. Excitation at 280 nm, emission at > 435 nm.
编号: 200060
中文名称: 蒽基HIV蛋白酶底物、Anthranilyl-HIV Protease Substrate
英文名: Anthranilyl-HIV Protease Substrate
CAS号: 133233-38-2
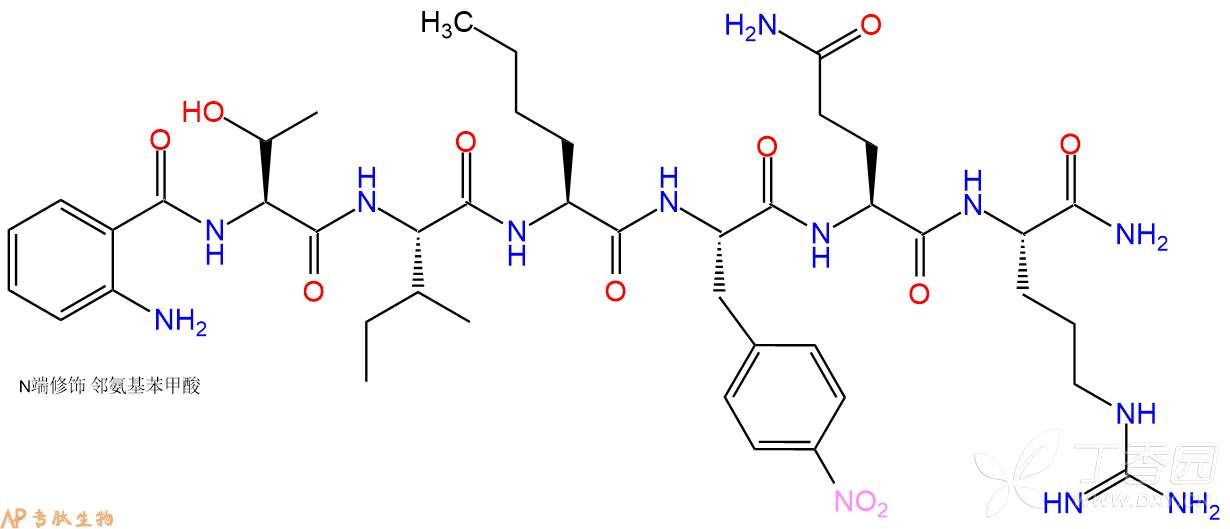
单字母: Abz-TI-Nle-F(4NO2)-QR-NH2
三字母: Abz-Thr-Ile-Nle-Phe(4NO2)-Gln-Arg-NH2
氨基酸个数: 6
分子式: C43H65N13O11
平均分子量: 940.06
精确分子量: 939.49
等电点(PI): -
pH=7.0时的净电荷数: 1
平均亲水性: -0.55
疏水性值: 0.4
来源: 人工化学合成,仅限科学研究使用,不得用于人体。
储存条件: 负80℃至负20℃
标签: 氨基酸衍生物肽 抑制剂相关肽 侧链保护基肽 传染病学
文献:
DOI 名称
10.1021/bi0116543 HIV-1 protease: characterization of a catalytically competent enzyme-substrate intermediate 下载
10.1021/bi011781z Anisotropic dynamics of the JE-2147-HIV protease complex: drug resistance and thermodynamic binding mode examined in a 1.09 A structure 下载
10.1002/cmdc.200500063 A potent HIV protease inhibitor identified in an epimeric mixture by high-resolution protein crystallography 下载
10.1021/jm701142s Structure-guided design of C2-symmetric HIV-1 protease inhibitors based on a pyrrolidine scaffold 下载
10.1021/jm800149m A copper(I)-catalyzed 1,2,3-triazole azide-alkyne click compound is a potent inhibitor of a multidrug-resistant HIV-1 protease variant 下载
10.1002/cmdc.200900452 Pyrrolidine derivatives as plasmepsin inhibitors: binding mode analysis assisted by molecular dynamics simulations of a highly flexible protein 下载
10.1111/j.1399-3011.1990.tb00994.x A simple, continuous fluorometric assay for HIV protease 下载
10.1016/j.jmb.2011.04.052 Two solutions for the same problem: multiple binding modes of pyrrolidine-based HIV-1 protease inhibitors 下载
10.1016/j.jmb.2011.03.038 Accessory mutations maintain stability in drug-resistant HIV-1 protease 下载
10.1021/jm300072d Potent antiviral HIV-1 protease inhibitor GRL-02031 adapts to the structures of drug resistant mutants with its P1'-pyrrolidinone ring 下载
10.1021/jm301519z Novel P2 tris-tetrahydrofuran group in antiviral compound 1 (GRL-0519) fills the S2 binding pocket of selected mutants of HIV-1 protease 下载
10.1002/anie.201309682 Structure-based design of inhibitors of the aspartic protease endothiapepsin by exploiting dynamic combinatorial chemistry 下载
10.1021/cb5009487 Colloidal aggregation and the in vitro activity of traditional Chinese medicines 下载
10.1021/acs.jmedchem.5b00474 Substituted Bis-THF Protease Inhibitors with Improved Potency against Highly Resistant Mature HIV-1 Protease PR20 下载
10.1073/pnas.90.24.11638 Catalytic contribution of flap-substrate hydrogen bonds in "HIV-1 protease" explored by chemical synthesis 下载
10.1128/jvi.76.3.1359-1368.2002 Altered substrate specificity of drug-resistant human immunodeficiency virus type 1 protease 下载
10.1016/j.jmb.2008.07.062 Structural and kinetic analysis of pyrrolidine-based inhibitors of the drug-resistant Ile84Val mutant of HIV-1 protease 下载
10.1021/bi200033z The L76V drug resistance mutation decreases the dimer stability and rate of autoprocessing of HIV-1 protease by reducing internal hydrophobic contacts 下载
10.1021/jm3001136 Synthesis and biological activity of potent HIV-1 protease inhibitors based on Phe-Pro dihydroxyethylene isosteres 下载
- 定义
- 酶是用于生化反应的非常有效的催化剂。它们通过提供较低活化能的替代反应途径来加快反应速度。酶作用于底物并产生产物。一些物质降低或什至停止酶的催化活性被称为抑制剂。
- 发现
- 1965年,Umezawa H分析了微生物产生的酶抑制剂,并分离出了抑制亮肽素和抗痛药的胰蛋白酶和木瓜蛋白酶,乳糜蛋白酶抑制的胰凝乳蛋白酶,胃蛋白酶抑制素抑制胃蛋白酶,泛磷酰胺抑制唾液酸酶,乌藤酮抑制酪氨酸羟化酶,多巴汀抑制多巴胺3-羟硫基嘧啶和多巴胺3-羟色胺酶酪氨酸羟化酶和多巴胺J3-羟化酶。最近,一种替代方法已应用于预测新的抑制剂:合理的药物设计使用酶活性位点的三维结构来预测哪些分子可能是抑制剂1。已经开发了用于识别酶抑制剂的基于计算机的方法,例如分子力学和分子对接。
- 结构特征
- 已经确定了许多抑制剂的晶体结构。已经确定了三种与凝血酶复合的高效且选择性的低分子量刚性肽醛醛抑制剂的晶体结构。这三种抑制剂全部在P3位置具有一个新的内酰胺部分,而对胰蛋白酶选择性最高的两种抑制剂在P1位置具有一个与S1特异性位点结合的胍基哌啶基。凝血酶的抑制动力学从慢到快变化,而对于胰蛋白酶,抑制的动力学在所有情况下都快。根据两步机理2中稳定过渡态络合物的缓慢形成来检验动力学。
- 埃米尔•菲舍尔(Emil Fischer)在1894年提出,酶和底物都具有特定的互补几何形状,彼此恰好契合。这称为“锁和钥匙”模型3。丹尼尔·科什兰(Daniel Koshland)提出了诱导拟合模型,其中底物和酶是相当灵活的结构,当底物与酶4相互作用时,活性位点通过与底物的相互作用不断重塑。
- 在众多生物活性肽的成熟过程中,需要由其谷氨酰胺(或谷氨酰胺)前体形成N末端焦谷氨酸(pGlu)。游离形式并与底物和三种咪唑衍生抑制剂结合的人QC的结构揭示了类似于两个锌外肽酶的α/β支架,但有多个插入和缺失,特别是在活性位点区域。几种活性位点突变酶的结构分析为针对QC相关疾病5的抑制剂的合理设计提供了结构基础。
- 作用方式
- 酶是催化化学反应的蛋白质。酶与底物相互作用并将其转化为产物。抑制剂的结合可以阻止底物进入酶的活性位点和/或阻止酶催化其反应。抑制剂的种类繁多,包括:非特异性,不可逆,可逆-竞争性和非竞争性。可逆抑制剂 以非共价相互作用(例如疏水相互作用,氢键和离子键)与酶结合。非特异性抑制方法包括最终使酶的蛋白质部分变性并因此不可逆的任何物理或化学变化。特定抑制剂 对单一酶发挥作用。大多数毒药通过特异性抑制酶发挥作用。竞争性抑制剂是任何与底物的化学结构和分子几何结构非常相似的化合物。抑制剂可以在活性位点与酶相互作用,但是没有反应发生。非竞争性抑制剂是与酶相互作用但通常不在活性位点相互作用的物质。非竞争性抑制剂的净作用是改变酶的形状,从而改变活性位点,从而使底物不再能与酶相互作用而产生反应。非竞争性抑制剂通常是可逆的。不可逆抑制剂与酶形成牢固的共价键。这些抑制剂可以在活性位点附近或附近起作用。
- 功能
- 工业应用中, 酶在商业上被广泛使用,例如在洗涤剂,食品和酿造工业中。蛋白酶用于“生物”洗衣粉中,以加速蛋白质在诸如血液和鸡蛋等污渍中的分解。商业上使用酶的问题包括:它们是水溶性的,这使得它们难以回收,并且一些产物可以抑制酶的活性(反馈抑制)。
- 药物分子,许多药物分子都是酶抑制剂,药用酶抑制剂通常以其特异性和效力为特征。高度的特异性和效力表明该药物具有较少的副作用和较低的毒性。酶抑制剂在自然界中发现,并且也作为药理学和生物化学的一部分进行设计和生产6。
- 天然毒物 通常是酶抑制剂,已进化为保护植物或动物免受天敌的侵害。这些天然毒素包括一些已知最剧毒的化合物。
- 神经气体( 例如二异丙基氟磷酸酯(DFP))通过与丝氨酸的羟基反应生成酯,从而抑制了乙酰胆碱酯酶的活性位点。
- 参考
- 1、Scapin G (2006). Structural biology and drug discovery. Curr. Pharm. Des., 12(17):2087–2097.
- 2、Krishnan R, Zhang E, Hakansson K, Arni RK, Tulinsky A, Lim-Wilby MS, Levy OE, Semple JE, Brunck TK (1998). Highly selective mechanism-based thrombin inhibitors: structures of thrombin and trypsin inhibited with rigid peptidyl aldehydes. Biochemistry, 37 (35):12094-12103.
- 3、Fischer E (1894). Einfluss der configuration auf die wirkung der enzyme. Ber. Dt. Chem. Ges., 27:2985–2993.
- 4、Koshland DE (1958). Application of a theory of enzyme specificity to protein synthesis. PNAS., 44 (2):98–104.
- 5、Huang KF, Liu YL, Cheng WJ, Ko TP, Wang AH (2005). Crystal structures of human glutaminyl cyclase, an enzyme responsible for protein N-terminal pyroglutamate formation. PNAS., 102(37):13117-13122.
- 6、Holmes CF, Maynes JT, Perreault KR, Dawson JF, James MN (2002). Molecular enzymology underlying regulation of protein phosphatase-1 by natural toxins. Curr Med Chem., 9(22):1981-1989.

























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








