第一章 原子结构及键合
1.1 原子结构
基态:在正常状态下,原子处于最低能级,电子在离核最近的轨道上运动的这种定态。
电离能:基态原子失去最外层的一个电子(价电子)所需的能量。
亲和能:基态原子获得一个电子成为负离子所释放出的能量。
电负性:原子获得电子的能力。
1.2原子间键合
**极性:**元素不同。中心原子的化合价的绝对值不等于中心原子的最外层电子数。
**非极性:**元素相同。中心原子的化合价的绝对值=中心原子的最外层电子数。
1、金属键:金属离子通过正离子和自由电子之间的引力而相互结合所形成的结合键。
无方向性和饱和性
特性:自由电子的存在使金属具有良好的导电性和导热性,良好的金属光泽。原子间发生相对位移时,金属键不受破坏,因而塑性好。
如同,人站着,水流从人之间流过。
2、离子键:活泼的金属元素和活泼的非金属元素之间通过得到或失去电子而形成的结合键。电负性相差大,通过库仑静电引力形成。
无方向性和饱和性
特性:强度和硬度高,熔点高,脆性大。由于离子难以输送电荷,所以是良好的绝缘体。
如同,你抓着我,我抓着你。
3、共价键:相邻原子共享电子对来达到稳定结构所形成的结合键。同族元素和电负性相差不大的元素结合。
有方向性和饱和性
特性:强度高,熔点高,脆性大。导电性取决于共价键的强弱。
如同,你和我抓着同一个篮球。
4、范德瓦耳斯键:原子的正电荷中心和负电荷中心不重叠,则产生一个偶极矩。这种偶极矩所产生的原子间结合力。
无方向性和饱和性
特性:材料熔点和硬度都比较低,是良好的绝缘体材料。
物理键,次价键。

5、氢键:由氢原子同时与两个电负性很大,而原子半径较小的原子相结合形成的二次键。
有方向性和饱和性
构成中间桥梁,又称氢桥。

氢键键能介于化学键和范德瓦尔斯键之间。

第二章 固体结构
2.1 晶体学基础
晶体:周期性规则重复排列。
固定的熔点,各向异性,长程有序。
非晶体:非周期性不规则重复排列。
无固定的熔点,各向同性,短程有序
晶胞的描述:

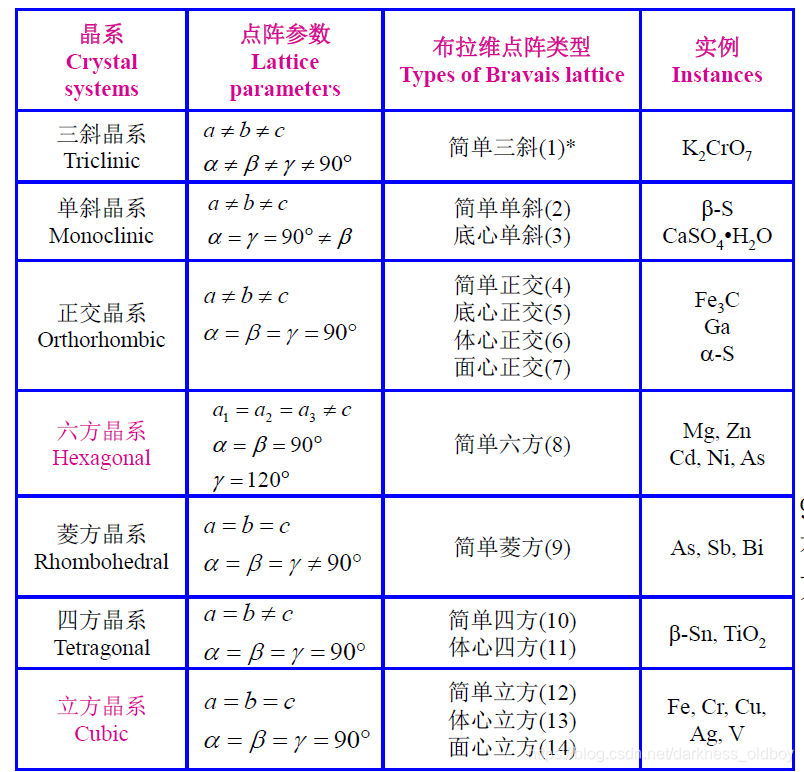
7种晶系和14种布拉维点阵:

2.2晶向指数和晶面指数
晶向[uvw]
若晶体中两晶向相互平行但方向相反,则指数的数字相同,方向相反 ;
晶体中原子排列情况相同但空间位向不同的一组晶向称为晶向族
晶面(hkl)
平行晶面的晶面指数相同,或数字相同,正负号相反
晶体中具有等同条件而只是空间位向不同的各组晶面称为晶面族 {hkl}
六方晶系

晶带:

晶面间距与向夹角


2.3 金属的三种晶体结构
1、面心立方结构 配位数12

2、体心立方结构 配位数8

3、密排六方结构 配位数12

面密度和线密度


合金相


中间相

1、正常价化合物
2、电子化合物
3、尺寸因素化合物



























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








