前言:各类杂环名称
见图: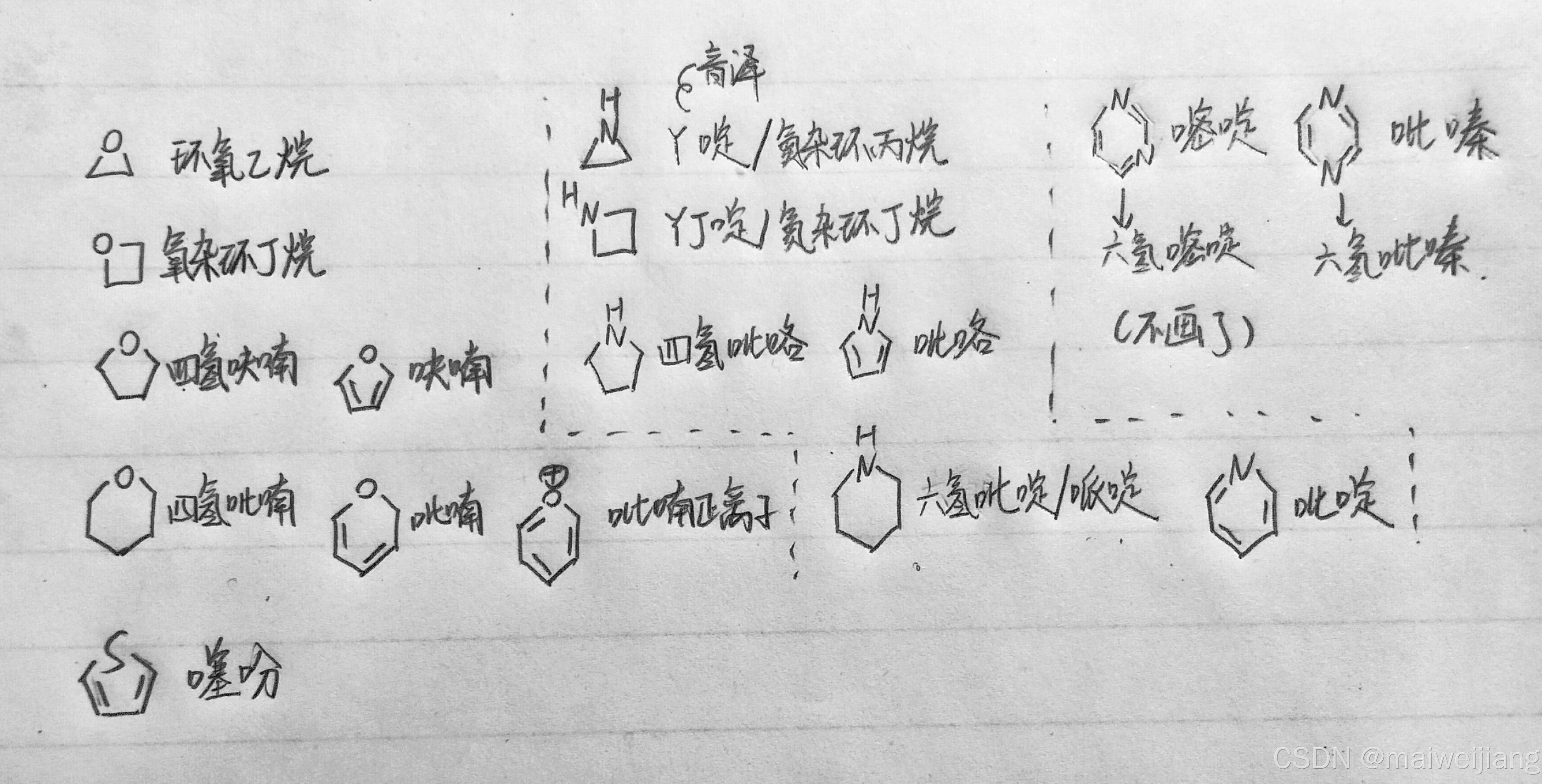
一、醚
简要提及物理性质:甲醚不能任意比互溶的原因,氧可被甲基完全内陷包裹,难以充分与水成氢键。而四氢呋喃等在空间中氧原子成突出部,充分成氢键。
立体电子效应:
杂环中单个孤电子处直立键更稳定,如四氢吡咯
异头碳效应:杂原子相邻的碳原子称异头碳,正常平伏键更稳定,但异头碳因杂原子的孤电子超共轭(孤电子轨道重叠异头碳的反键轨道,类似乙烷)而直立键更稳定(稳定性和反应性都如此)。
1.1 碱性
吞质子成𨦡盐,显而易见
1.2 断碳氧键
成𨦡盐断碳氧键,关键是亲核试剂进攻谁,两个考虑:
1.比较
R
O
−
RO^-
RO−与
R
′
O
−
R'O^-
R′O−稳定性
2.R’与R谁更容易成碳正
(一般两者不会打架,有时第2项的两个都不能形成稳定碳正此时
S
N
2
S_{N2}
SN2,如eg2)
S
N
1
S_{N1}
SN1or
S
N
2
S_{N2}
SN2看能否形成稳定碳正
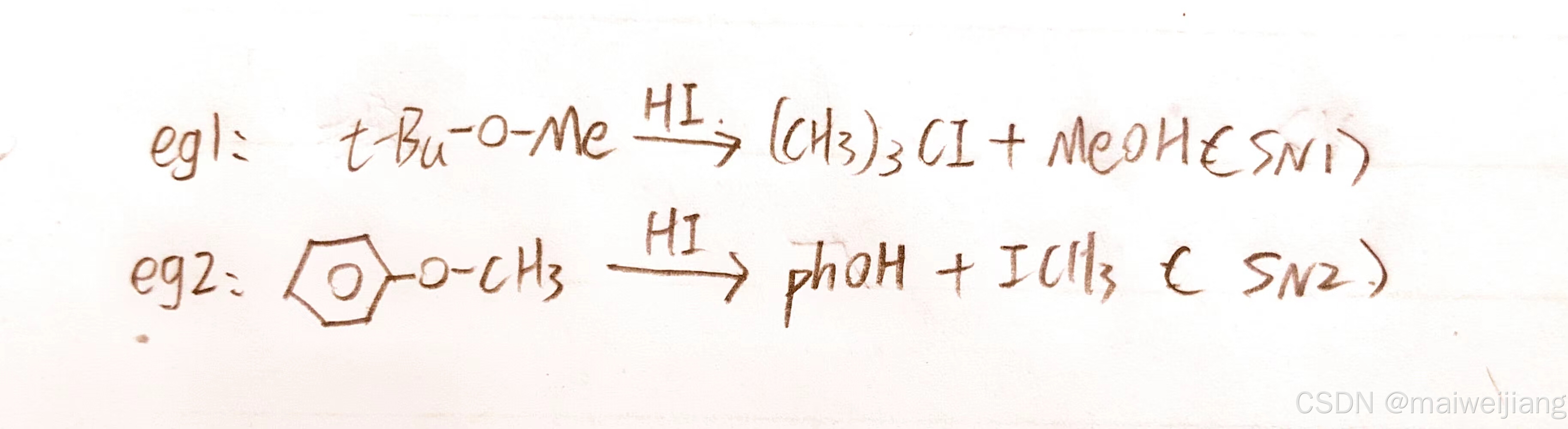
二、环氧化合物
2.1 1,2环氧化合物开环
为
S
N
2
S_{N2}
SN2反应,分两类情况:酸性开环和碱性开环。
酸性开环:
类似
S
N
1
S_{N1}
SN1的
S
N
2
S_{N2}
SN2反应,Lewis酸进攻氧成𨦡盐,区域选择性的主因由位阻变为电荷,分散电荷则中间体更稳定,可视
S
N
1
S_{N1}
SN1分析。水醇酚酸乙硼烷为酸性开环(“酸”指卤素/拟卤素的氢化酸,如HCN)。立体选择性除乙硼烷构型不翻转(过渡态为同一平面内的四元环,而非三角双锥),一般符合
S
N
2
S_{N2}
SN2规律。
硼烷机理:
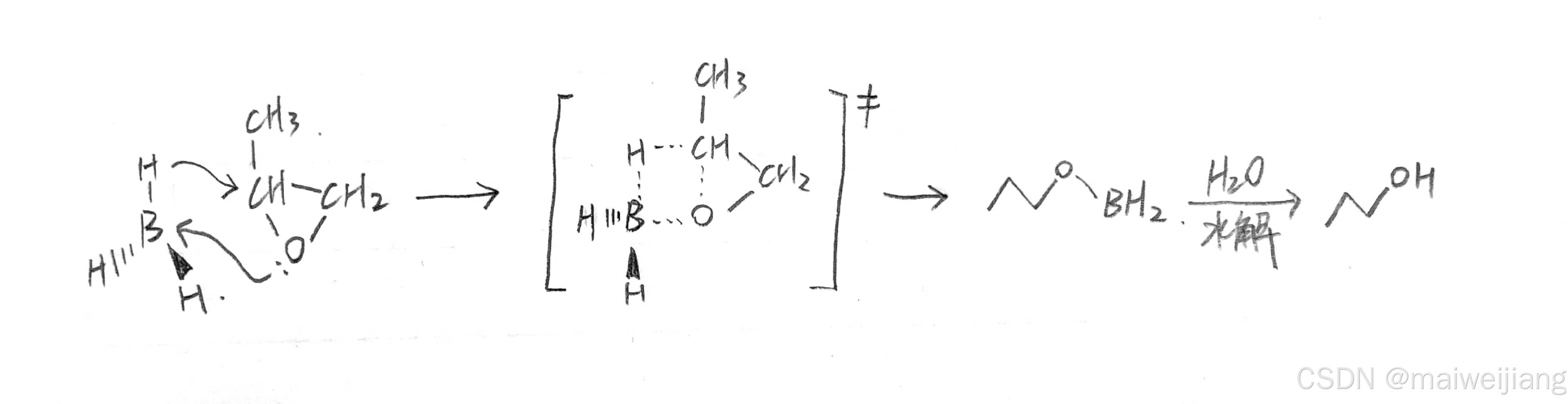
乙硼烷常看成甲硼烷,可以忽略掉乙硼烷的氢桥键(简化模型)。(氢桥键详见:氢键、氢桥键、氢配位键的关系)。过渡态的理解:氧进攻硼,碳因此带正电与氢结合。
碱性开环:
纯的
S
N
2
S_{N2}
SN2反应,位阻主导,同一般规律
氧负格氏氢铝胺,“氧负”指
R
O
−
RO^-
RO−如
O
H
−
OH^-
OH−、
R
O
−
RO^-
RO−、
A
r
O
−
ArO^-
ArO−等,“氢铝”指氢化铝锂LAH,“胺”指脂肪胺,格氏指格氏试剂。立体选择性,也有例外:
铝硼同族,
L
i
A
l
H
4
LiAlH_4
LiAlH4与酸性开环的硼烷异曲同工,过渡态也为共平面的四元环,构型不翻转。
2.2 四五元环开环
相对环氧乙烷而言,环张力下降,性质向链状醚靠近,反应困难,产率下降。
机理:Lewis酸进攻氧成𨦡盐,亲核试剂进攻异头碳开环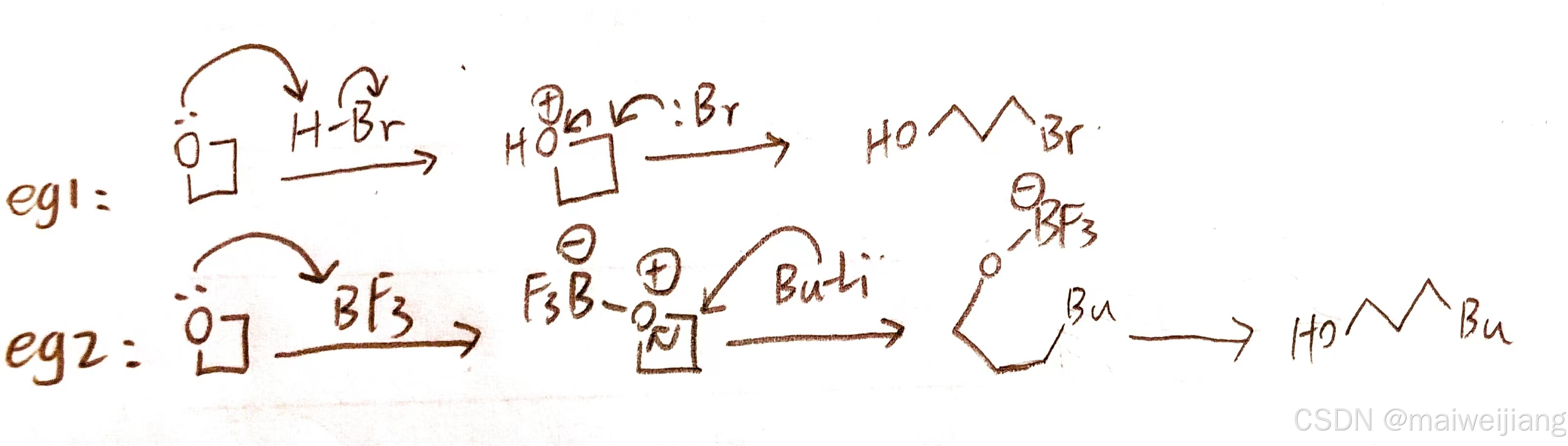
五元环类比即可
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








