本节就是收个尾。
9.4 酶催化
酶包括蛋白和RNA。第四章超分子和分子识别与本节关系很大。
9.4.1 Michaelis- Menten 动力学
对于任何催化反应来说,最简单的模型就是酶最通用的Michaelis-Menten 动力学模型。
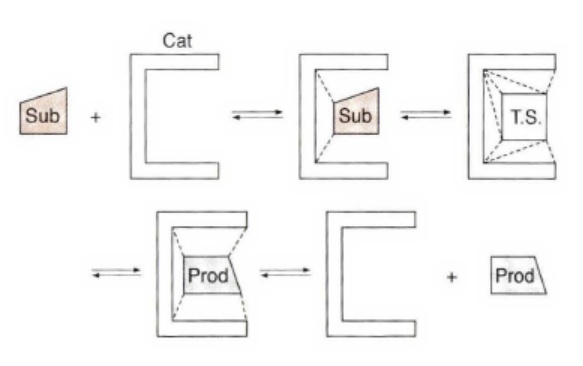
如下面的图,底物(S) 与催化剂(E,对应酶enzyme)处于一个具有非共价的酶-底物络合物E:S 的可逆平衡中。一旦该络合物形成,在决速步以酶一产物络合物的类似物的形式将底物转化成产物。然后,产物从催化剂解离,建立另外一个平衡。

[E]0指酶的总浓度,可以假设[E]=[E]0-[E:S],根据稳态近似[E:S]随时间变化接近0,解出P的产生速率相关方程,就是下图中最后两个式子,这个方程中的KM被称为Michaelis 常数,这个方程被称为Michaelis- Menten 方程。

当[S]>>KM时,
9.4.2 KM,kcat 和kcat/KM 的意义
kcat 的意义最容易理解,它是在催化剂的活性部位之内将底物转化成产物的速率常数,经常被称为转化数。注意它是单分子速率常数,单位为s-1 。前面讨论过的所有能够影响过渡态稳定化的因素也就是说,邻近效应、酸碱催化、静电作用、共价催化和张力的解除——都会影响kcat。
Michaelis 常数(KM ) 的意义要复杂得多。这里有两个极端,如果k-1>>kcat,则KM=k-1/k1,该常数为酶-底物络合物的解离常数(Kd )。因此,许多人认为KM 值能够体现表现解离常数。在这种情况下, KM 提供了洞悉催化剂是多么好的受体的手段。一个小的KM 值意味着催化剂是一种好的受体。注意在这样的假定中, KM 反映的是物理过程(结合)而不是化学转化。
当kcat>> k-1时,会发生另一个极端现象。当KM 接近kcat /k-1时,它只是一系列步骤中第二步对第一步速率常数的比率。这时KM 根本不能代表催化剂-底物络合物的解离常数Kd。
kcat/KM称为专一性常数,底物浓度非常低时(KM >>[S]),上面的式子可以简化成

其中,因为底物很少,可以假设[E]0=[E],以至于酶的总数量与溶液中自由酶的总数量几乎相等。反应表现为二级反应,对酶和底物来说都是一级反应,表现二级反应速率常数是kcat/ KM。
9.4.3 酶活性部位
这个其实药化研究,生化研究什么的讨论的比较多,本书举了一个蓖麻毒素的例子,不是这个例子我想直接跳掉这节了。
酶是一个巨大的分子一一比化学中常用的催化剂大得多。然而,底物的结合和催化转化通常发生在称为活性部位的酶的一个相对较小的区域。通常,活性部位是同酶的“裂缝”和“口袋”相关联的。
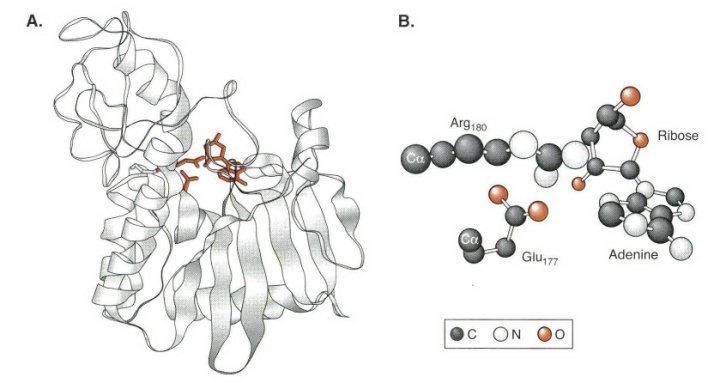
蓖麻毒素酶A是从蓖麻种子里分离得到的一种细胞毒素。因为中毒症状不易觉察,被KGB 用作毒药。这种酶进攻核糖体,水解寡聚核苷酸中特定的腺嘌呤核苷的N-配糖连接。
下图是蓖麻毒素酶A催化反应的可能机理。Glu177 中的羧酸根和由于嘌呤碱的离去生成的氧鎓离子形成离子对,因而稳定了由离去基团离开所形成的过渡态。离去基团与Arg180 中的邻近胍基自发地或质子化或形成离子对,这进一步稳定了上述离去基团离开时所形成的过渡态。在活性部位通过与同样的精氨酸(Arg) 和谷氨酸(Glu)侧链形成氢键而存在的水在第二步中作为亲核试剂。
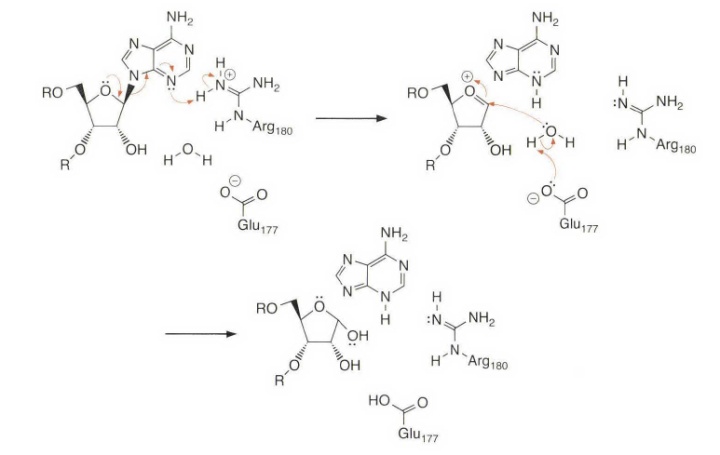
水的亲核性通过一般碱催化增强,如下图所示。一般碱可以是羧酸根,也可以是新生成的胍碱(我们任意地选择羧酸根作为一般碱)。虽然在现实中可能只形成一个离子对,但这里我们列举的是利用腺嘌呤离去基团将胍盐全部去质子化的情况。腺嘌呤的pKa是9 ,而胍盐的pKa大概是12 ,因此除非这些pKa值被它们的微环境(一个明确的可能性)极大地干扰,否则将只形成一个离子对。产生的腺嘌呤碱的N-3 位被质子化,但是这个质子会快速地异构化为更稳定的N-9位质子化产物。当从酶的活性部位失去腺嘌呤和去嘌呤的核酸后,质子转移和结合另一个水分子是再生用于下一个底物分子反应的催化剂所必需的。这就是自然界催化剂的诡异之处。
9.4.4 [S] 对KM一一反应坐标图
这个直接看图就好了,也只用物理有机化学会讨论这种东西。

A 代表了[S] > Kd ( 如果KM 和Kd相似,这里可以用KM 表示)。与底物在游离溶液中的能量相比,底物需要降低能量与酶结合,并且需要翻越能阱达到过渡态。我们可以以图 A为起点,希望酶能进化成为一种更有效的催化剂。加入另外一种与底物和过渡态强度相等的结合相互作用(称为一致的结合改变)决不会降低与kcat有关的能垒,因此也不会加速反应的进行。只作用于过渡态而不是作用于底物的额外的结合相互作用(差异的结合改变)是改进催化过程必需的。这种差异的结合改变不需要十分完美;如果对底物的结合作用有一些改进,则对过渡态有很大的改进,可以看到同样的效果。因此,当[S] > Kd 时,只有在过渡态中发生额外的相互作用时,才能发生催化剂的改进(例如kact/KM 的增加)。

B 代表了[S] < Kd 。同样的,有利于过渡态的差异的结合改变将改进催化。此外,此时一致的结合改变也将改进催化。之所以能发生这种改进作用是因为在这个浓度范围内, Kd的改进会显著提高E:S 络合物的浓度,因此有助于催化。一系列一致的结合改变会改进催化直到底物的结合作用变得如此“好”,以至于Kd 低于自然浓度[S]。
其中,当酶的kcat/KM 在10^8~10^9 L/(mol.s) ,并且KM>[S],将不会再有改进,这些酶被称为理想酶。
9.4.5 超分子相互作用
超分子催化SN2酶的体系。

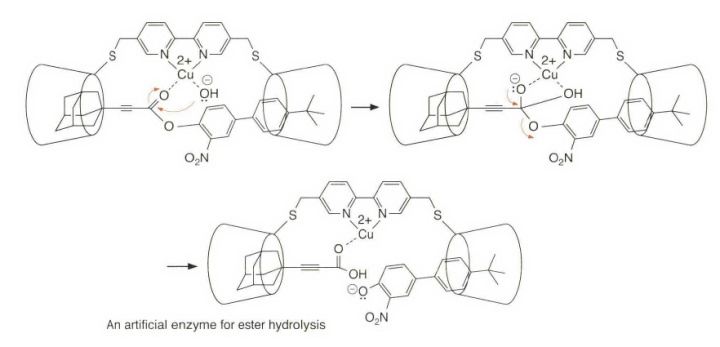
一个人工酶体系,用于酯水解的人工酶,涉及了分子识别和金属离子效应。
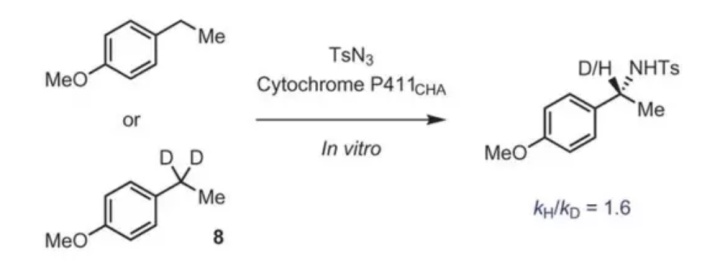
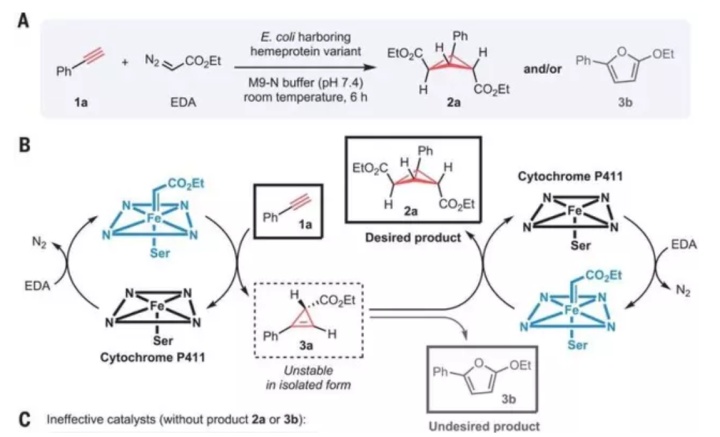
补充:现在研究比较多的是酶催化-不对称反应,反应中的还会出现很多生物化学名词,比如下面这个例子。

2018年诺贝尔奖是酶分子定向进化,这方面的问题能结合之前讲的动力学测试,在催化循环中出现其实也不难。
想象中:《现代物理有机化学》笔记 第九章 习题
想象中:《现代物理有机化学》笔记 第十章机理1







 博客介绍了酶催化相关知识,包括最通用的Michaelis - Menten动力学模型,阐述了KM、kcat和kcat/KM的意义,以蓖麻毒素为例说明酶活性部位,分析了[S]对KM - 反应坐标图,还提及超分子相互作用及人工酶体系,最后提到酶催化 - 不对称反应和酶分子定向进化。
博客介绍了酶催化相关知识,包括最通用的Michaelis - Menten动力学模型,阐述了KM、kcat和kcat/KM的意义,以蓖麻毒素为例说明酶活性部位,分析了[S]对KM - 反应坐标图,还提及超分子相互作用及人工酶体系,最后提到酶催化 - 不对称反应和酶分子定向进化。

















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








