一. 元素周期律
元素周期表历史:八音律----à三元素律------门捷列夫周期表
门捷列夫:1.主要:原子量增加
2.辅助:物理化学性质
现代元素周期律
1. 质子数依次递增
2. 按电子层数换行
3. 质子数=核电荷数=原子序数=电子数
4. 电子层数=周期数
二. 元素周期表结构
1.从上往下:7个周期 第一周期…….第七周期
2.前三周期称为短周期元素(2,8,8),其余为长周期元素(18,18,32,32,)
3.从左往右:18列:主族:IA族~VIIA族
副族:IB族~VIIB族
VIII族:3列
零族元素:1列
副族和VIII族统称过渡元素,主族数=最外层电子数
4.价电子分类:1.nS1~ns2:S区
2.Ns2np1~ns2np6:P区
3.Ns2(n-1)d1~ns2(n-1)d10((n-1)d1ns2~(n-1)d10ns2):d区
4.(n-2)fns2~(n-2)f14ns2 f区
(n-2)f14(n-1)d1ns2~(n-2)f14(n-1)d10ns2 d区
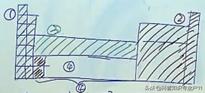
没考虑洪特规则,没有ds区
5.周期表位置推断
1.上下:同族元素原子序数差

2.左右:同周期不同元素 对比IIA、IIIA主族
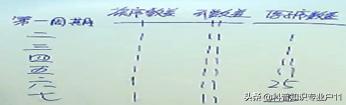
3.从原子序数推位置
20: 第四周期第IIA主族
30: 第四周期第IIB副族
108: 第七周期第VIII族
4.结合图形推测:1~20号元素
5.周期表的细节:
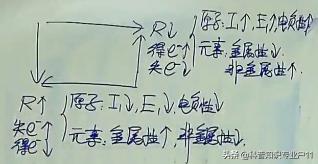
5.1 金属与非金属
过渡元素全是金属元素
5.2 元素个数最多
第3列/IIIB族
5.3 元素对应化合物最多
14列/第IV主族
5.4 物态(常温常压下单质)
固态:金属:金属旁
非金属:石旁
液态:金属:汞
非金属:溴
气态:气
5.6 实际用途
农药:非金属 S P Cl
金属过渡:合金、催化剂
交界:Si 半导体
三. 元素周期律
位置推测结构,结构决定化学性质
原子半径R 得失电子能力----à宏观性质
1. 原子半径比较
1.1 化学键半径(非零族元素) H原子

H气分子:

零族元素原子:单原子分子
分子间作用力标准:非零族原子不与零族原子比较半径
比较依据:
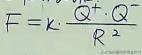
同主族元素R比较:从上往下电子层数增大(主要因素),半径增大
同周期R比较:同周期从左往右,电荷增大(次要因素),引力增大,半径减少
离子与离子R比较:阴阳离子:电子排布同稀有气体原子
电子排布相同的:电荷增大,引力增大,半径减小
电子排布不同的:电子层数增大,半径增大
离子与原子比较:失电子,电子层数因素
得电子,电子间的排斥力增大(最次因素),半径减小
R判断标准小结(主族元素,过渡元素有例外)
电子层数增大,R增大 主
核电荷数增大,半径减小 次
最外层电子数增大,半径增大 最次
2. 得失电子能力比较(主族元素、短周期为主,零族除外)
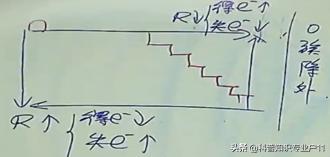
3. 得失电子能力的描述
3.1电离能与亲合能
电离能:原子失去电子时所需要吸收能量的大小(绝对值)

多步失电子比较:I1
不同原子比较电离能I1:失电子能力越强,第一电离能越小,得电子能力越弱。
亲合能:原子得电子时,所放出能量的大小(绝对值)
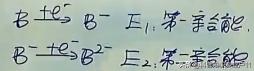
多步得电子比较:E1>E2>E3……
不同原子的E1:EA>EB, B得电子能力比A弱,FB
3.2 电负性
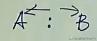
两个原子比较抢电子的能力
电负性越强,吸电子能力越强,失电子能力越弱
3.3 元素
得电子能力:非金属性
失电子能力:金属性
对比:按Cl原子分析
Cl元素非金属性强,得电子能力强
具体:Cl2 氧化性强:得电子
Cl-:只有还原性:失电子
具体物质有价态差别
小结:原子:单原子:I1,E1
两个原子比较:电负性
元素:金属性和非金属性
具体物质:氧化性与还原性
4. 向宏观物质化学性质推广
元素(得失电子):
单质:氧化性或还原性
化合物:金属氧化物的水化物:碱性
非金属:含氧酸:氧化物的水化物:酸性
非含氧酸:氢化物热稳定性
活泼性(越活泼):
金属:金属性越活泼,还原性越强,金属氧化物的水化物的碱性越强
非金属:非金属性越活泼,氧化性越强,非金属最高价氧化物的水化物的酸性越强,非金属氢化物热稳定性越强,非金属氢化物大部分是气态,水、标况氟化氢是液体







 本文详细介绍了元素周期表的历史、结构和周期律,强调了过渡元素的特点,指出主族数等于最外层电子数。内容涵盖原子半径比较、得失电子能力以及电离能、电负性和化学性质的关系,揭示了结构决定化学性质的规律。
本文详细介绍了元素周期表的历史、结构和周期律,强调了过渡元素的特点,指出主族数等于最外层电子数。内容涵盖原子半径比较、得失电子能力以及电离能、电负性和化学性质的关系,揭示了结构决定化学性质的规律。

















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








