常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )

A. a点溶液的pH=2
B. 水的电离程度:a<b<c
C. b点溶液中:c(Y-)+c(HY)=c(Na+)
D. c点溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
此题D选项何解?
0 2 我的解答起点:HX的起点为12,即0.1 mol·L-1的HX中,c(H+)=10-1、c(OH-)=10-13、pH=1,HX为强酸;n(NaOH)=0.01时,lg[c(H+)/c(OH-)]=0,溶液显中性,即恰好完全反应形成正盐。
c点 :n(NaOH)=0.005,所以形成HY:NaY=1:1的混合溶液(缓冲体系)。若都不水解、不电离,HY=1, Na+=Y-=1 ,但HY电离,使c(HY)↓、c(Y-)↑;Y-水解,使c(Y-)↓、c(HY)↑。由于溶液显酸性,知HY电离>Y-水解,那么溶液中最终存在的Y->1,HY<1,而Na+=1。最后,由c(H+)=10-4、c(OH-)=10-10、可得排序c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-),D选项正确。
这样的题,这样的解释,我无比熟悉。
0 3 学生追问是不是只要是弱酸和它的盐溶液1:1混合就是缓冲体系?“缓冲”何解?
0 4 关于缓冲体系类似醋酸和醋酸钠溶液、氨水和氯化铵溶液1:1组成时,由于两个平衡体系的存在,一个平衡使溶液显碱性,一个平衡使溶液显酸性,外加一滴酸或碱在溶液中两个平衡的调节下,使得溶液整体pH变化很小,起到缓冲作用。
如:人体血液维持在正常的pH范围,Na2HPO4/NaH2PO4、HCO3-/H2CO3缓冲对在血液中浓度最高,缓冲能力最强,对维持血液正常pH起到重要作用。

所以整个酸碱中和滴定的过程中,滴加一滴酸或碱,这个点pH值变化最小?但是和我们学的滴定曲线弧度不一致,滴定曲线不是最开始的时候变化最小吗?
0 6 滴定曲线,究竟哪个点斜率最小?以往还真没有这样思考问题?
缓冲体系外加一滴酸或碱,溶液pH值变化最小,这个不会错;那么,只能是滴定曲线有问题,真实的滴定曲线究竟是什么样的?
人教版选修四P48给出了NaOH滴定HCl的曲线
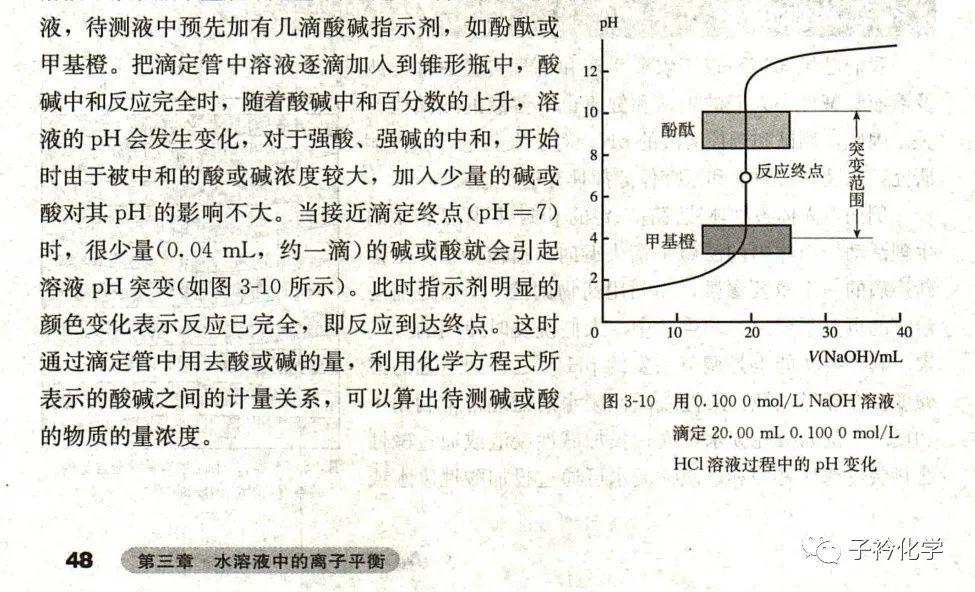
我需要标准的强碱弱酸或者强酸弱碱相互滴定曲线。这样的曲线中,才能出现缓冲体系的点。
知网上,我找到了这个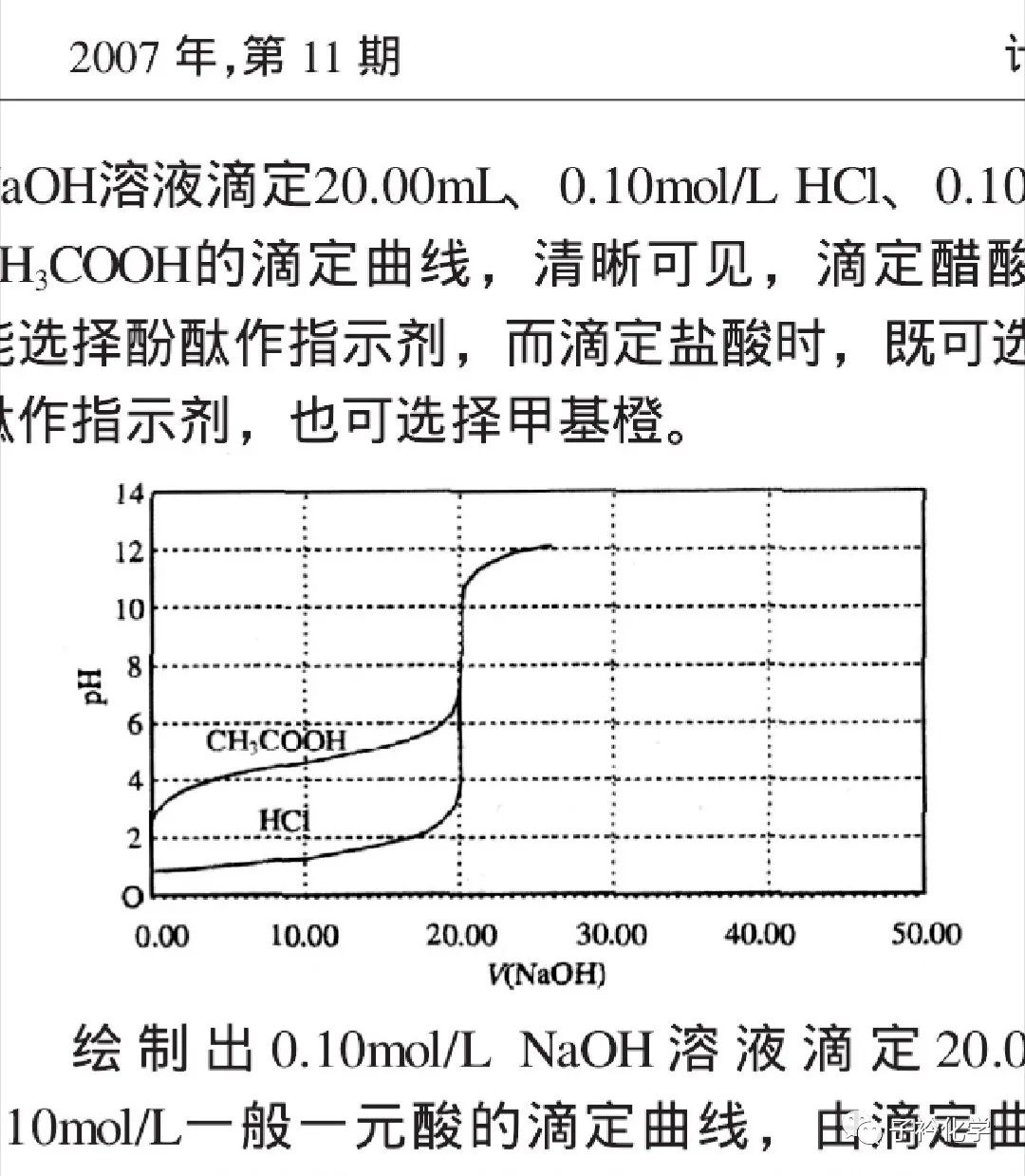
弱酸和强酸分别滴定强碱的曲线是有差异的!
强碱滴定强酸时,确实最初pH变化最小;
而强碱滴定弱酸时,pH变化最小的点,是在缓冲体系处。
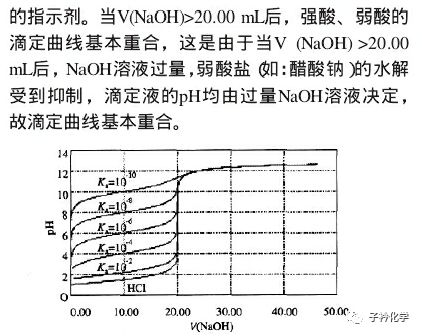
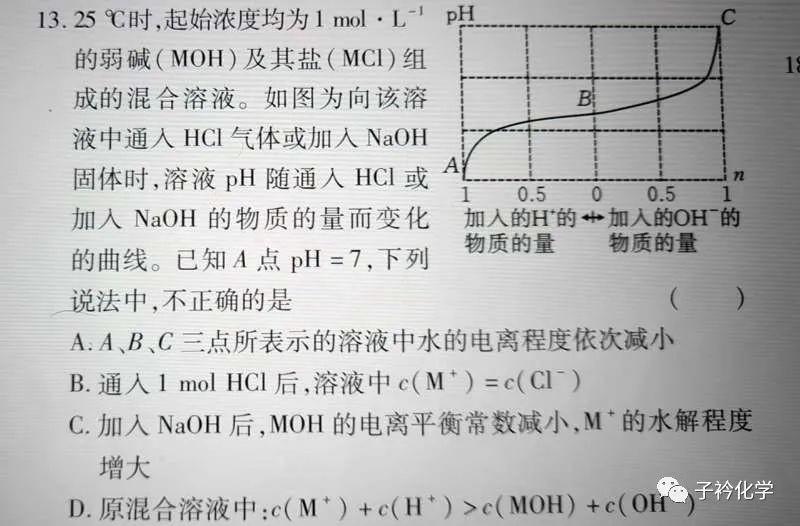
[解析] 此题的起点——B点(MOH:MCl=1:1),即为缓冲体系。抛开正常的酸碱中和滴定曲线,由B出发,B→A加酸,MOH逐渐转为MCl;B→C加碱,MCl逐渐转为MOH,最初pH变化缓慢。A选项,A→B→C,是MOH逐渐增多MCl逐渐减少的过程,对水电离的抑制作用增强,促进作用减弱,A选项正确;B选项,通入1 mol HCl后,溶液为A点,由题A点pH=7,知c(H+)=c(OH-),则c(M+)=c(Cl-),B选项正确;C选项非常明显,电离常数和水解常数一定温度下是定值,不会改变;D选项,根据电荷守恒,有c(M+)+c(H+)=c(Cl-)+c(OH-),B点显碱性,即MOH的电离>M+的水解,那么MOH<1,M+>1,而Cl-=1,所以c(M+)+c(H+)>c(MOH)+c(OH-)。
以上是教学中获得的一点想法,跟大家分享。

谢谢学生,让我在毕业后脱离大学高端学习的情况下,依然能够有所成长和进步。
此之谓“教学相长”。
【声明】
1. 文中2个滴定曲线图,出自《化学教学》期刊:
徐守兵. 利用Excel系统绘制酸碱滴定曲线 [B]. 化学教学. 2007(11).58-60
2. 谢谢安徽蚌埠王孜易老师分享的题目
友情链接
杨海滨 碳、硅及其化合物综合应用题型分析 卢 峰 沈阳云课堂芦老师化学课介绍























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








