第三节 化学平衡
第三课时 化学平衡常数
【三维目标】
知识与技能:理解化学平衡常数的概念,掌握有关化学平衡常数的简单计算。
过程与方法:能用化学平衡常数、转化率判断化学反应进行的程度。
情感态度与价值观:培养学生的逻辑思维能力和科学态度;培养学生理论联系实际能力。
【教学重难点】
教学重点:理解化学平衡常数的概念,平衡常数表达式的书写
教学难点:运用“三段式”进行化学平衡常数计算,转化率的计算
【教学过程】
[复习提问] 什么叫化学平衡?化学平衡的特征有哪些?
[引入] 化学平衡状态的特征,不仅包括同学们回答的五点,还有其他方面的特征。今天我们继续学习和讨论化学平衡的其它特征——化学平衡常数。
[探究活动]请同学们阅读教材标题三下面的内容以及浓度关系数据表,分析并验算表中所给的数据,最后可以得到什么结论?
[PPT展示]在一定温度下,反应体系中各物质浓度的有关数据如下:
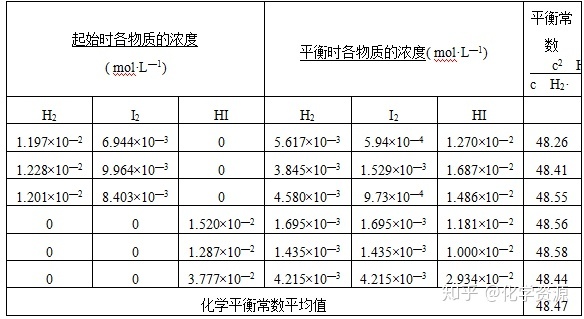
[讲解]分析上表的数据,可么得出以下结论:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用符号K表示。例如,
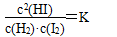
[讲解]在一定温度下,可逆反应无论是从正反应开始,还是从逆反应开始,又无论反应物起始浓度为多少,最后都能达到化学平衡。这时生成物的浓度幂之积与反应物浓度幂之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。
[板书]一、化学平衡常数
1.概念:在一定温度下,可逆反应达到平衡时,生成物的浓度幂之积与反应物浓度幂之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。
[提问]刚才得出的平衡常数K是由一个特殊的反应引出的,其
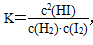
,但如果对于任意一个可逆化学反应:aA + bB

cC + dD,其平衡常数K又该如何表示呢?
[讲]平衡常数实际上是平衡混合物中各生成物浓度的化学计量数次方的乘积除以反应物浓度的化学计量数次方的乘积。即
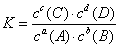
[板书]2.表达式
对于任意反应aA + bB

cC + dD
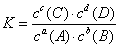
[讲解]当反应中有固体物质或纯液体参加时,固体或纯液体的“浓度”作为常数,在平衡表达式中,就不写固体或纯液体的浓度。
[巩固练习]
[板书]3.使用平衡常数的注意事项:
(1)K只与温度有关,所以使用时应注明温度;
(2)K值表达式中,固体、纯液体的“浓度”不写;
(3)平衡常数的表达式与方程式的书写方式有关;
[讲解]同一个化学反应,由于书写方式不同,各反应物、生成物的化学计量数不同,平衡常数不同。但是这些平衡常数可以相互换算。
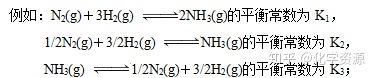
写出K1和K2、K3的关系式: K1 = 1/K3 = K22
(4)平衡常数表示反应进行的程度,不表示反应的快慢,即速率大,K值不一定大;
[提问]化学平衡常数实际上是化学平衡的又一特征,那么化学平衡常数有哪些应用呢?
[板书]4、化学平衡常数的应用
(1).判断反应进行的程度;
K值的大小,表示在该温度下达到平衡时,反应进行的程度(反应的限度),K值越大,表明反应进行的程度越大;反之则越小。
一般地说,K>105时,该反应进行得就基本完全。
(2).判断反应进行的方向
对于可逆反应:mA(g)+nB(g)

pC(g)+qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:Qc=cp(C)·cq(D)/cm(A)·cn(B),叫该反应的浓度商。
Qc=K,反应处于平衡状态, v正=v逆,
Qc<K,反应向正反应方向进行, v正>v逆,
Qc>K,反应向逆反应方向进行, v正<v逆,
[讲解]平衡常数K只受温度影响,K越大,反应进行的程度越大,反应的转化率也越大;反之K越小,表示反应进行的程度越小,反应物的转化率也越小。
[提问]什么叫反应物的转化率?
[板书]二、平衡转化率(a )
1、定义:
2、表达式:

3、理解注意:
(1)、转化率是对反应物而言的;
(2)、在一定温度下可逆反应中,K值越大,反应物的转化率就越高;
(3)、对于一给定可逆反应,K值只与温度有关,而a不仅与温度有关也与反应物起始浓度有关。
[巩固练习]、在某温度下,可逆反应: mA(g)+nB(g)

pC(g) + qD(g)的平衡常数为K,下列说法正确的是 ( )
A.K越大,达到平衡时,反应进行的程度越大.
B.K越小,达到平衡时,反应物的转化率越大.
C.K随反应物浓度改变而改变.
D.K随温度改变而改变.
[讲解]有关化学平衡的计算有何特点呢?
[板书]三、化学平衡的相关计算
⑴基本模式——“三段式法”
例: (mol/L) mA + nB

pC + qD
起始浓度: a b 0 0
转化浓度: mx nx px qx
平衡浓度: a-mx b-nx px qx
⑵基本关系
①反应物:平衡浓度=起始浓度-转化浓度
②生成物:平衡浓度=起始浓度+转化浓度
例1:某温度下,向10L真空容器中注入1.00 mol H2(g) 和1.00 mol I2(g),反应平衡后I2(g)的浓度为0.0200 mol·L-1试求该温度下 H2(g)+I2(g)

2HI(g)的平衡常数。
例2: 在一密闭容器中,CO与H2O混合加热到800℃达到下列平衡:
CO(g)+H2O(g)

CO2(g)+H2(g) K=1.00,若反应开始时CO和H2O的浓度均为0.200 mol·L-1 ,求达到平衡时CO转化为CO2转化率是多少?
[小结]本节课重点学习的化学平衡常数的概念。谈到化学平衡常数必须指明温度,反应必须达到平衡状态,表达式中各物质的浓度必须是平衡状态下的值,不能用任一时刻的浓度值。化学平衡常数表示反应进行的程度,不表示反应的快慢,即化学反应速率快,K值不一定大。使用催化剂能改变化学平衡的速率,但不会使平衡移动,因此不会改变平衡常数。
另外,要掌握转化率的概念及有关化学平衡常数的计算。
[巩固练习] 850K时,在一密闭容器中充入一定量的SO2和O2当反应达到平衡后测得:SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1 、8.0×10-3 mol·L-1 和 4.4×10-2 mol·L-1。
计算:
(1)该温度下反应2SO2+O2

2SO3 的平衡常数。
(2)达平衡状态时 SO2的转化率。
作业:




















 101
101











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








