 锐意(高中)化学
专业、有“
铍
”气的
都在关注!
锐意(高中)化学
专业、有“
铍
”气的
都在关注!

原电池是考试中的热点之一。虽然它本质考察的内容还是氧化还原反应,但因为情景的改变,给初学者造成许多障碍!一般情况下,找出原电池的负极是解题的关键,所以接下来介绍几种常见的负极判断方法。
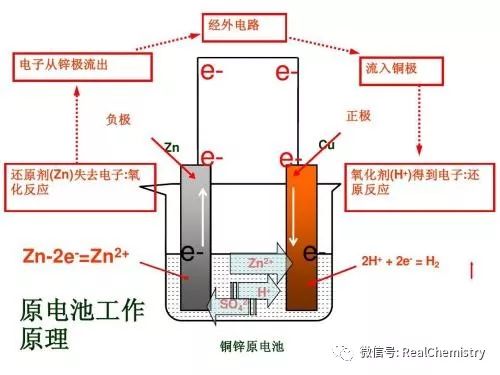
首先理解并记忆最最最基础的锌铜原电池的工作原理图,将它作为一个基本模型和参照物!由该图形可以推理总结出如下基本方法。
一般来说,较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。则
方法一:由组成原电池的两极材料判断
解决特殊情况:如镁、铝电极在稀硫酸中构成原电池,镁为负极,铝为正极;但镁、铝在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生了反应,失去了电子,因此铝为负极,镁则为正极;如铝、铜和氢氧化钠溶液构成的原电池中,铝为负极;而若把氢氧化钠溶液换为浓硝酸,因为常温下铝在浓硝酸中钝化,则铜为负极。如果是多个池串联在一起的,一般情况下活波性最强的为负极,该池为原电池,其他的都是电解池。
由图形中可以得出:在原电池的外电路,电流由正极流向负极,电子由负极流向正极。则
方法二:根据外电路电流的方向或电子的流向判断
由图形中可以得出:因为电子流向正极,使得正极带上负电荷,所以在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。则
方法三:根据内电路离子的移动方向判断
因为电子从负极流向正极,原电池中,负极发生氧化反应,正极发生还原反应。因此可以根据总反应化学方程式中化合价的升降来判断。则
方法四:根据原电池两极发生的化学反应类型判断
因为负极的电子流出,使得负极的金属由单质变为离子而溶解,电极质量减轻,该电极为负极;电子流入正极,溶液中的阳离子在该电极上放电,由离子转变为单质析出,使得电极质量增加,说明该电极为正极。则
方法五:根据电极质量的增减变化判断
原电池工作时,如果一电极上产生气体,通常是因为该电极发生了氢离子被还原为氢气的反应,一说明该电极为正极,活动性较弱。则
方法六:根据电极上是否有气体产生判断
氢离子被还原为氢气,使得氢离子浓度降低,或将吸收的氧气还原为氢氧根离子,提高氢氧根离子的浓度。说明析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作时,正极附近的pH增大。则
方法七:根据某电极附近pH是否增大判断

专业、有“铍”气的化学公众号
ID:RealChemistry

免费微课视频!
免费知识点整理!
免费化学学习群答疑!
免费送学习用品,还包邮!
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








