【医学影像 AI】使用血管特征量化自动诊断早产儿视网膜病变中的附加病变
0. 论文简介
0.1 基本信息
2024年6月,伊朗 Tehran University of Medical Sciences 的 Sharafi SM 等在 Nature 子刊 Sci Rep. 发表论文 “使用血管特征量化自动诊断早产儿视网膜病变中的附加病变(Automated diagnosis of plus disease in retinopathy of prematurity using quantification of vessels characteristics)”。
本研究展示了利用计算机图像分析和定量方法自动诊断附加病变的潜力。通过量化血管特征,可以提高诊断的准确性和效率,为早产儿视网膜病变的管理提供技术支持。
论文下载: nature
引用格式:
Sharafi SM, Ebrahimiadib N, Roohipourmoallai R, Farahani AD, Fooladi MI, Khalili Pour E. Automated diagnosis of plus disease in retinopathy of prematurity using quantification of vessels characteristics. Sci Rep. 2024 Mar 16;14(1):6375. doi: 10.1038/s41598-024-57072-4.

0.2 摘要
被称为附加病变(Plus disease)的病症以早产儿视网膜血管结构的非典型改变为特征。研究表明,附加病变的诊断本质上是主观和定性的。文献中已广泛证实,利用定量方法和基于计算机的图像分析可以提高附加病变诊断的客观性。
本研究提出了一种基于计算机的图像分析方法,旨在自动区分附加病变图像和非附加病变图像。所提出的方法对与附加病变相关的血管特征进行了定量分析,从而帮助医生做出明智的判断。
研究获取了来自不同婴儿群体的 76 张视网膜后部图像,这些婴儿接受了早产儿视网膜病变(ROP)筛查。参考标准诊断由三位ROP专家在两次独立会话中完成标注,并以多数意见为准。
视网膜血管的分割过程采用了一种半自动方法。开发了计算机算法来计算不同视网膜区域中血管的弯曲度、扩张度和密度,作为潜在的区分特征。分类器被提供了一组选定的特征,以区分附加病变图像和非附加病变图像。
本研究包括76名婴儿(49名[64.5%]男孩),平均出生体重为1305±427克,平均孕周为29.3±3周。专家对附加病变诊断的一致性水平平均为79%,标准差为5.3%。在专家内部一致性方面,平均为85%,标准差为3%。此外,附加病变图像中五条最弯曲血管的平均弯曲度显著高于非附加病变图像(p≤0.0001)。基于点的曲率值在附加病变图像中显著高于非附加病变图像(p≤0.0001)。在距离视盘边界5个视盘直径(称为5DD)区域内,附加病变图像中血管的最大直径显著增加(p≤0.0001)。附加病变图像中的血管密度显著高于非附加病变图像(p≤0.0001)。通过十倍交叉验证,分类器区分附加病变图像和非附加病变图像的准确率为0.86±0.01。这一准确率高于三位专家中一位与参考标准相比的诊断准确率。
本研究中实施的算法在检测早产儿视网膜病变中的附加病变时表现出较高的准确率,与专家诊断的表现相当。通过对血管特征进行客观分析,有可能对疾病进展的特征进行定量评估。利用这一自动化系统,可以增强医生诊断附加病变的能力,从而通过结合传统检眼镜检查和基于图像的远程医疗方法,为ROP的管理提供有价值的贡献。
1. 介绍
早产儿视网膜病变(Retinopathy of Prematurity, ROP)是一种病理状态,其特征是低出生体重婴儿视网膜血管的异常增殖。这种疾病对视力损害具有重要影响,如果不及时处理,可能会发展为视网膜脱离并最终导致失明。ROP在发展中国家和发达国家中仍然是儿童失明和视力损害的一个重要且可避免的因素。据估计,全球共有184万名儿童面临不同程度的ROP风险。在这些病例中,约11%的患儿可能会因ROP直接导致完全失明或严重视力损害。在发达国家,ROP的患病率约为9%,而在发展中国家,这一比例约为12%。在低收入和中等收入国家,ROP引起的失明患病率可高达44%,主要归因于视网膜检查、患者随访以及新生儿重症监护病房的可及性方面的挑战。
“附加病变”(Plus disease)是ROP中最严重的血管改变形式,其特征是视网膜血管的显著扩张和迂曲。这种病变是ROP病情加重的重要标志,需要及时干预。
筛查与治疗
多项研究(6,7,8)表明,早产儿视网膜病变(ROP),特别是以附加病变(Plus disease)为特征的情况,可以通过激光光凝术(Laser Photocoagulation,6,7)或贝伐单抗玻璃体内注射(Intravitreal Bevacizumab,8)在及时诊断后成功治疗。
广域视网膜成像技术,如 RetCam(9),可以捕捉更广泛的视网膜图像,这为结合远程医疗和阅读中心进行ROP筛查提供了可能(10,11),并提高了ROP筛查的可及性和诊断过程的公正性。然而,ROP的临床诊断仍然具有主观性,导致诊断中存在显著的变异性和不一致性,甚至在ROP专家之间也存在差异(12,13)。
多个研究团队已经探索了人工智能和基于计算机的图像分析技术的开发,旨在提高 ROP附加病变诊断的客观性并实现自动化(11,14,15,16,17,18,19,20,21,22,23)。然而,据我们所知,针对临床医生在诊断和治疗过程中关注的图像特征进行定量分析的研究较少。
本研究旨在通过血管特征的量化分析,开发一种计算机辅助系统来检测附加病变,以提高诊断准确性并实现治疗进展的定量监测。
2. 方法
2.1 伦理
五位ROP专家负责图像的采集,其中三位参与了眼底图像的标注。本研究遵循《赫尔辛基宣言》的原则,并获得了德黑兰医科大学(Tehran University of Medical Sciences)机构审查委员会的批准。所有参与研究的患者父母均签署了书面知情同意书,同意进行影像采集并参与研究。此外,在查看图像之前,我们采取了预防措施,删除了所有与患者相关的敏感信息,以确保其匿名性和保密性。
2.2 研究对象与参考标准诊断
我们建立了一个包含 76 张广角后部视网膜图像的数据库,每张图像均来自不同早产儿,采集于常规临床护理过程中。研究参与者包括 27名女婴(35.5%)和 49 名男婴(64.5%),平均出生体重为1305克(标准差=427克),平均孕周为29.3周(标准差=3周)。这些婴儿于2019年1月1日至2020年12月30日期间在伊朗德黑兰法拉比医院的新生儿监护病房接受检查。ROP筛查标准基于已发布的指南,包括出生体重(BW)低于2000克、孕周(GA)不超过32周,或由儿科医生或新生儿科医生确定存在 ROP 风险(24)。我们排除了所有曾接受过ROP治疗的眼睛以及任何可能影响视网膜检查的相关疾病(如呼吸窘迫综合征、支气管肺发育不良或任何全身性或眼部疾病)。
所有图像均使用广角成像设备(RetCam;Clarity Medical Systems,普莱森顿,加利福尼亚州)拍摄,图像分辨率为1200×1600像素。三位ROP专家观察者独立将选定的图像分类为“附加病变(Plus)”或“非附加病变(non-Plus)”。每张图像的参考标准诊断(即附加病变或非附加病变)由三位专家中的多数意见确定。为了评估专家间和专家内部的一致性,三位专家在10天内分别进行了两次标注。本研究的最终数据集包含 76张图像,其中37张为非附加病变图像,39张为附加病变图像(基于参考标准)。
2.3 图像选择与预处理
拍摄婴儿视网膜图像的挑战主要源于患者在图像采集过程中配合度低和注意力有限。这些因素导致图像质量较低,表现为聚焦问题、对比度不足、运动模糊和光照不均等伪影。低对比度和/或失焦区域缺乏清晰的血管边界,对血管分割和后续分析的精度产生不利影响。为了解决图像质量问题,专家系统地从数据集中剔除了低质量图像。为了获得更准确的血管分割,选定的图像经过增强处理,以解决光照不均问题并增强血管与背景视网膜之间的对比度。
本研究重点开发了与附加病变相关的两种主要血管图像特征(即血管弯曲度和扩张度)的量化算法,评估了这些算法在区分附加病变患者和非附加病变患者中的性能。
此外,我们还比较了视网膜图像中血管的密度,以确定两组患者在这一血管特征上是否存在统计学显著差异。
通过使用参考标准进行交叉验证,评估了我们算法的性能。参考标准由三位ROP专家组成的专家组提供的诊断结果汇总确定。
简而言之,本研究的目标包括两个方面:
- 首先,评估不同专家之间以及专家内部在诊断附加病变时的变异性;
- 其次,开发一种计算机辅助系统来检测附加病变,以提高诊断准确性并实现治疗进展的定量监测。
2.4 血管分割
准确的血管分割对于通过提取血管掩模量化其特征(如弯曲度)至关重要。大多数现有研究依赖于手动创建整个视网膜图像或特定血管段的血管掩模。这一过程涉及使用图形编辑软件(如Photoshop),既耗时又高度依赖操作者的技能和经验。
在本研究中,作者结合了Sharafi等人(25,26)提出的顶帽变换技术和Strisciuglio等人(27)引入的方法(利用一组专门用于血管检测的B-COSFIRE滤波器),成功以自动化方式为每张ROP图像生成了血管掩模。鉴于ROP图像中存在的上述伪影以及对后续分析中精确血管分割的迫切需求,我们设计了一个图形用户界面(GUI),用于纠正通过自动分割生成的掩模中的不准确性。(补充文件-1)视盘的分割也使用了上述GUI。
我们的团队目前正在完善一种综合方法,结合多种技术实现ROP图像的血管分割流程,旨在实现高精度和全自动化。本研究中的ROP图像血管分割由一位ROP专家(EKP)进行了全面审查。
2.5 量化血管弯曲度
动脉弯曲度在国际 ROP 分类系统中起着关键作用,因为它被用于附加病变的诊断(28)。文献中有多项研究将血管弯曲度作为区分附加病变和非附加病变的主要特征进行量化(17,19,22,29)。
使用基于距离的指标来量化血管弯曲度,通常涉及计算血管段或曲线所经过的路径长度,然后除以血管段两个端点之间的距离。这种方法也被称为弧弦比(Arc-over-Chord ratio),通常也称为弯曲度指数。然而,现有文献提出了基于曲率的替代方法来计算弯曲度,这些方法能够提供更精确的结果。最近发表的研究表明,与弯曲度指数相比,基于曲率的方法表现出更高的一致性和直观性。此外,该研究还指出,弯曲度指数等指标存在固有局限性,即无法全面反映血管的几何形状(30)。
为了实现更高的准确性,我们采用了平方导数曲率法(31),该方法在以往的研究中被广泛用于计算视网膜血管的弯曲度。弯曲度通过评估曲率导数平方的积分除以血管段的弧长来计算(公式1)。在这种情况下,完全线性的血管段的弯曲度近似为 0。

式中,κ 表示血管段的曲率。曲率是量化血管弯曲程度的重要指标。
为了确定血管段的曲率,首先通过对血管段进行形态学细化(骨架化, Skeletonizing)来获取其中心线。这一过程涉及从血管边界迭代地移除像素。此操作保持了拓扑特性,并且不会改变血管段的基本结构。在骨架化之后,任何可能存在于骨架化血管段旁边的小分支(称为刺状边缘)都被有效移除,从而使血管段仅保留两个端点。
曲率(用 κ 表示)是指曲线偏离直线的程度。曲率与曲线上每一点的切向量有关,这一点将在后文详细讨论。从几何角度来看,曲率 κ 可以精确地定义为曲线切向量方向变化的速度。为了确定 κ,首先需要用连续曲线表示骨架化的血管段。为此,我们使用三次样条曲线(由分段多项式定义的连续可微函数)来估计数字图像中的骨架化血管段 S。如果 S 由位于坐标 (x1, y1), (x2, y2), …, (xn, yn) 的中心线像素表示,那么样条曲线实际上是对这些坐标的插值。然而,当使用集合 S 中的所有坐标进行插值时,生成的样条曲线会表现出过多的噪声,并且缺乏准确表示血管段所需的平滑度。因此,有必要对初始坐标进行下采样,并在采样数据点上逼近一个更连续的样条函数。这一过程为后续的曲率计算提供了基础,从而能够更准确地描述血管的几何特征。
假设一个粒子沿着样条曲线 γ 移动,那么 x 和 y 都被视为时间变量 t 的函数,样条曲线 γ 可以表示为 γ ( t ) = ( x ( t ) , y ( t ) ) γ(t) = (x(t), y(t)) γ(t) = (x(t),y(t)),其中 γ ( t ) γ(t) γ(t) 表示粒子在时间 t 的位置。点 t 处的曲率 κ,即 κ ( t ) κ(t) κ(t),可以通过公式 2 估算,其中撇号(’)表示对参数 t 的导数 d / d t d/dt d/dt。

其中:
x
′
(
t
)
x'(t)
x′(t) 和
y
′
(
t
)
y'(t)
y′(t) 是
x
(
t
)
x(t)
x(t) 和
y
(
t
)
y(t)
y(t) 对
t
t
t 的一阶导数(速度分量),
x
′
′
(
t
)
x''(t)
x′′(t) 和
y
′
′
(
t
)
y''(t)
y′′(t) 是
x
(
t
)
x(t)
x(t) 和
y
(
t
)
y(t)
y(t) 对
t
t
t 的二阶导数(加速度分量)。通过将样条曲线参数化为时间 t 的函数,可以利用导数计算曲线上每一点的曲率 κ(t)。曲率的计算公式结合了速度和加速度的信息,能够精确量化曲线的弯曲程度,为研究血管弯曲度提供了数学基础,特别是在早产儿视网膜病变(ROP)的诊断中具有重要意义。
公式 3 通过积分曲线的微分长度来计算曲线长度
L
c
L_c
Lc 。这是量化血管几何特征的基础,特别是在研究血管弯曲度和长度时具有重要意义。

图 1 展示了从一名患有附加病变(Plus disease)的患者视网膜图像中计算小动脉段弯曲度的顺序步骤。沿血管段的曲率值通过颜色编码方案直观表示,其中高曲率区域用红色表示,低曲率区域用蓝色表示。最终样条曲线在选定点处的一阶导数和二阶导数分别用红色和黄色箭头表示。

图 1:
(a) 视网膜图像的一部分及其上描绘的单个小动脉段。(b) 沿血管段的曲率值通过颜色编码方案直观表示,高曲率区域为红色,低曲率区域为蓝色。(c ) 中心线像素、样条曲线、选定点处的一阶导数和二阶导数。
“.” 表示血管段的中心线像素;“o” 表示下采样后的点;黑线表示通过所有原始像素的初始样条拟合;颜色编码曲线:下采样后的样条拟合,沿样条的曲率值通过颜色编码方案表示;红色箭头表示样条曲线在选定点处的一阶导数(即切向量);黄色箭头表示样条曲线在选定点处的二阶导数(即加速度向量)。颜色条(Color bar)表示曲率值的颜色映射。
2.6 血管扩张
如前所述,血管扩张(即血管直径增大)是附加病变(Plus disease)的一个特征性表现。为了确定每个血管段的直径,我们采用了 Sharafi 等人(25) 提出的方法。从血管段的中心线像素中随机选择三分之一。对于每个选定的像素,确定其到血管段边界的最短连线,并将其视为该像素处的血管段直径。整个血管段的直径通过所选中心线像素处直径值的平均值来确定。特定区域的直径指数定义为该区域内所有血管段中的最大直径,假设该区域内的小静脉具有最大直径。血管扩张的测量在整个视野范围内进行,并在距离视盘 5 个视盘直径的区域内进行,如先前研究(17,20) 中所记录的那样。
通过量化血管扩张可以更准确地诊断附加病变,这种方法为附加病变的诊断提供了重要的定量依据。
2.7 血管密度
由于ROP是一种增殖性视网膜血管疾病,而附加病变(Plus disease)的特征是血管弯曲度和扩张,因此假设附加病变中的血管密度高于健康视网膜。视网膜血管密度在学术文献中已被广泛讨论,作为 ROP(32,33,34,35,36)的潜在指标,特别是与附加病变相关(35)。因此,通过量化血管密度,可以进一步理解附加病变的病理特征。在我们的研究中,除了评估弯曲度和扩张外,我们还研究了血管密度作为附加病变的潜在指标。
血管密度血管密度定义为血管上像素数量与整个血管化区域像素数量的比率。血管化区域通过对血管掩模应用形态学图像膨胀获得。具体步骤包括:(1)通过形态学图像膨胀技术从血管掩模中提取血管化区域。(2)计算血管上像素的数量。(3)计算血管化区域剩余部分像素的数量。(4)血管密度 = 血管上像素数量 / 血管化区域像素数量。
本研究通过形态学图像膨胀技术提取血管化区域,并计算血管上像素与血管化区域像素的比率来量化血管密度。结合血管弯曲度和扩张的评估,血管密度为ROP的诊断提供了更全面的定量依据。
3. 结果
3.1 专家间和专家内变异性及专家一致性
一致性分析的目的是:(1)评估专家之间在诊断附加病变(Plus disease)时的一致性(inter-expert agreement)。(2)评估单个专家在不同时间点诊断的一致性(intra-expert agreement)。
采用 Cohen’s kappa 统计量评估专家之间的一致性以及单个专家在两次独立会话中评分的一致性。Cohen’s kappa 是一种用于评估分类任务一致性的统计方法,考虑了随机一致性的影响。Kappa 值的范围从 -1 到 1,值越高表示一致性越好。
表 1 和表 2 分别展示了专家间和专家内的变异性水平。表 3 展示了个别专家与参考标准之间的一致性。专家之间的平均一致性水平为 79%,标准差为 5.3%。在专家内一致性方面,平均值为 85%,标准差为 3%。



3.2 特征提取和特征分析
根据前文所述,最初提取了总共 10 个特征来描述弯曲度、扩张和血管密度的属性。
为了优先选择更具辨别力的特征,我们采用了邻域成分分析(Neighborhood Component Analysis, NCA)技术进行特征选择(37)。NCA 是一种监督学习方法,通过最大化特征对分类任务的贡献来选择最具辨别力的特征。
最终选择了五个权重较大的特征,这些特征对区分附加病变和非附加病变具有更高的判别能力。所选特征及其属性如表 4 所示。
为了展示数据集中部分样本图像及其对应的特征值,图 2 展示了两张附加病变图像样本和两张非附加病变图像样本,并附有对应的特征值,直观反映了这些特征在附加病变和非附加病变中的差异。



图2:2个 Plus图像样本(a, b)和 2个 non-Plus 图像样本(c, d)及其相应的特征值。
图 3 展示了附加病变(Plus)和非附加病变(non-Plus)图像在表 4 中列出的选定特征方面的比较。
- 图 3a: 比较了附加病变和非附加病变图像在整个图像中弯曲度最高的五个血管段的平均弯曲度值(F1)。附加病变图像的测量值与非附加病变图像之间存在显著差异(p ≤ 0.0001)。
- 图 3b: 比较了附加病变和非附加病变图像在距离视盘边界 5 个视盘直径(5DD)区域内血管段的平均弯曲度(F2)。附加病变图像的弯曲度测量值与非附加病变图像相比具有统计学显著差异(p ≤ 0.0001)。
- 图 3c: 对附加病变和非附加病变图像在特征 F3(即前 1% 曲率值的平均值)方面进行了比较分析。附加病变图像的测量值与非附加病变图像之间存在显著差异(p ≤ 0.0001)。
- 图 3d: 比较了附加病变和非附加病变图像在 5DD 区域内观察到的最大血管直径(F4)。附加病变图像的直径测量值显著大于非附加病变图像(p ≤ 0.0001)。
- 图 3e: 比较了附加病变和非附加病变图像的血管密度(F5)。附加病变图像的血管密度显著高于非附加病变图像(p ≤ 0.0001)。
图 3 通过对比附加病变和非附加病变图像在五个选定特征(F1-F5)上的表现,揭示了附加病变的显著特征:
- 高弯曲度: 附加病变图像中弯曲度最高的血管段(F1)和 5DD 区域内的血管段(F2)的弯曲度显著高于非附加病变图像。
- 高曲率: 附加病变图像中前 1% 曲率值的平均值(F3)显著高于非附加病变图像。
- 血管扩张: 附加病变图像在 5DD 区域内的最大血管直径(F4)显著大于非附加病变图像。
- 高血管密度: 附加病变图像的血管密度(F5)显著高于非附加病变图像。
这些结果表明,附加病变在血管弯曲度、曲率、扩张和密度方面具有显著差异,这些特征可以作为诊断附加病变的重要定量指标。通过量化这些特征,可以提高诊断的准确性和客观性。

图3:Plus和 nonPlus图像之间提取的特征值的比较(值是标准化的)。(a) 五个弯曲度最大的血管段的平均弯曲度(F1)。(b) 从OD边界(5DD)延伸5个直径的区域内所有血管段的平均曲折度(F2)。(c) 最高1%曲率值的平均值(F3)。(d) 5DD区域中血管的最大直径(F4)。(e) 视网膜血管区域的血管密度(F5)。蓝色圆圈表示异常数据值。
3.3 图像分类
通过主成分分析(PCA)降维和支持向量机(SVM)分类器对附加病变(Plus disease)和非附加病变(non-Plus)图像进行分类,并评估分类器的性能。
由于五个选定特征中的三个(即 F1、F2 和 F3)属于血管弯曲度类别,并且它们可能存在相关性,因此我们尝试通过对选定特征使用主成分分析(PCA)来进一步降维。
我们使用前三个主成分获得了最佳准确率,并用它们训练了一个支持向量机(SVM)分类器。SVM 分类使用了径向基核函数,正则化参数设置为 1。分类器的性能通过十倍交叉验证进行评估。
我们还将分类器的准确率与专家提供的参考标准诊断准确率进行了比较。
表 5 展示了每位专家和所提出方法在区分附加病变图像和非附加病变图像方面的诊断准确率。根据表格,所提出方法的准确率为 0.86 ± 0.01,在专家诊断准确率中排名第三(接近专家诊断水平)。分类器的准确率通过重复执行十倍交叉验证获得。
图 4 利用选定特征的前三个主成分的标准化值,展示了附加病变和非附加病变图像数据点在主成分空间中的分布,直观验证了分类器的有效性。这一方法为早产儿视网膜病变(ROP)的诊断提供了高效、客观的解决方案,具有重要的临床应用价值。
表5:专家提供的诊断准确度测量和拟议方法的预测与参考标准的比较。

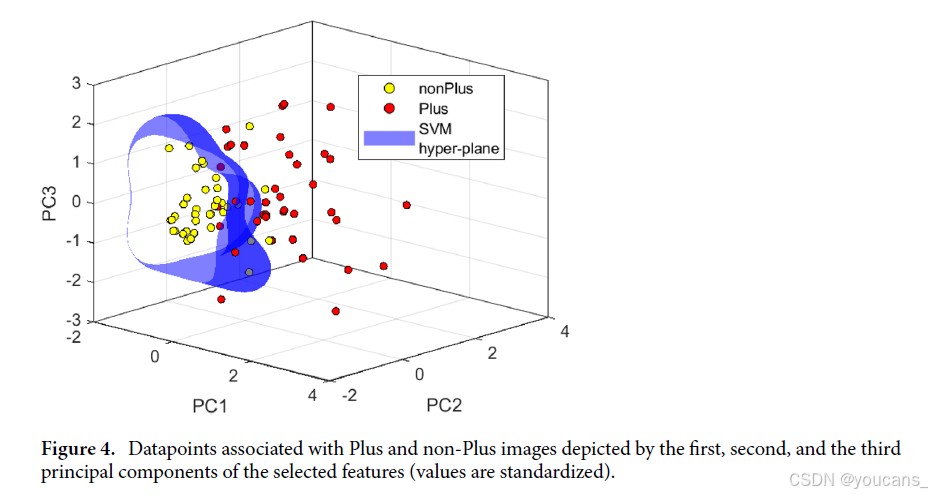
图 5 是对本研究方法的总结和可视化,展示了所提出方法的整体流程和每个阶段的输出示意图,涵盖了从图像输入到分类结果的全过程。

4. 讨论
许多研究团队正在开发基于计算机的图像分析技术,以实现 ROP 附加病变(Plus disease)的自动化诊断(11,14,15,16,17,18,38,39,40,41,42)。这些研究在血管特征量化、图像分割、机器学习和自动化诊断系统等方面取得了显著进展,为提高诊断效率和准确性提供了重要支持。
4.1 ROP 附加病变的诊断
为了建立用于检测 ROP 的自动化系统,有必要对视网膜眼底图像进行分析,并准确表征与 ROP 相关的独特特征。ROP 的识别,特别是附加病变(Plus disease)的存在,可以被概念化为机器学习领域中的分类任务。
传统算法(17,19,20,43,44)使用手工特征(Handcrafted Features, HC),例如血管扩张和弯曲度,来分析视网膜眼底图像并区分附加病变、前附加病变(pre-Plus)和非附加病变(non-Plus)。
相比之下,深度卷积神经网络(Deep Convolutional Neural Networks, DCNN)能够从提供的输入中学习图像特征,以有效分类标签。DCNN 已在多种眼部疾病的自动识别中展示了其有效性,包括糖尿病视网膜病变、青光眼、年龄相关性黄斑变性和早产儿视网膜病变。这些发现在多项研究中得到了报道(14,18,21,45,46,47,48)。
DCNN 通常需要大量高质量的训练样本,并且这些样本在不同标签之间需要保持平衡。然而,在 ROP 的背景下,由于患者的配合度有限(尤其是儿童)和注意力不足,获取这样的样本具有挑战性。此外,DCNN 学习到的特征缺乏透明性和可解释性。因此,使用手工特征检测附加病变已被证明是有效的,既可以作为独立方法(17,22,29),也可以作为 DCNN 在图像分类任务中的补充信息(16,23)。结合两者的优势,可以提高诊断的准确性、可解释性和鲁棒性,为 ROP 的自动化诊断提供重要支持。
除了附加病变的诊断外,ROP 领域的专家面临的另一个重大挑战是评估患者治疗期间临床干预措施的有效性(49,50,51)。在治疗过程中量化血管特征可以为临床医生提供更精确的手段,以监测干预措施对疾病的影响。
4.2 血管分割的自动生成
准确的血管分割对于通过提取血管掩模来量化血管特征(如弯曲度)至关重要。大多数研究通过手动创建视网膜图像中血管的掩模(无论是整个图像还是特定血管段)来实现这一点。这一过程使用图形编辑软件(如 Photoshop),需要大量时间,并且高度依赖操作者的熟练程度和专业知识。
在本研究中,我们结合了阈值分割技术和 B-COSFIRE 滤波器组(27)的方法进行视网膜血管分割。通过整合这两种方法,研究人员实现了对每张 ROP 眼底图像的血管掩模的自动生成。我们构建了一个图形用户界面(GUI),以纠正由于 ROP 图像伪影和后续分析对血管分割的需求而导致的自动分割掩模不足。准确且自动化的 ROP 眼底图像血管分割还可以作为未来研究中使用深度学习的综合血管分割方法的数据集。
4.3 血管图像特征与附加病变的关系
本研究旨在开发用于表征与附加病变(Plus disease)相关的两个主要血管图像特征(血管弯曲度和扩张)的算法。评估了这些算法在区分附加病变患者和非附加病变患者中的能力。
结果表明,附加病变图像中五条最弯曲血管的平均弯曲度显著高于非附加病变图像(p ≤ 0.0001)。分析显示,附加病变图像中基于点的曲率值显著高于非附加病变图像(p ≤ 0.0001)。在距离视盘边缘 5 个视盘直径(称为 5DD)的区域内,附加病变图像中血管的最大直径显著大于非附加病变图像(p ≤ 0.0001)。除了血管弯曲度和扩张外,我们的方法还验证了 Ataer 等人(26) 的发现,即附加病变图像中基于点的曲率值显著高于非附加病变图像。
此外,我们还对视网膜图像中的血管密度进行了比较分析,以评估两组患者在这一血管特征方面是否存在统计学显著差异。附加病变图像中的血管密度显著高于非附加病变图像(p ≤ 0.0001)。
本研究成功开发了用于量化血管弯曲度、扩张和密度的算法,并验证了这些特征在区分附加病变和非附加病变中的有效性。研究结果表明,附加病变图像中的血管弯曲度、扩张和密度显著高于非附加病变图像,这些特征可以作为诊断附加病变的重要定量指标。
文献广泛讨论了视网膜血管密度作为 ROP(特别是附加病变)的潜在指标。血管密度与附加病变之间的关系尚不明确,因为针对这一特定方面的研究有限。此外,附加病变的发展受多种因素影响,包括孕周、出生体重和婴儿的整体健康状况。
研究结果显示,附加病变图像和非附加病变图像之间的血管密度存在显著差异(p ≤ 0.0001)。这一发现支持了 Mao 等人(35) 的研究结果,他们的研究表明,被诊断为附加病变和前附加病变的患者血管密度显著高于正常组。他们还展示了治疗后 7 天、14 天和 30 天血管密度的比例下降。在一项关于氧诱导视网膜病变(OIR)小鼠模型的研究中,观察到血管密度的增加(32)。然而,我们的研究结果与其他研究相矛盾,这些研究未观察到 ROP 组和正常组之间血管密度的显著增加(33,34)。
4.4 SVM 分类器
我们使用提取的血管特征(如弯曲度、扩张和密度)训练了一个支持向量机(SVM)分类器,以区分附加病变和非附加病变图像。
我们通过交叉验证和参考标准评估了算法的性能。参考标准由三位 ROP 专家组成的专家组提供的诊断结果整合确定。通过十倍交叉验证,分类器在区分附加病变和非附加病变图像方面的准确率为 0.86 ± 0.01,高于三位专家中一位的准确率。
ROP 专家在附加病变的分类中存在显著差异。这种差异源于专家用于诊断附加病变和前附加病变所需的血管异常程度的阈值不同。这一发现对 ROP 研究、教学和患者护理具有重要意义。这表明,连续的 ROP 附加病变严重程度评分可以更准确地反映 ROP 临床专家的评估,并可能在未来改善分类的标准化(52)。
4.5 i-ROP 血管严重程度评分
ROP 图像与信息学深度学习算法(i-ROP)是一种著名的人工智能工具,用于测量 ROP 病例中后极部的血管变化。
多项关于 ROP 筛查的研究表明,i-ROP 算法可以像人类 ROP 专家一样有效检测附加病变。这表明该算法有潜力识别需要再次治疗的 ROP 复发病例。
i-ROP DL 系统的输出可以转换为代表附加病变范围的血管严重程度评分(VSS)。
研究表明,血管严重程度评分(VSS)在 ROP 的初步筛查和二次筛查中具有实用性,包括抗 VEGF 治疗后 ROP 复发的筛查(51)。该评分已被证明对 ROP 初步筛查、跟踪疾病进展和评估治疗反应具有重要价值(15,16,49,50,53,54,55,56)。
5. 总结
与发展中国家相比,发达国家的 ROP 患儿往往出生体重较低、孕周较小。因此,低收入和中等收入国家实施了更广泛的筛查指南,导致这些地区面临 ROP 风险的婴儿数量更多(57)。由于人均眼科医生数量相对较少,筛查负担的增加对这些国家构成了特别的挑战。
本研究旨在开发一种计算机辅助系统,用于在低收入国家伊朗检测附加病变,以提高诊断准确性并促进治疗进展的定量监测。本研究量化了 ROP 图像中血管的特征,包括弯曲度、扩张和密度。这些测量结果可用于附加病变的初步筛查,并可能用于未来的抗 VEGF 治疗后 ROP 复发筛查研究,具有重要的临床和公共卫生意义。
本研究存在一些局限性。首先,本研究使用的数据集中 ROP 眼底图像数量有限,这可能影响了模型的性能。其次,眼底图像是从单一临床中心收集的,设备设置和人群特征一致,这可能降低了数据的多样性,并影响了算法对其他人群的泛化能力。最后,虽然采用了交叉验证方法来增强泛化性,但未来研究需要使用独立图像进行进一步验证。
未来的研究应致力于获取更大的 ROP 图像数据集,以在临床环境中验证和优化我们的系统。此外,可能需要对敏感性指标进行额外的测试和优化,以尽量减少假阴性结果的发生。需要进一步的研究来验证这一自动化系统,并通过整合来自多个临床中心和更大患者群体的数据集,增强其在真实世界临床应用中的实用性。
总之,本研究中使用的算法在检测早产儿视网膜病变中的附加病变方面表现出较高的准确性,其性能与专家诊断相当。通过客观分析血管特征,可以定量评估疾病进展的特征。该自动化系统有潜力提高医生诊断附加病变的能力,通过整合传统检眼镜检查和基于图像的远程医疗方法,为 ROP 的管理做出宝贵贡献。
尽管本研究存在数据集规模有限、数据来源单一等局限性,但其开发的算法在检测附加病变方面表现出较高的准确性,具有重要的临床应用潜力。未来的研究应致力于扩大数据集、优化敏感性指标并进行多中心验证,以进一步提高系统的实用性和泛化能力。该自动化系统为 ROP 的诊断和管理提供了高效、客观的工具,有望在临床实践中发挥重要作用。
6. 数据
在本研究中开发和/或分析的数据集可根据合理要求从通讯作者处获得。
7. 参考文献
- Gilbert, C. Retinopathy of prematurity: A global perspective of the epidemics, population of babies at risk and implications for control. Early Hum. Dev. 84, 77–82 (2008).
- Hansen, E. D. & Hartnett, M. E. A review of treatment for retinopathy of prematurity. Expert Rev. Ophthalmol. 14, 73–87 (2019).
- Blencowe, H., Lawn, J. E., Vazquez, T., Fielder, A. & Gilbert, C. Preterm-associated visual impairment and estimates of retinopathy of prematurity at regional and global levels for 2010. Pediatr. Res. 74(Suppl 1), 35–49 (2013).
- Chang, J. W. Risk factor analysis for the development and progression of retinopathy of prematurity. PLoS ONE 14, e0219934 (2019).
- Senjam, S. S. & Chandra, P. Retinopathy of prematurity: Addressing the emerging burden in developing countries. J. Fam. Med. Prim. Care 9, 2600–2605 (2020).
- Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicenter trial of cryotherapy for retinopathy of prematurity: Preliminary results. Arch. Ophthalmol. 106, 471 (1988).
- Good, W. V., Early Treatment for Retinopathy of Prematurity Cooperative Group. Final results of the Early Treatment for Retinopathy of Prematurity (ETROP) randomized trial. Trans. Am. Ophthalmol. Soc. 102, 233–248 (2004).
- Mintz-Hittner, H. A., Kennedy, K. A., Chuang, A. Z., BEAT-ROP Cooperative Group. Efficacy of intravitreal bevacizumab for stage 3+ retinopathy of prematurity. N. Engl. J. Med. 364, 603–615 (2011).
- Kemper, A. R., Wallace, D. K. & Quinn, G. E. Systematic review of digital imaging screening strategies for retinopathy of prematurity. Pediatrics 122, 825–830 (2008).
- Fijalkowski, N. et al. Stanford University Network for Diagnosis of Retinopathy of Prematurity (SUNDROP): Five years of screening with telemedicine. Ophthalmic Surg. Lasers Imaging Retina 45, 106–113 (2014).
- Simkin, S. K., Misra, S. L., Han, J. V., McGhee, C. N. J. & Dai, S. Auckland regional telemedicine retinopathy of prematurity screening network: A 10-year review. Clin. Exp. Ophthalmol. 47, 1122–1130 (2019).
- Kalpathy-Cramer, J. et al. Plus disease in retinopathy of prematurity: Improving diagnosis by ranking disease severity and using quantitative image analysis. Ophthalmology 123, 2345–2351 (2016).
- Bolón-Canedo, V. et al. Dealing with inter-expert variability in retinopathy of prematurity: A machine learning approach. Comput. Methods Programs Biomed. 122, 1 (2015).
- Tan, Z., Simkin, S., Lai, C. & Dai, S. Deep learning algorithm for automated diagnosis of retinopathy of prematurity plus disease. Transl. Vis. Sci. Technol. 8, 23 (2019).
- Redd, T. K. et al. Evaluation of a deep learning image assessment system for detecting severe retinopathy of prematurity. Br. J. Ophthalmol. 103, 580–584 (2019).
- Brown, J. M. et al. Automated diagnosis of plus disease in retinopathy of prematurity using deep convolutional neural networks. JAMA Ophthalmol. 136, 803 (2018).
- Ataer-Cansizoglu, E. et al. Computer-based image analysis for plus disease diagnosis in retinopathy of prematurity: Performance of the “i-ROP” system and image features associated with expert diagnosis. Transl. Vis. Sci. Technol. 4, 5 (2015).
- Wang, J. et al. Automated retinopathy of prematurity screening using deep neural networks. EBioMedicine 35, 361–368 (2018).
- Wilson, C. M. et al. Computerized analysis of retinal vessel width and tortuosity in premature infants. Invest. Ophthalmol. Vis. Sci. 49, 3577–3585 (2008).
- Wittenberg, L. A., Jonsson, N. J., Chan, R. V. P. & Chiang, M. F. Computer-based image analysis for plus disease diagnosis in retinopathy of prematurity. J. Pediatr. Ophthalmol. Strabismus 49, 11–19 (2012).
- Tong, Y., Lu, W., Deng, Q., Chen, C. & Shen, Y. Automated identification of retinopathy of prematurity by image-based deep learning. Eye Vis. 7, 40 (2020).
- Pour, E. K. et al. Retinopathy of prematurity-assist: Novel software for detecting plus disease. Korean J. Ophthalmol. 31, 524–532 (2017).
- Yildiz, V. M. et al. Plus disease in retinopathy of prematurity: Convolutional neural network performance using a combined neural network and feature extraction approach. Transl. Vis. Sci. Technol. 9, 10 (2020).
- Roohipoor, R. et al. Retinopathy of prematurity screening criteria in Iran: New screening guidelines. Arch. Dis. Child. Fetal Neonatal Ed. 101, F288-293 (2016).
- Sharafi, S. M. Investigation of the Retinal Biomarkers of Alzheimer’s Disease and Atherosclerosis Using Hyperspectral Images (Ecole Polythechnique at University of Montreal, 2019).
- Sharafi, S. M. et al. Vascular retinal biomarkers improves the detection of the likely cerebral amyloid status from hyperspectral retinal images. Alzheimers Dement. N. Y. N 5, 610–617 (2019).
- Strisciuglio, N., Azzopardi, G., Vento, M. & Petkov, N. Supervised vessel delineation in retinal fundus images with the automatic selection of B-COSFIRE filters. Mach. Vis. Appl. 27, 1137–1149 (2016).
- International Committee for the Classification of Retinopathy of Prematurity. The international classification of retinopathy of prematurity revisited. Arch. Ophthalmol. Chic. Ill. 1960(123), 991–999 (2005).
- Keck, K. M. et al. Plus disease diagnosis in retinopathy of prematurity: Vascular tortuosity as a function of distance from optic disc. Retina Phila. Pa 33, 1700–1707 (2013).
- Kashyap, V. et al. Accuracy of vascular tortuosity measures using computational modelling. Sci. Rep. 12, 865 (2022).
- Patasius, M., Marozas, V., Lukosevicius, A. & Jegelevicius, D. Evaluation of tortuosity of eye blood vessels using the integral of square of derivative of curvature (2005).
- Li, W. et al. Soluble Tei2 fusion protein inhibits retinopathy of prematurity occurrence via regulation of the Ang/Tie2 pathway. Exp. Ther. Med. 18, 614–620 (2019).
- Rezar-Dreindl, S. et al. Retinal vessel architecture in retinopathy of prematurity and healthy controls using swept-source optical coherence tomography angiography. Acta Ophthalmol. (Copenh.) 99, e232 (2021).
- Lee, G.-I., Park, K.-A., Oh, S. Y. & Kim, S. J. Retinal and peripapillary vascular deformations in prematurely born children aged 4–12 years with a history of retinopathy of prematurity. Sci. Rep. 13, 3130 (2023).
- Mao, J. et al. Automated diagnosis and quantitative analysis of plus disease in retinopathy of prematurity based on deep convolutional neural networks. Acta Ophthalmol. (Copenh.) 98, e339–e345 (2020).
- Czeszyk, A., Hautz, W., Jaworski, M., Bulsiewicz, D. & Czech-Kowalska, J. Morphology and vessel density of the macula in preterm children using optical coherence tomography angiography. J. Clin. Med. 11, 1337 (2022).
- Yang, W., Wang, K. & Zuo, W. Neighborhood component feature selection for high-dimensional data. J. Comput. 7, 161–168 (2012).
- Dai, S., Chow, K. & Vincent, A. Efficacy of wide-field digital retinal imaging for
- Murakami, Y. et al. Stanford University Network for Diagnosis of Retinopathy of Prematurity (SUNDROP): 12-month experience with telemedicine screening. Br. J. Ophthalmol. 92, 1456–1460 (2008).
- Shah, P. K., Ramya, A. & Narendran, V. Telemedicine for ROP. Asia-Pac. J. Ophthalmol. Phila. Pa 7, 52–55 (2018).
- Richter, G. M., Williams, S. L., Starren, J., Flynn, J. T. & Chiang, M. F. Telemedicine for retinopathy of prematurity diagnosis: Evaluation and challenges. Surv. Ophthalmol. 54, 671–685 (2009).
- Ells, A. L. et al. Telemedicine approach to screening for severe retinopathy of prematurity: A pilot study. Ophthalmology 110, 2113–2117 (2003).
- Binenbaum, G. Algorithms for the prediction of retinopathy of prematurity based upon postnatal weight gain. Clin. Perinatol. 40, 261–270 (2013).
- Rani, P., Elagiri Ramalingam, R., Rajamani, K. T., Kandemir, M. & Singh, D. Multiple instance learning: Robust validation on retinopathy of prematurity. Int. J. Control Theory Appl. 9, 451–459 (2016).
- Grzybowski, A. et al. Artificial intelligence for diabetic retinopathy screening: A review. Eye 34, 451–460 (2020).
- Devalla, S. K. et al. Glaucoma management in the era of artificial intelligence. Br. J. Ophthalmol. 104, 301–311 (2020).
- Yan, Q. et al. Deep-learning-based prediction of late age-related macular degeneration progression. Nat. Mach. Intell. 2, 141–150 (2020).
- Fulton, A. B., Hansen, R. M., Moskowitz, A. & Akula, J. D. The neurovascular retina in retinopathy of prematurity. Prog. Retin. Eye Res. 28, 452–482 (2009).
- Taylor, S. et al. Monitoring disease progression with a quantitative severity scale for retinopathy of prematurity using deep learning. JAMA Ophthalmol. 137, 1022–1028 (2019).
- Gupta, K. et al. A quantitative severity scale for retinopathy of prematurity using deep learning to monitor disease regression after treatment. JAMA Ophthalmol. 137, 1029–1036 (2019).
- Eilts, S. K. et al. Assessment of retinopathy of prematurity regression and reactivation using an artificial intelligence-based vascular severity score. JAMA Netw. Open 6, e2251512 (2023).
- Campbell, J. P. et al. Plus disease in retinopathy of prematurity: A continuous spectrum of vascular abnormality as a basis of diagnostic variability. Ophthalmology 123, 2338–2344 (2016).
- Campbell, J. P. et al. Expert diagnosis of plus disease in retinopathy of prematurity from computer-based image analysis. JAMA Ophthalmol. 134, 651–657 (2016).
- Campbell, J. P. et al. Applications of artificial intelligence for retinopathy of prematurity screening. Pediatrics 147, e2020016618 (2021).
- Greenwald, M. F. et al. Evaluation of artificial intelligence-based telemedicine screening for retinopathy of prematurity. J. AAPOS Off. Publ. Am. Assoc. Pediatr. Ophthalmol. Strabismus 24, 160–162 (2020).
- Campbell, J. P. et al. Evaluation of a deep learning-derived quantitative retinopathy of prematurity severity scale. Ophthalmology 128, 1070–1076 (2021).
- Gilbert, C. et al. Characteristics of infants with severe retinopathy of prematurity in countries with low, moderate, and high levels of development: Implications for screening programs. Pediatrics 115, e518-525 (2005).
版权说明:
本文由 youcans@xidian 对论文 Automated diagnosis of plus disease in retinopathy of prematurity using quantification of vessels characteristics 进行摘编和翻译。该论文版权属于原文期刊和作者,本译文只供研究学习使用。
youcans@xidian 作品,转载必须标注原文链接:
【医学影像 AI】使用血管特征量化自动诊断早产儿视网膜病变中的附加病变(https://youcans.blog.csdn.net/article/details/145861202)
Crated:2025-03


























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










