推荐阅读:
1.ips细胞治疗糖尿病研究进展综述
2.iPS细胞重编程实验相关实验材料
造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植和疾病治疗方面有重要作用。
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.Cell Stem Cell:造血干细胞通过保持对以前感染的记忆来提高免疫反应
doi:10.1016/j.stem.2020.01.017
在一项新的研究中,来自法国、德国和以色列的研究人员发现造血干细胞的一个令人吃惊的特性:它们不仅确保血细胞的持续更新,而且还能够记住以前的感染经历,从而在未来引发更快更有效的免疫反应。这些发现应当对未来的疫苗接种策略产生重大影响,并且为表现不佳或反应过度的免疫系统开发新疗法铺平道路。相关研究结果近期发表在Cell Stem Cell期刊上,论文标题为“C/EBPβ-Dependent Epigenetic Memory Induces Trained Immunity in Hematopoietic Stem Cells”。论文通讯作者为Michael Sieweke博士和Sandrine Sarrazin博士。
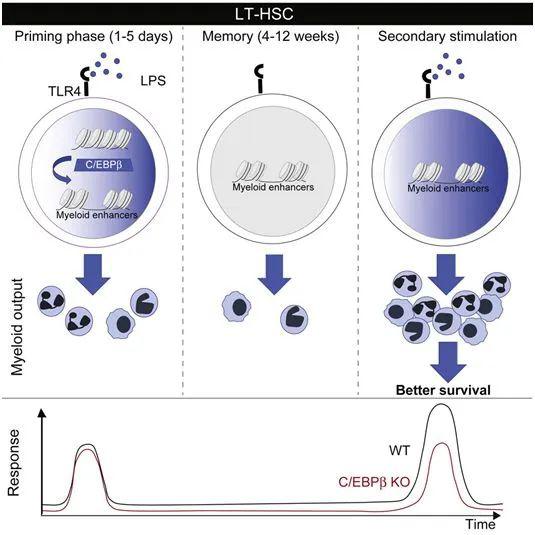
图片来自Cell Stem Cell, 2020, doi:10.1016/j.stem.2020.01.017
图片来源:Wikipiedia
图片来自Nature Medicine, 2020
论文共同通讯作者、美国加州大学旧金山分校伊莱和伊迪特-布罗德再生医学与干细胞研究中心(Eli and Edythe Broad Center of Regeneration Medicine and Stem Cell Research)的Donald Kohn博士说,“通过这种基因疗法,你能够使用患者自己的干细胞替代供者细胞用于移植。这意味着这些细胞与患者完全匹配,它应当是一种更加安全的移植方法,没有产生免疫排斥的风险。”
7.Science子刊:供者造血干细胞中的罕见有害突变可能给受者带来健康问题
doi:10.1126/scitranslmed.aax6249
造血干细胞移植,也称为骨髓移植,是治疗急性髓细胞白血病(AML)等血液癌症的常见方法。这种治疗可以治愈血液癌症,但也可能导致危及生命的并发症,包括心脏问题和移植物抗宿主病。在移植物抗宿主病中,来自供者的新免疫细胞会攻击患者的健康组织。
在一项新的研究中,来自美国华盛顿大学医学院等研究机构的研究人员指出在健康供者的造血干细胞中存在的极其罕见的有害基因突变,尽管不会对供者造成健康问题,但是可能会传递给接受造血干细胞移植的癌症患者。在移植前患者接受放疗和化疗以及服用免疫抑制剂使得携带这些罕见突变的造血干细胞有机会快速地增殖,从而给接受造血干细胞移植的患者带来健康问题,比如心脏损伤、移植物抗宿主病和可能的新白血病。相关研究结果发表在2020年1月15日的Science Translational Medicine期刊上,论文标题为“Engraftment of rare, pathogenic donor hematopoietic mutations in unrelated hematopoietic stem cell transplantation”。
这项涉及AML患者及其造血干细胞供者样本的研究表明这些罕见的有害突变存在于非常年轻的供者中,可给受者带来健康问题,即使这些突变非常罕见以致于利用传统基因组测序技术无法在供者中检测到,也会如此。这些研究结果为在更多的健康供者中探究这些罕见突变的更大型研究打开了大门,从而可能导致人们开发出方法来阻止或减轻这类遗传错误给接受造血干细胞移植的患者带来的健康问题。
8.Stem Cell Rep:癌症研究帮助开发有用的造血干细胞
doi:10.1016/j.stemcr.2019.12.009
在超过25年的时间里,大量的研究工作试图使个性化的血液干细胞用于治疗白血病以及许多其他类型疾病。研究人员采取的一种方法是采集患者的成年细胞,然后对其进行“解码”,以产生诱导性多能干细胞(iPSC),该干细胞能够形成人体的任何细胞类型,包括血细胞在内。不幸的是,这些iPSC也有可能发育成癌细胞。因此研究人员将工作重心重新集中在制造造血干细胞(HSC)上,造血干细胞不能制造任何类型的细胞,但可以产生多种类型的血细胞。好消息是,HSC似乎不会像iPSC一样引起癌症。坏消息是研究人员无法创建可以在体内保持生长的HSC。
图片来源:Www.pixabay.com
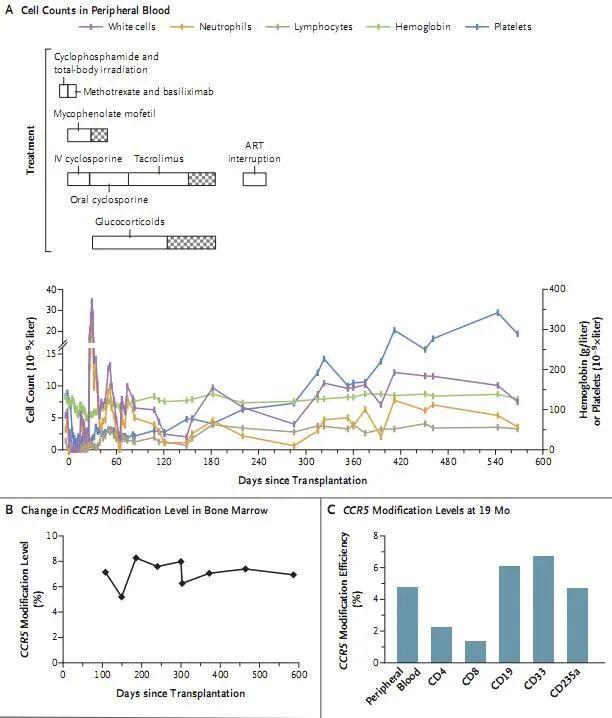
CCR5修饰的HSPCs的移植,图片来源:Lei Xu et al. N Engl J Med 2019
我们都知道,如今CRISPR-Cas9基因编辑工具对哺乳动物细胞的基因组进行编辑已经被广泛使用了,该技术展现出了潜在的临床使用前途,而且目前研究人员已经开始利用该技术来探寻基于CRISPR的疗法治疗人类疾病的安全性和可行性。CCR5是HIV-1感染人体的一个保护性靶点,CCR5缺失的血细胞常常对HIV-1的感染有很大的抵抗力;有研究表明,当将携带天然CCR5突变的造血干细胞和祖细胞(HSPCs,hematopoietic stem and progenitor cells,造血干祖细胞)进行同种异体移植后(allogeneic transplantation)就能长期根除HIV-1,因为CCR5是HIV进入机体的关键共受体,这些事例或许就增加了一种可能性,即移植携带人工破坏CCR5的细胞或能作为一种新方法来制造对HIV-1感染耐受的细胞。
中国科学家的这项最新研究描述了同种异体干细胞移植后CCR5 CRISPR基因编辑的CD34+细胞的长期移植状况,其对循环骨髓细胞基因组的基因干扰比率不到8%,而且并不存在基因编辑的脱靶效应。这项长达多年的工作目前已经初步证实了基因编辑造血干细胞在临床应用中的可行性与安全性,未来将会促进和推动该技术的临床应用。未来研究人员将会继续深入研究通过各种方法来优化基因编辑造血干细胞移植方案,从而降低脱靶率,实现100%的CCR5的敲除效率。







 本文梳理了造血干细胞研究进展。造血干细胞可存在于造血组织及血液,在骨髓移植和疾病治疗中作用重要。研究发现其能记住感染经历以提高免疫反应,也指出供者干细胞中罕见有害突变或给受者带来问题。还提及利用CRISPR - Cas9编辑造血干细胞治疗疾病的可行性与安全性。
本文梳理了造血干细胞研究进展。造血干细胞可存在于造血组织及血液,在骨髓移植和疾病治疗中作用重要。研究发现其能记住感染经历以提高免疫反应,也指出供者干细胞中罕见有害突变或给受者带来问题。还提及利用CRISPR - Cas9编辑造血干细胞治疗疾病的可行性与安全性。
















 1380
1380

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








