推荐阅读:
细胞转染的方法主要包括:人工脂质体法、磷酸钙法、DEAE-右旋糖苷法、电穿孔法、病毒转导法等,上期详解了细胞转染常用的方法-脂质体转染的原理和步骤 等,今天做个细胞转染技术大比拼,了解各种细胞转染的方法优缺点,再根据自己的实验要求选择理想的方法,获得漂亮的实验结果。
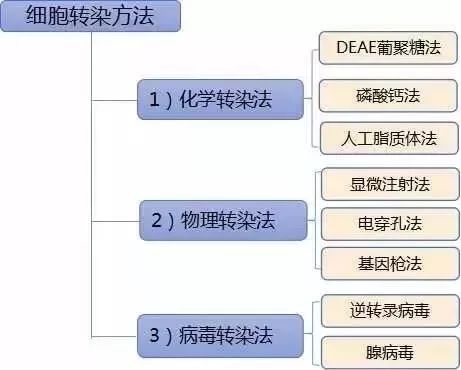
接下来,详述一下几种经典细胞转染的方法。
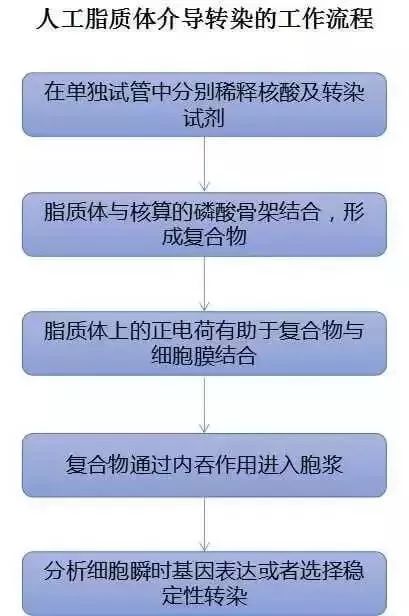
一、人工脂质体法
带正电的脂质体与核酸带负电的磷酸基团形成复合物,进而可被细胞内吞稳定转染/瞬时性转染。这种方法几乎适用于所有细胞,转染效率高、重复型好,但转染时需要去除血清,转染效果随细胞类型变化大。
脂质体转染的原理与步骤:
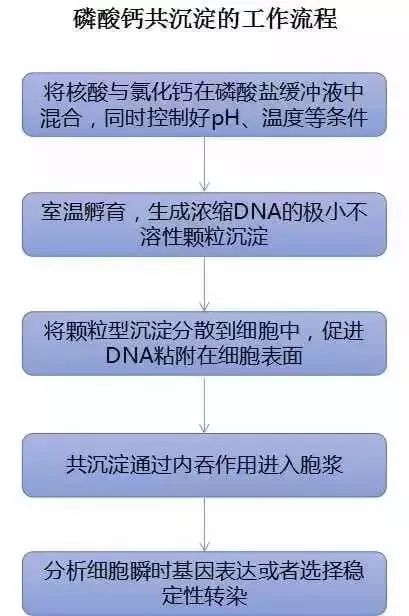
二、磷酸钙法
通常穿了“隐身衣”核酸分子在“照妖镜”磷酸钙的作用下可形成“肉眼可见”的磷酸钙-DNA共沉淀,可使共沉淀中浓缩DNA分子与细胞表面结合并通过内吞作用进入细胞。该法可用于瞬时或稳定转染。然而因其对pH、温度和缓冲液盐浓度的微小变化十分敏感,所得结果容易出现差异,且对许多类型的细胞培养物(尤其是原代细胞)具有细胞毒性,转染效率较差。
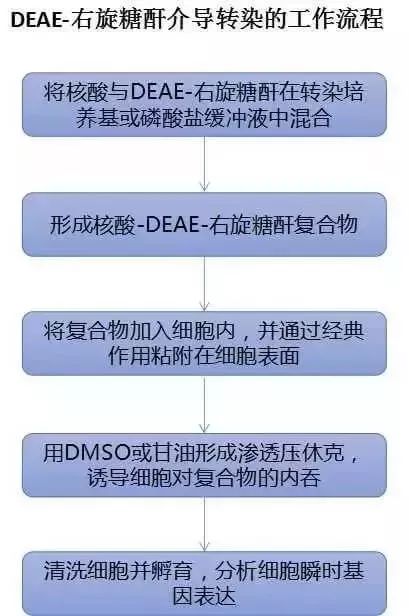
三、DEAE-右旋糖苷法
常言道:同性相斥,异性相吸。因而,当带正电的DEAE-右旋糖苷与核酸中带负电的磷酸骨架相遇,妥妥的火花四射,而后会被细胞膜抱团相拥并通过细胞内吞作用迎客到家。该法可用于瞬时转染,操作相对简单、结果可重复,但是对细胞有一定的毒副作用,且转染时需要血清。
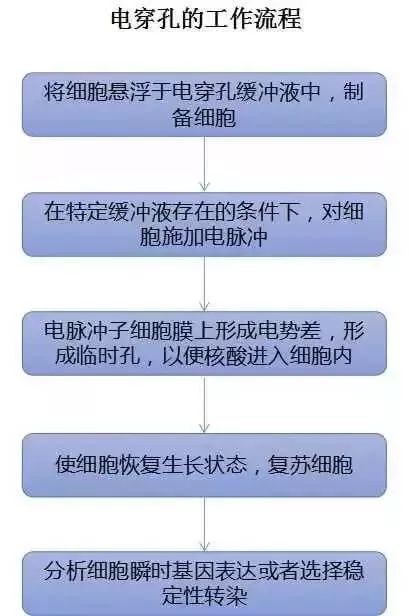
四、电穿孔法
有时,细胞有些“油盐不进”,就是不开放门户给核酸放行,此时各位小伙伴可采用一些强硬手段—电穿孔法。此法利用高脉冲电压破坏细胞膜电位,使得DNA 通过膜上形成的小孔导入稳定/瞬时性转染,适用于所有类型的细胞,但细胞致死率高,DNA和细胞用量大,且需根据不同细胞类型优化电穿孔实验条件。
其他物理基因输送法还包括基因枪、直接显微注射等方式。前者又称为粒子轰击,可将包裹着核酸的显微重金属颗粒告诉射入受体细胞内,适用于瞬时性转染。该技术可需要昂贵的设备,且细胞死亡率较高。而后者则是通过精细的注射针将核酸送入胞浆中,一次只能输送一个细胞中,适用于构建转基因动物或输送人工染色体。
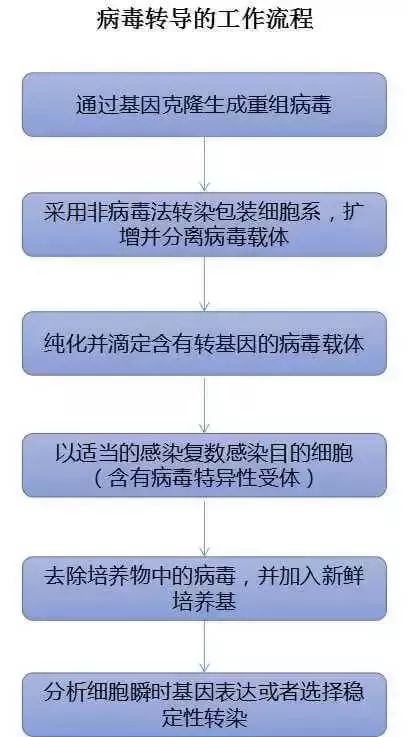
五、病毒转导法
一般,病毒介导的转染也称之为转导,它为难以转染的细胞类型提供了一种方法,可用于蛋白质过表达或抑制,是临床研究中最常用的方法。它通过侵染宿主细胞将外源基因整合到染色体中,可用于难转染细胞、原代细胞的稳定性转染。
技术应用案例:

LONZA 4D-Nucleofector细胞核转染系统,即原德国Amaxa 4D-Nucleofector核转系统,结合电穿孔技术和细胞特异性转染液,通过系统内置优化的转染程序,将外源基因高效导入目标细胞的细胞质中,并可直接入核,整合到细胞染色体中。
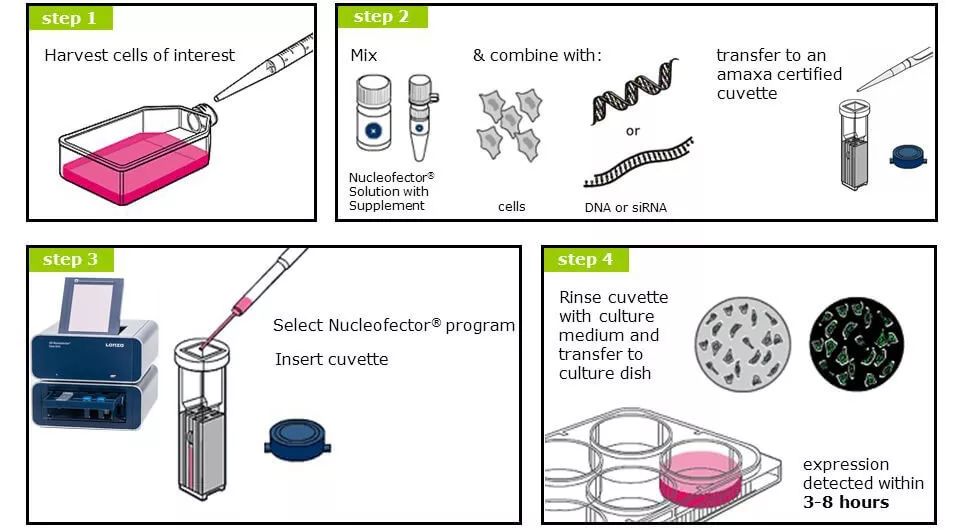
Nucleofector核转系统可用于免疫细胞、干细胞、神经细胞、内皮细胞等较难转染的原代细胞和各类细胞系中,其不依赖于病毒感染、不依赖于细胞有丝分裂,可加快基因表达,已成功转染1200余种细胞系、130余种原代细胞,多数细胞系转染效率可高达50-70%,部分原代细胞转染效率可超过90%。目前,LONZA 4D-Nucleofector已大量应用于CAR-T细胞的研究中。
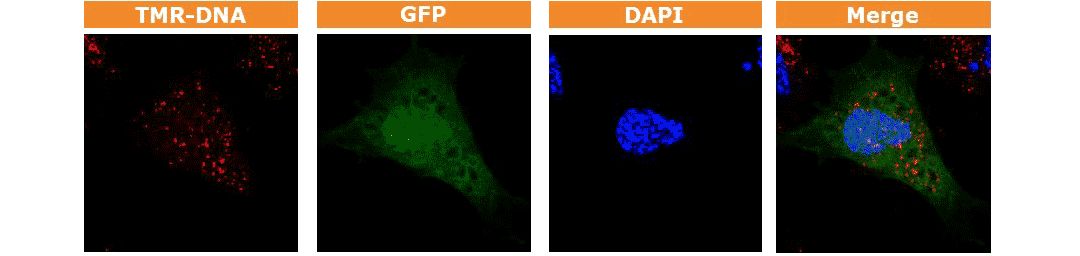
图.用Nucleofector细胞核转染系统,将GFP标记的质粒转染新生儿皮肤成纤维细胞(NHDF-neo),2小时后用3.5% PFA 固定,共聚焦显微镜可观察到GFP蛋白在细胞核内表达。

LONZA 4D-Nucleofector细胞核转染系统,配备多种转染模块,可满足不同细胞类型、不同数量、不同通量的转染实验需求;

电转过程中配合使用不同细胞类型专用转染试剂,转染效率远高于传统电转仪;

采用由新型高分子聚合物制造的电极,相比传统铝制电转杯,杜绝金属离子毒害,细胞转染后成活率更高。

为提高细胞核转染效率,优化转染条件必不可少,相比其他品牌,LONZA可提供全球共享的数据库,可检索到700种以上的细胞转染数据和操作手册,除转染操作指导外,还提供细胞来源、传代、生长条件、培养基、转染后细胞培养基等各类技巧,大大节省摸索时间和试剂耗材损耗。

4D-Nucleofector细胞核转染平台,在小体积转染条件优化成功后,可不改变转染条件,直接用于大体积转染中,一次获得最多1*10^9数量的细胞,大大缩短实验时间。

LONZA 4D-Nucleofector细胞核转染系统,由1个主机加不同模块构成,各模块可单独配置:
1.C模块(必选):细胞核转染系统主机,即核心模块(Core unit),内置各类细胞转染程序。

2.X模块(可选):最常选择的小体积转染模块,用于各类悬浮细胞转染。允许使用2个电极杯和1个中通量16孔电极板条。其中电极杯为100uL体系,适用于2*10^5至2*10^7数量细胞;16孔电极板条各孔为20uL体系,适用于2*10^4至1*10^6数量细胞,可同时转染16个样品。

3.Y模块(可选):用于各类贴壁细胞的原位转染,无需消化细胞。允许使用1个24孔电极板,各孔为350uL体系,可同时转染24个样品。

4.LV模块(可选):用于一种细胞的大规模连续转染。允许使用电转盘,其中小体积电转盘允许手动注射填充1mL,适用于1*10^7至1*10^8数量细胞;更大体积的电转盘允许以1mL体积不断进样,配合储液罐或储液袋,连续处理20mL体积,最高可转染10^9数量细胞。

5.96孔模块(可选):用于高通量细胞转染,需要同时配置X模块。允许使用1个可拆卸的96孔电极板,由6个16孔电极板条组成,适用于2*10^4至1*10^6数量细胞,可同时转染96个样品,经常用于摸索转染条件。

相关文献
Ribonucleoprotein Transfection for CRISPR/Cas9-Mediated Gene Knockout in Primary T Cells.(Curr Protoc Immunol,2019,124(1):e69)
Engineering of CRISPR-Cas12b for human genome editing.(Nature,2019,10(1):212)
CRISPR-Cas9 genome engineering of primary CD4+ T cells for the interrogation of HIV-host factor interactions.(Nat Protocols,2019,14(1):1-27)
Bacteria-free minicircle DNA system to generate integration-free CAR-T cells.(J Med Genetics,2019,56:10-17)
Guide Swap enables genome-scale pooled CRISPR-Cas9 screening in human primary cells.(Nat Methods,2018,15(11))
Nucleofection with Plasmid DNA for CRISPR/Cas9-Mediated Inactivation of Programmed Cell Death Protein 1 in CD133-Specific CAR T Cells.(Hum Gene Ther,2018)
Optimized RNP transfection for highly efficient CRISPR/Cas9-mediated gene knockout in primary T cells.(J Exp Med,2018,215(3):985-997)
LONZA 4D-Nucleofector细胞核转染系统免费试用中,微信搜索“泽平科技”公众号进入咨询。

























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








