【摘要】
近日,中共中央、国务院印发了《质量强国建设纲要》,“加强药品和疫苗全生命周期管理,完善信息化追溯体系,实现重点类别产品全过程可追溯... ..."全球的生物药市场正面临转型,生物医药公司就已经在积极寻求创新科技,以赋能生物医药全产业链。应用场景包括研究开发的助力、临床试验的便捷化、临床数据的实时监测和精准采集、大数据支持和智能工作流程等长期的数字化转型推进。 百奥利盟®系统助力精准医疗与创新生物药企业,赋能全程数字化追溯平台管理建设。
展望未来:新华社北京2月6日电 近日,中共中央、国务院印发了《质量强国建设纲要》,并发出通知,要求各地区各部门结合实际认真贯彻落实。
《质量强国建设纲要》建设质量强国是推动高质量发展、促进我国经济由大向强转变的重要举措,是满足人民美好生活需要的重要途径。为统筹推进质量强国建设,全面提高我国质量总体水平,制定本纲要。
五、加快产品质量提档升级
(十)加强药品和疫苗全生命周期管理,推动临床急需和罕见病治疗药品、医疗器械审评审批提速,提高药品检验检测和生物制品(疫苗)批签发能力,优化中药审评机制,加速推进化学原料药、中药技术研发和质量标准升级,提升仿制药与原研药、专利药的质量和疗效一致性。加强农产品食品药品冷链物流设施建设,完善信息化追溯体系,实现重点类别产品全过程可追溯。
八、增强企业质量和品牌发展能力
(二十)提升全面质量管理水平。鼓励企业制定实施以质取胜生产经营战略,创新质量管理理念、方法、工具,推动全员、全要素、全过程、全数据的新型质量管理体系应用,加快质量管理成熟度跃升。强化新一代信息技术应用和企业质量保证能力建设,构建数字化、智能化质量管控模式,实施供应商质量控制能力考核评价,推动质量形成过程的显性化、可视化。引导企业开展质量管理数字化升级、质量标杆经验交流、质量管理体系认证、质量标准制定等,加强全员质量教育培训,健全企业首席质量官制度,重视质量经理、质量工程师、质量技术能手队伍建设。
九、推进质量治理现代化
(二十七)优化质量监管效能。建立健全产品质量安全风险监控机制,完善产品伤害监测体系,开展质量安全风险识别、评估和处置。建立健全产品质量安全事故强制报告制度,开展重大质量安全事故调查与处理。健全产品召回管理体制机制,加强召回技术支撑,强化缺陷产品召回管理。构建重点产品质量安全追溯体系,完善质量安全追溯标准,加强数据开放共享,形成来源可查、去向可追、责任可究的质量安全追溯链条。
回顾历史
1959年,西德儿科医生Weidenbaeh首先报告了一例女婴的罕见畸形,称为“海豹肢畸形儿”及“海豹胎”。从1956年进入市场到1962年撤药,震惊全世界的“反应停”事件,波及德国、日本、欧洲等国家1万余例“海豹肢畸形”婴儿。医学研究表明,“海豹胎”病因是妇女在怀孕初期服用“反应停”所致,也是药物审批制度不完善的产物。这一悲剧增强了人们对药物毒副作用的警觉,从而进一步完善了现代药物的审批制度。
1972~1973年,新西兰、丹麦率先实施了GLP实验室登记规范。美国食品药品监督管理局(Food and Drug Administration, FDA)也于1976年11月颁布了GLP法规草案,并于1979年正式实施。1981年,国际经济合作与发展组织(Organization for Economic Cooperation and Development, OECD)制定了GLP原则。80年代中,日本、韩国、瑞士、瑞典、德国、加拿大、荷兰等国也先后实施了GLP规范。GLP逐渐成为国际通行的确保药品非临床安全性研究质量的规范。
我国从1991年开始起草GLP,并于1993年原国家科委颁布、1994年生效。1998年国家食品药品监督管理局(NMPA)根据国际GLP的发展结合我国的实际情况,颁布了《药品非临床研究质量管理规范》,并于1999年实施。2007年规定未在国内上市销售的化学原料药及其制剂、生物制品,未在国内上市销售的从植物、动物、矿物等物质中提取的有效成分及其制剂以及中药注射剂等的新药非临床安全性评价研究必须在经过GLP认证、符合GLP要求的实验室进行,这标志着我国从开始的GLP试行到目前强制性实施。
全球数字化转型进程加速 从长期转型变成短期必需

全球的生物药市场正面临转型,在新冠疫情爆发之前,生物医药公司就已经在积极寻求创新科技,以赋能生物医药全产业链。应用场景包括研究开发的助力、临床试验的便捷化、临床数据的实时监测和精准采集、大数据支持和智能工作流程等长期的数字化转型推进。疫情爆发后,数字化转型的进程被迫大幅加速,从长期转型变成了短期必需。
在全球趋势的影响下和国内双循环发展模式的推动下,中国生物医药产业的创新逐渐发展出自己的特色,主要体现在政府机构对于生物创新药的重视、生物医药产业数字化转型的领先、人工智能对生物医药全产业链的赋能持续加大等方面。
预计到2025年,用药诊疗模式将出现很大的转变,临床医生将以具备4P要素-预测性(predictive)、预防性(preventative)、个性化(personalized)和参与性(participatory)的治疗方法为基础来进行诊断和诊疗的相关决策。具备4P要素的产品分别为数字诊疗(人工智能、纳米科技等)与细胞和基因治疗(表观遗传学、细胞治疗、基因编辑等)。
百奥利盟BioTechLeague:为全球精准医疗和创新生物药企业提供全程数字化解决方案
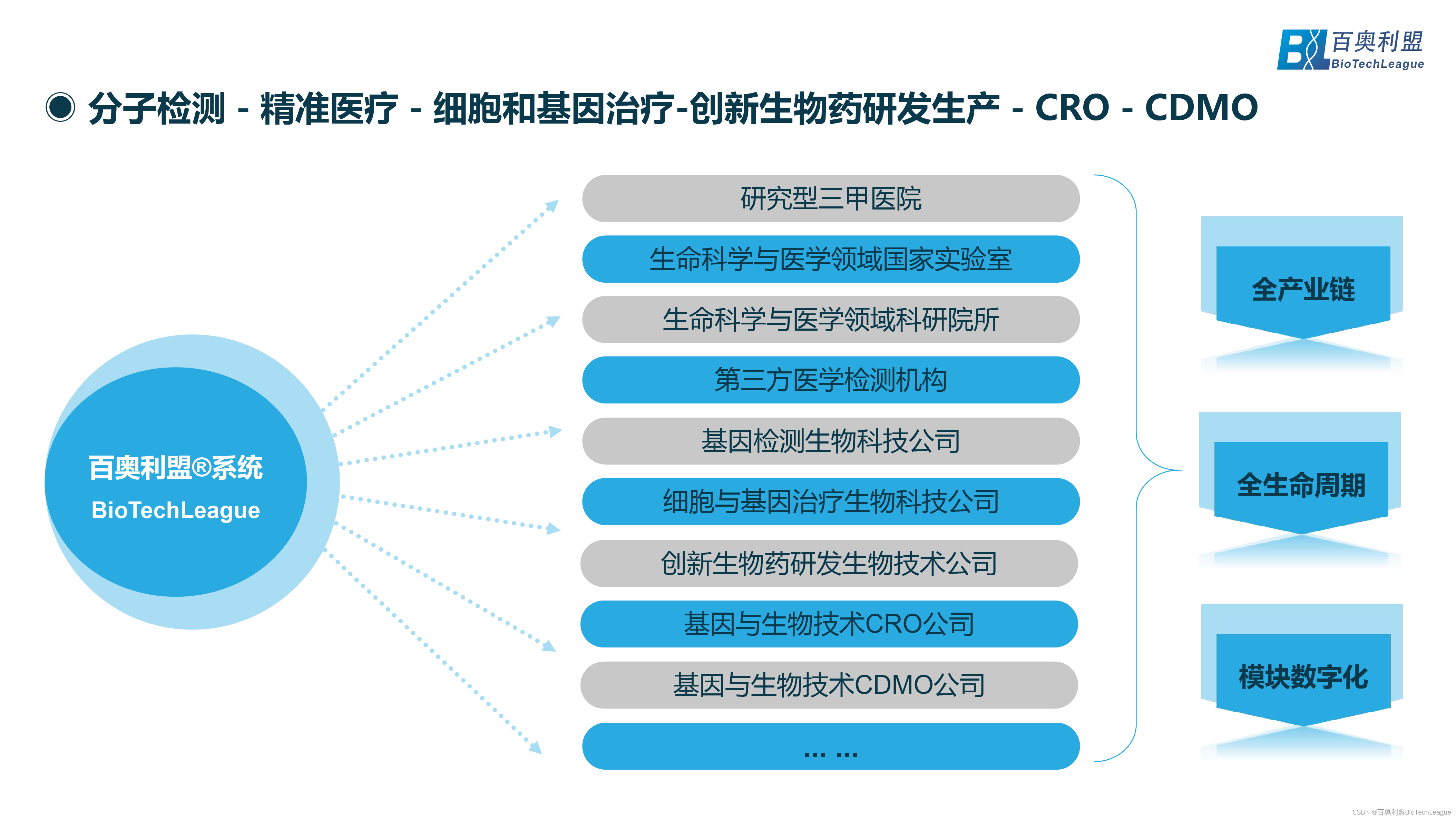
百奥利盟致力于为全球精准医疗和创新生物药企业提供全程数字化解决方案,服务的客户涵盖研究型三甲医院、生命科学与医学领域国家实验室、生命科学与医学领域科研院所、第三方医学检测机构、基因检测生物科技公司、细胞与基因治疗生物科技公司、创新生物药研发生物技术公司、基因与生物技术CRO公司、基因与生物技术CDMO公司等生命科学领域。
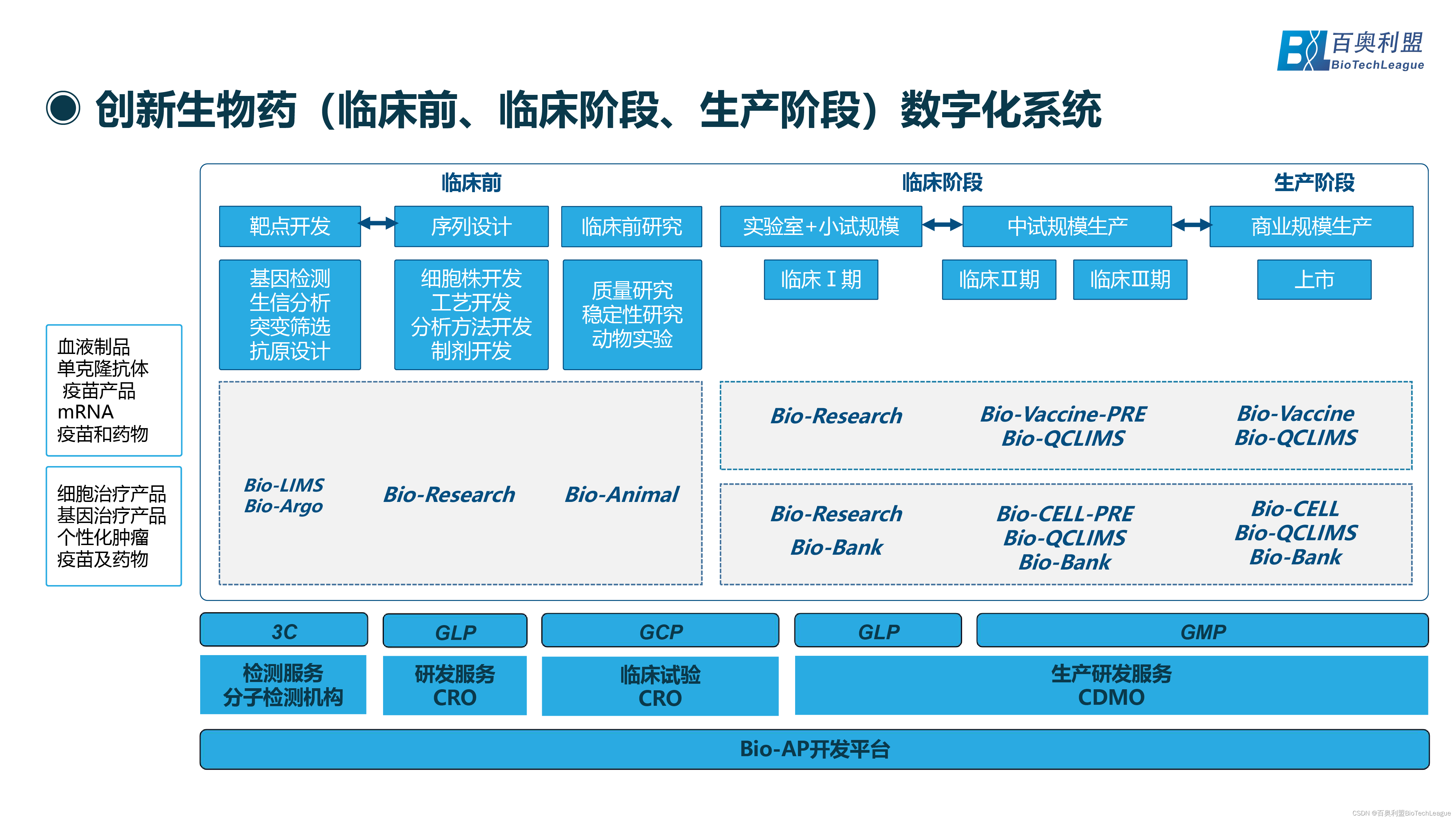
创新生物药(临床前、临床阶段、生产阶段)都需要怎样的数字化系统?首先针对生物制品行业或者生物药行业不同产品(如:血液制品、抗体、mRNA疫苗药物、个性化细胞与基因治疗、mRNA个性化肿瘤药物等)。在临床前靶点开发阶段需要基因测序、生信分析、突变筛选、抗原设计等,可使用Bio-LIMS智慧实验室管理系统、Bio-Argo生物信息平台的系统产品来解决实验室以及生信分析等的数字化系统。在序列设计的各种实际开发,包括细胞株开发、工艺开发、分析方法开发、制剂开发等,都可以用Bio-Research针对研发实验室的数字化系统;在临床前阶段质量研究、稳定性研究、动物实验等,可以用Bio-Animal动物实验数字化系统做支持。
在临床阶段(实验室+小试规模、中期规模生产、商业化规模),建议临床一期阶段还是需要研发相关的数字化系统,如Bio-Research研发实验室管理系统、Bio-Bank生物样本库管理系统。在临床二期、三期规模增长后(特别是三期中试以后),在流程还未完全固定的现实情况下急需偏灵活的、生产相关的系统(生产前期的数字化系统)以及质控、样本库系统,如Bio-Vaccine-PRE疫苗生物药生产数据一体化信息平台-研发阶段、Bio-CELL-PRE细胞和基因治疗数据一体化信息平台-研发阶段、Bio-QCLIMS质控信息化管理系统、Bio-Bank生物样本库管理系统。
在商业化生产阶段,使用Bio-Vaccine疫苗生物药生产数据一体化信息平台、Bio-CELL细胞和基因治疗数据一体化信息平台、Bio-QCLIMS质控信息化管理系统、Bio-Bank生物样本库管理系统,从研发到临床到生产形成无缝衔接。对于当前创新生物药领域,很多企业都处在创业阶段(即:中试、临床、生产中间阶段),确实需要相对轻量级、灵活性的,既符合生产标准要求,也符合灵活属性的数字化系统进行支持。
对于各种企业CRO、CDMO等药企单位,都面临着不同机构监管与法规规范要求。针对数字化系统一定要有一个技术开发的基础平台,不管是实验还是生产等环节都构建成模块化服务进行后期的组装。
百奥利盟®系统 数字化合规
百奥利盟提供的数字化解决方案完全符合生命科学行业的法规和规范,主要从基本法规、实验室规范、生产GMP规范三个层面,具体内容如下:
基础法规层面:
符合21 CFR Part11(电子记录及电子签名法规)、 ALCOA+CCEA原则(数据可靠性原则)以及中华人民共和国电子签名法;
实验室规范层面:
符合GLP(良好实验室规范)、ISO17025(检验与校准实验室证),ISO15189(医学实验室认证),CAP/CLIA(美国病理家协会实验体系认证)等相关法规对计算机化系统的要求;
生产GMP规范层面:
符合 ISPE GAMP5,NMPA《计算机化系统》、NMPA 《药品记录与数据管理规范》、 NMPA 《生物制品》、 NMPA 《细胞治疗产品生产质量管理指南(试行)》以及FDA和欧盟的相关法规和规范;
---------------------------------------------------------------------------------------------------------------------------------
参考资料:
《中国生物医药创新趋势展望》
相关法规和规范:
▪ HIPPA(病人隐私信息保护法案)
▪ 中国人类遗传资源管理条例
▪ 21 CFR Part11(电子记录及电子签名法规)
▪ 中国电子签名法
▪ ALCOA+CCEA原则(数据可靠性原则)GMP相关规范
▪ NMPA 2010年5月 GMP附录《计算机化系统》《确认与验证》
▪ NMPA 2020年2月 《药品记录与数据管理规范》
▪ NMPA 2020年7月 GMP附录 《生物制品》
▪ NMPA 2020年1月 《药品生产质量管理规范-细胞治疗产品附录》COI(身份链)COC(监管链)
▪ EU 欧盟药事法规第4卷GMP,附录11《计算机化系统》
▪ ISPE GAMP5-2 良好自动化生产实践指南,遵从GxP计算机化系统监管的风险管理方法
▪ ISPE PHARMA4.0
▪ WHO GMP 2003,Annex4实验室相关规范
▪ GLP-计算机化系统的要求
▪ PCR临床实验室规范
▪ ISO17025(检验与校准实验室认证)
▪ ISO15189(医学实验室认证)
▪ ASTM E 2066(实验室信息管理系统的鉴定标准导则)
▪ ASTM E 1578(实验室信息管理系统(LIMS)的标准指南)
▪ CAP/CLIA(美国病理家协会实验体系认证)
▪ AAALAC(国际实验动物规范)
▪ AABB(生物样本库国际认证)






















 178
178











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








