本文内容速览:

背景介绍
蛋白质并不总以单个分子的形式发挥功能,许多关键的生物过程依赖于蛋白质的寡聚化(oligomerization),即蛋白质与自身或其他蛋白质结合形成超分子复合物,根据组成单位的多少,蛋白复合物可以是二聚体、三聚体甚至更高阶的多聚体。
蛋白质寡聚化在原核生物和真核生物中广泛存在,大约30%~50%的蛋白质都参与了寡聚化(Levy and Teichmann, 2013)。它的作用在于:一,功能强化:多个单体协同工作可提高催化效率或信号传递速度;二,动态调控:通过单体的增减或修饰,快速响应环境变化;三,功能变化:异源寡聚化可能赋予蛋白复合物全新的生物学功能。
在植物中,许多代谢途径中的关键酶,如PEPC(磷酸烯醇式丙酮酸羧化酶)和Rubisco(核酮糖-1,5-二磷酸羧化酶)都以寡聚体形式存在,以提高催化效率并增强功能调控能力。另外,得益于越来越精细的信号通路机理解析,大家平时阅读文献,也会发现越来越多的蛋白复合物即蛋白寡聚体的分子机制被报道。但以上这些都不是伯小远想重点关注的,本篇文章主要关注单个蛋白自身形成寡聚体这种情况,看看这种类型的蛋白寡聚体在植物体内能发挥什么作用,对大家平时研究信号通路有没有什么启发。
抗病蛋白的寡聚化
关于植物免疫的基础知识,大家可以去看看小远以前写的文章“植物免疫系统的御敌机制”,小远在此就不多介绍了。
NLR抗病蛋白作为植物免疫系统的核心组分,通过特异识别病原体效应因子激活防御反应,引发侵染区细胞程序性死亡以限制病原扩散。值得注意的是,其表达水平在植物体内相对较低——过高的表达量会引发持续性免疫信号传导,导致能量过度消耗并引发生长抑制现象,最终导致植物出现生长抑制和产量下降等负面表型。
但在茄科的番茄、烟草中却有一类特殊的NLR抗病蛋白,它能与多种抗病蛋白协作,帮助植物抵抗病原体,其表达量在没有病原体侵染时也保持着较高的水平,且并不会因此引发免疫反应。
2024年6月,湘湖实验室马守偲团队、德国马普研究所Paul Schulze-Lefert团队和西湖大学柴继杰团队联合在Nature杂志上发表了一篇题为“Oligomerization-mediated autoinhibition and cofactor binding of a plant NLR”的研究论文,该研究首次发现了番茄NLR抗病蛋白SlNRC2通过寡聚化介导了自抑制,即SlNRC2通过形成高阶寡聚体处于失活状态,避免自激活引发免疫反应,而当病原体来袭时,SlNRC2会迅速从高阶寡聚体中解脱,快速启动抗病反应。

图1 SlNRC2二聚体、四聚体和高阶寡聚体的三维结构重构图(Ma et al., 2024)。

图2 破坏SlNRC2的寡聚化会引发本氏烟的细胞程序性死亡(Ma et al., 2024)。(a)SlNRC2的二聚化构象;(b)SlNRC2二聚体与ZAR1抗病小体的侧向二聚体的结构比对;(c)Co-IP测试破坏SlNRC2的寡聚化后对自身蛋白的结合能力;(d)表型观察:破坏SlNRC2的寡聚化会介导细胞程序性死亡;(e)离子泄露实验。
转录因子的寡聚化
单个转录因子的DNA结合结构域(DBD)通常仅能特异性识别4~6bp的顺式元件。以6bp序列为例,其随机出现频率为每4096bp(即4^6)一次,那么如果是在拟南芥基因组(约135Mbp)中,则理论上存在约3.3万个潜在结合位点,而实际上转录因子能调控的元件仅占极小比例。因此,若仅依赖单体结合,转录因子难以从海量序列中精准定位靶基因顺式元件。在植物中,一些转录因子的DBD具有独特的寡聚化基序,转录因子通过两种寡聚化模式增强结合特异性:一种模式是,通过形成寡聚体满足DNA结合的结构需求,寡聚化使转录因子与DNA结合的能力提高了一个数量级;另一种模式是,寡聚化蛋白分别结合单独的DNA元件,通过识别更长的DNA序列提高结合的特异性(Strader et al., 2022)。此外,有些转录因子通过寡聚化后使DNA发生局部构象变化,促进与其他辅因子的协同招募,以进一步提高特异性。转录动力学研究表明,寡聚化的转录因子能够降低转录因子对靶标的搜索时间、延长与靶标结合的停留时间(Mankun Sang, 2024)。
下面,小远列举了一些研究转录因子寡聚化的文献,一起来看看吧。
2016年4月,格勒诺布尔阿尔卑斯大学François Parcy团队在Nature Communications杂志上发表了一篇题为“A SAM oligomerization domain shapes the genomic binding landscape of the LEAFY transcription factor”的研究论文,作者发现植物花发育的主调控转录因子LEAFY(简称为LFY)的N末端有一个在植物中从未表征过的结构域SAM,该结构域介导了LFY的寡聚化,作者通过体外实验证明所有影响寡聚化相互作用界面的突变都会完全消除LFY的寡聚化,而体内实验也证明寡聚化相互作用界面的突变会影响LFY的功能。

图3 LFY的N端为SAM结构域(Sayou et al., 2016)。(a)银杏GbLFY蛋白的结构域,蓝色为N端结构域,橙色为DNA结合结构域,虚线框表示用于获取晶体结构的区域;(b)GbLFY-N单体的晶体结构,分辨率为2.3Å,该单体由五个α螺旋组成。

图4 LFY-SAM寡聚化界面的突变会破坏拟南芥LFY的功能(Sayou et al., 2016)。结果显示,在61株35S启动子驱动LFY基因表达的植株中,有一半的植株出现茎过早终止生长以及莲座叶腋处形成易位的花(c),但在51株35S启动子驱动LFYTERE基因(突变了SAM寡聚化相互作用界面的位点)表达的植株中,完全未观察到易位的花(d)。
再来说说另一种转录因子。HY5是一个著名的植物光形态建成关键转录因子,属于碱性亮氨酸拉链(bZIP)转录因子家族,该家族可能通过C端亮氨酸拉链结构形成同源或异源二聚体,进而调控靶基因转录。2023年8月,德里大学Akanksha Bhatnagar和Paramjit Khurana团队在Plant Physiology杂志上发表了一篇题为“Two splice forms of OsbZIP1, a homolog of AtHY5, function to regulate skotomorphogenesis and photomorphogenesis in rice”的研究论文,作者通过Y2H和BiFC实验证明AtHY5在水稻中的同源蛋白OsbZIP1.1和OsbZIP1.2均会发生二聚化,不过该研究在后续并未就二聚化对水稻光形态建成方面的意义作更深入的研究。

图5 通过Y2H(B)和BiFC(C)实验证明OsbZIP1.1和OsbZIP1.2发生同源或异源二聚化(Bhatnagar et al., 2023)。
了解了LEAFY和bZIP,咱们再来了解一下MADS转录因子。MADS转录因子几乎存在于所有的真核生物中,拟南芥中存在超过100种I型MADS转录因子和II型MADS转录因子,它们都包含MADS盒(M结构域)和C结构域(C端),但II型比I型增加了寡聚化域,即I结构域(间隔)和K结构域(角蛋白样螺旋),这两个结构域是在进化中获得的,能使II型MADS转录因子与自身或其他转录因子形成二聚体或四聚体,而这也让MADS家族的功能变得异常多样。
2014年9月,格勒诺布尔阿尔卑斯大学Chloe Zubieta团队在The Plant Cell杂志上发表了一篇题为“Structural basis for the oligomerization of the MADS domain transcription factor SEPALLATA3 in Arabidopsis”的研究论文,作者通过晶体结构解析,发现II型MADS家族转录因子SEP3的K结构域具有典型的亮氨酸拉链结构,其形成的螺旋对SEP3转录因子的二聚化和四聚化极为重要,并通过实验证实寡聚化界面的突变会显著降低四聚体比例,而SEP3的一种可变剪接体由于缺失部分K结构域序列导致完全丧失四聚化能力。

图6 SEP3的寡聚化结构域(Puranik et al., 2014)。(A)SEP3的四聚化展示,每个单体以浅绿、深绿、浅蓝、深蓝单独表示;(B)一个单体的疏水性弯曲区域;(C)SEP3的二聚化由螺旋1和螺旋2形成的分子盐桥介导;(D)沿四聚化界面的对称轴向下观察视图。
受体激酶的寡聚化
定位于植物细胞表面的受体主要由受体样激酶RLKs和受体样蛋白RLPs组成,其负责感知细胞外不同的信号分子/配体,例如激素、活性氧、肽、糖、核苷酸和离子等,一旦感知到这些分子,这些受体就会将信号传递到细胞质中,最终调节各种代谢和细胞活动。典型的植物RLKs具有高度可变的用于与配体结合的胞外结构域、将自身锚定在质膜的单次跨膜结构域和能磷酸化靶蛋白的高度保守的胞质激酶结构域(Liang X and Zhou JM,2018)。RLKs激活的普遍模式——需要配体诱导的同源二聚化或异源二聚化,即最少需要两个激酶的互作才能激活。
AtCERK1是拟南芥响应真菌细胞壁组分几丁质的重要受体激酶,在其最初被发现时,对其能否直接结合几丁质并不确定,结构生物学是受体-配体研究中最具说服力的研究方法。2012年6月,清华大学柴继杰团队、中科院遗传与发育研究所周俭民团队和郑州大学常俊标团队联合在Science杂志上发表了一篇题为“Chitin-induced dimerization activates a plant immune receptor”的研究论文,作者解析了AtCERK1的晶体结构,证明几丁质结合在AtCERK1含赖氨酸基序(LysM)的胞外结构域(AtCERK1-ECD)并诱导AtCERK1发生同源二聚化,从而激活免疫反应。八聚体几丁质作为双价配体诱导AtCERK1-ECD的二聚化,而较短的几丁质寡聚体则抑制这种二聚化,抑制这种二聚化或过表达AtCERK1-ECD形成无活性的二聚体会损害AtCERK1介导的信号传导。

图7 几丁质诱导的AtCERK1-ECD的二聚化对信号传导至关重要(Liu et al., 2012)。(A)八聚体几丁质在体外诱导AtCERK1-ECD的二聚化;(B)在溶液中,八聚体几丁质能诱导AtCERK1-ECD的二聚化,但四聚体几丁质却不能诱导;(C)在原生质体中几丁质能诱导AtCERK1-ECD的二聚化;(D)使用转基因株系制作原生质体,几丁质能诱导AtCERK1-ECD的二聚化;(E)A138H的突变减弱了几丁质诱导的FRK1::LUC的表达。
看了上面的例子,我们也不能就此认为所有的RLKs都是由配体诱导形成二聚化而被激活,有些RLKs实际上在配体结合前就已经以不活跃的二聚体形式存在。比如,位于细胞膜上的受体激酶BRI1(Brassinosteroid Insensitive 1,一种富含亮氨酸的受体样激酶)是油菜素甾醇(BR)的关键受体,BRI1在质膜上是同源二聚体的形式。BR与BRI1的结合激活BRI1的基础激酶活性,活化的BRI1在其C末端自磷酸化,随后的构象变化导致BKI1(BRI1 Kinase Inhibitor 1)从BRI1释放,之后,活化的BRI1与共受体激酶BAK1(BRI1-Associated Receptor Kinase 1)结合,它们相互磷酸化,进而完全激活BRI1(Kim et al., 2013)。
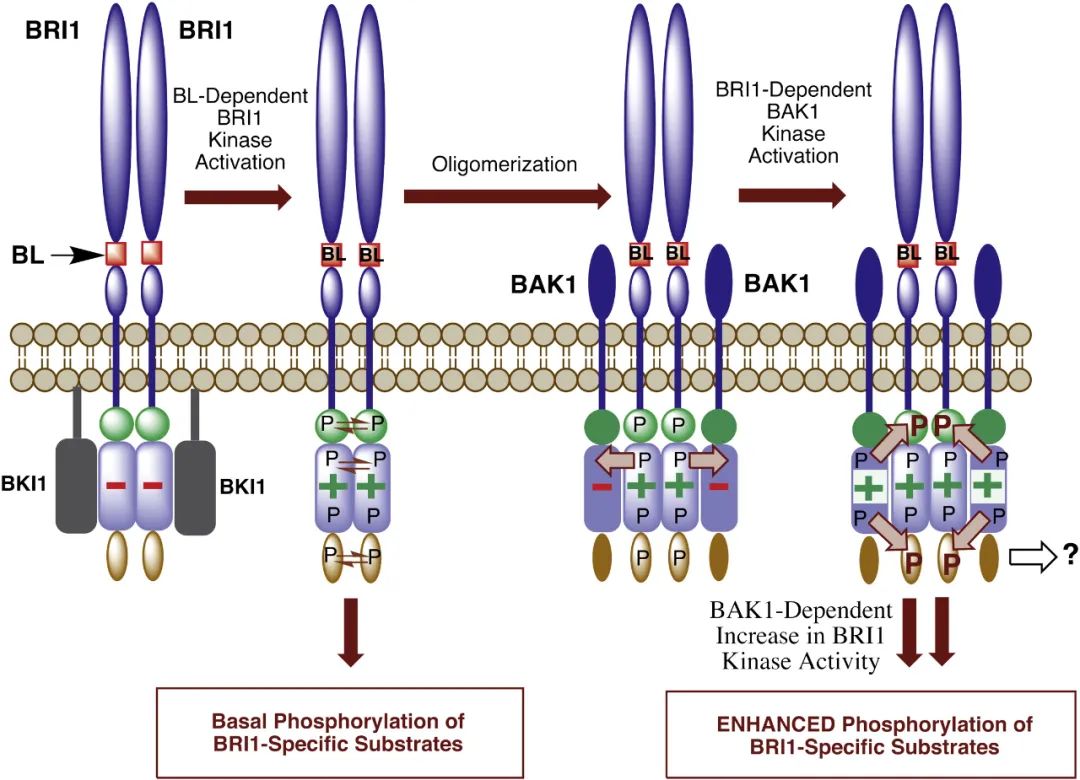
图8 BRI/BAK1相互磷酸化和激活模型(Wang et al., 2008)。
转运蛋白的寡聚化
植物的转运蛋白似乎也倾向于形成寡聚体来发挥作用,和小远一起来看看HKTs和ABCG转运蛋白的例子吧。
2024年2月,浙江大学苏楠楠、杨巍和郭江涛团队在Molecular Plant 杂志上发表了一篇题为“Structures and ion transport mechanisms of plant high-affinity potassium transporters”的研究论文,作者使用冷冻电镜解析了两类高亲和性钠钾转运蛋白HKTs的三维结构,这两类HKTs分别是拟南芥的I类HKT1;1和小麦的II类HKT2;1,它们均作为同源二聚体发挥作用,每个HKT单体由四个串联结构域D1~D4组成,并具有一个重复的钾离子通道样M-P-M拓扑结构。

图9 HKTs的结构(Wang et al., 2024)。(A)AtHKT1;1的三维重建图;(B)TaHKT2;1的三维重建图;(C)TaHKT2;1的一个单体;(D)TaHKT2;1的拓扑结构和结构域排列。
ATP结合盒(ABC)转运蛋白是一种转运各种底物的膜蛋白,其G蛋白亚家族(ABCG)成员特别丰富,在植物发育和胁迫反应中参与了多种信号通路。2024年2月,南方科技大学梁建生团队在Molecular Plant杂志上发表了一篇题为“Endomembrane-biased dimerization of ABCG16 and ABCG25 transporters determines their substrate selectivity in ABA-regulated plant growth and stress responses”的研究论文,作者通过FRET-FLIM等实验证明了拟南芥ABCG16形成了依赖于C646和C687两个半胱氨酸位点的同源二聚体,该二聚体对ABA的转运是必需的,并且定位于质膜的ABCG16同源二聚体对ABA有显著的构象变化反应;而ABCG16和ABCG25在内质网膜上形成异源二聚体,该二聚体对ABA葡萄糖酯(ABA-GE)特异响应(备注:ABA-GE被认为是ABA的贮存和长距离运输的非活性形态),并促进ABA-GE进入内质网。
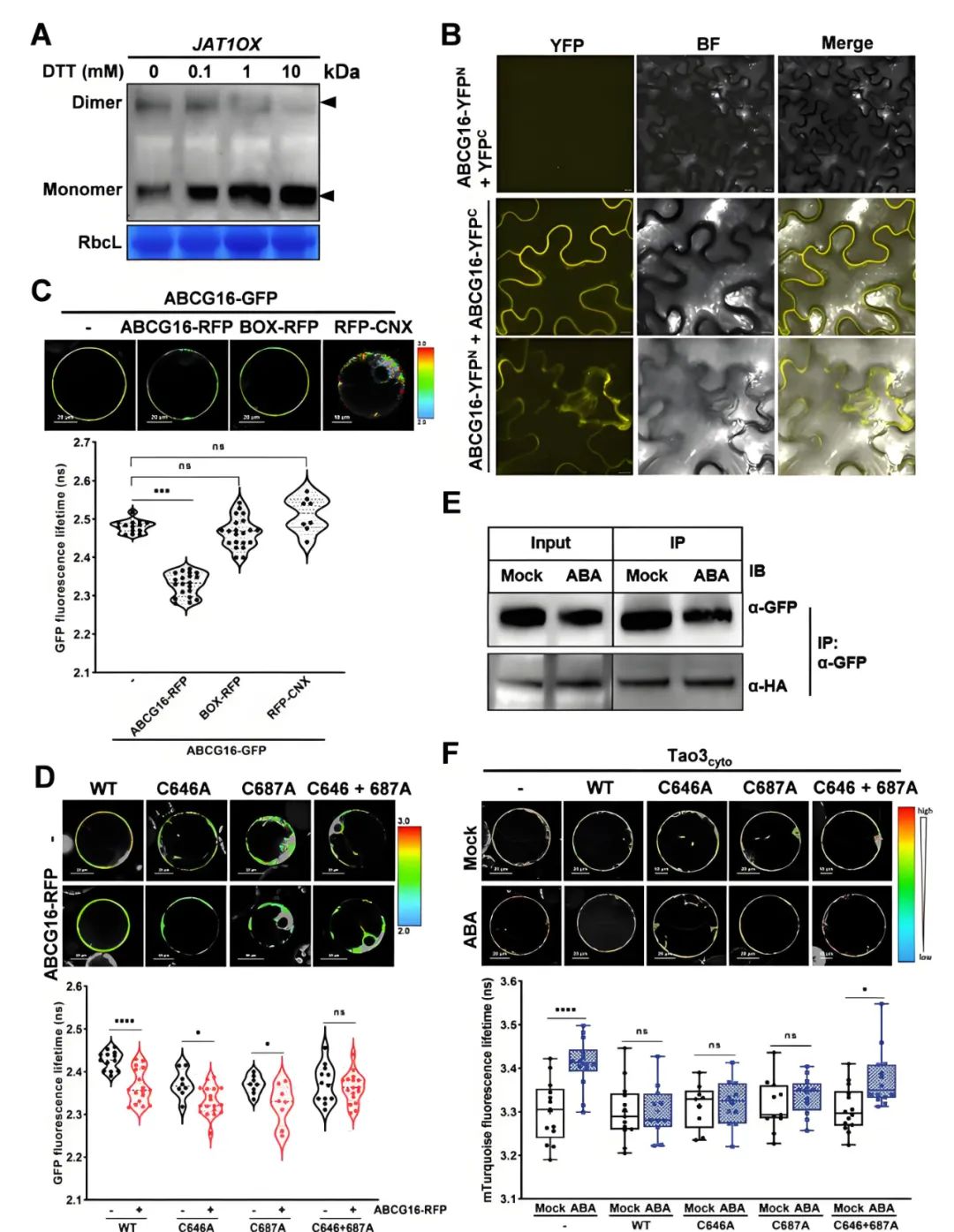
图10 ABCG16在体内形成同源二聚体,这是进行ABA转运所必需的(Zhou et al., 2024)。(A)使用DTT干扰过表达ABCG16-GFP株系中ABCG16的二聚化;(B)BiFC实验显示ABCG16在烟草细胞的质膜和内质网中发生同源二聚化;(C)FRET-FLIM实验显示ABCG16在烟草细胞中发生同源二聚化;(D)FRET-FLIM实验显示ABCG16的半胱氨酸依赖性同源二聚化;(E)Co-IP实验显示ABCG16-GFP和ABCG16-HA存在体内相互作用;(F)FLIM图像和数据揭示了在二聚化缺陷双突变体ABCG16 C646A+687A中ABA转运受损,但在单突变体C646A和C687A中未见此现象。
小远叨叨
伯小远在本篇文章中主要列举了抗病蛋白、转录因子、受体激酶和转运蛋白的蛋白自寡聚化的文献,篇幅所限,还有其他类型蛋白的自寡聚化暂未列出,也希望我们的读者如果有合适的文献请分享给伯小远喔。
总结一下,这些研究蛋白寡聚化所涉及的实验有冷冻电镜、单分子荧光成像、FRET、Co-IP、BiFC、酵母双杂、GST pull-down和寡聚化界面突变实验等等。
另外,伯小远在查找文献时最想找的文献是既做了结构生物学证明发生寡聚化现象,又做了分子实验和表型实验证明寡聚化界面的突变会对植物表型产生影响,类似图2、图4和图10所示的文献案例,但这种文献实际占比较少,多数是只做分子实验和表型实验的文献,这很大可能在于做结构生物学所需的仪器和技术成本较高。寡聚化现象在植物中非常常见,但目前似乎其在植物调控机制研究和应用中都还不太广泛。
最后让我们的思想放飞一下,未来,是否可以通过人工设计蛋白寡聚体如重构光系统超级蛋白寡聚体、强化胁迫响应蛋白寡聚体等来应对更多的挑战呢。
References:
Bhatnagar A, Burman N, Sharma E, Tyagi A, Khurana P, Khurana JP (2023) Two splice forms of OsbZIP1, a homolog of AtHY5, function to regulate skotomorphogenesis and photomorphogenesis in rice. PLANT PHYSIOL 193: 426-447
Kim BH, Kim SY, Nam KH (2013) Assessing the diverse functions of BAK1 and its homologs in arabidopsis, beyond BR signaling and PTI responses. MOL CELLS 35: 7-16
Levy ED, Teichmann S (2013) Structural, evolutionary, and assembly principles of protein oligomerization. PROG MOL BIOL TRANSL 117: 25-51
Liang X, Zhou JM (2018) Receptor-Like Cytoplasmic Kinases: Central Players in Plant Receptor Kinase-Mediated Signaling. ANNU REV PLANT BIOL 69: 267-299
Liu T, Liu Z, Song C, Hu Y, Han Z, She J, Fan F, Wang J, Jin C, Chang J, Zhou JM, Chai J (2012) Chitin-induced dimerization activates a plant immune receptor. SCIENCE 336: 1160-1164
Ma S, An C, Lawson AW, Cao Y, Sun Y, Tan E, Pan J, Jirschitzka J, Kummel F, Mukhi N, Han Z, Feng S, Wu B, Schulze-Lefert P, Chai J (2024) Oligomerization-mediated autoinhibition and cofactor binding of a plant NLR. NATURE 632: 869-876
Mankun Sang MEJ (2024) Oligomerization of transcription factors increases binding probability and residence time on DNA. Biophysical Journal, p 502a
Puranik S, Acajjaoui S, Conn S, Costa L, Conn V, Vial A, Marcellin R, Melzer R, Brown E, Hart D, Theissen G, Silva CS, Parcy F, Dumas R, Nanao M, Zubieta C (2014) Structural basis for the oligomerization of the MADS domain transcription factor SEPALLATA3 in Arabidopsis. PLANT CELL 26: 3603-3615
Sayou C, Nanao MH, Jamin M, Pose D, Thevenon E, Gregoire L, Tichtinsky G, Denay G, Ott F, Peirats LM, Schmid M, Dumas R, Parcy F (2016) A SAM oligomerization domain shapes the genomic binding landscape of the LEAFY transcription factor. NAT COMMUN 7: 11222
Strader L, Weijers D, Wagner D (2022) Plant transcription factors - being in the right place with the right company. CURR OPIN PLANT BIOL 65: 102136
Wang J, Luo Y, Ye F, Ding ZJ, Zheng SJ, Qiao S, Wang Y, Guo J, Yang W, Su N (2024) Structures and ion transport mechanisms of plant high-affinity potassium transporters. MOL PLANT 17: 409-422
Wang X, Kota U, He K, Blackburn K, Li J, Goshe MB, Huber SC, Clouse SD (2008) Sequential transphosphorylation of the BRI1/BAK1 receptor kinase complex impacts early events in brassinosteroid signaling. DEV CELL 15: 220-235
Zhou Y, Wang Y, Zhang D, Liang J (2024) Endomembrane-biased dimerization of ABCG16 and ABCG25 transporters determines their substrate selectivity in ABA-regulated plant growth and stress responses. MOL PLANT 17: 478-495























 3183
3183

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








