引言
在国际市场运营中,药品生产与供应链合规性是企业关注的重点。为了符合全球GMP(药品生产质量管理规范)和GDP(药品分销质量管理规范)要求,企业需在经过确认的设施中进行药品的生产、储存与运输。本文梳理了确认与温度分布验证的基本概念,并总结了规范操作流程。
一、确认与验证的基本概念

**验证(Validation)**是对整个过程进行系统性检查,以确认其能够持续实现预期目标。例如,药品仓库需具备符合要求的物理设施、经培训的人员、合规的管理系统及适宜的设备。在进行验证之前,相关设施与设备需先完成确认。
**确认(Qualification)**则是针对设施或设备进行评估,以证明其符合预期用途。例如,仓库需在2至8℃的范围内稳定控制温度,确认过程通常包括:
-
安装确认(IQ):验证设备是否正确安装;
-
运行确认(OQ):测试设备在不同运行条件下的稳定性;
-
性能确认(PQ):在实际操作环境下评估设备性能;
-
再确认(Requalification):定期评估设备是否持续符合标准。
二、确认流程与行业通用方法
虽然法规对确认文件的具体结构并无统一规定,行业普遍遵循GxP原则,并通过风险分析与文档记录来规范流程。常见的方法包括采用V模型,覆盖以下阶段:
-
用户需求规格(URS):明确设备的功能需求,如温度控制范围;
-
风险分析:识别影响设备性能的潜在因素,如电力故障、空气流通等;
-
设计确认(DQ):验证选购设备符合既定需求;
-
运行确认(OQ)与性能确认(PQ):测试设备在空载与满载条件下的运行表现。
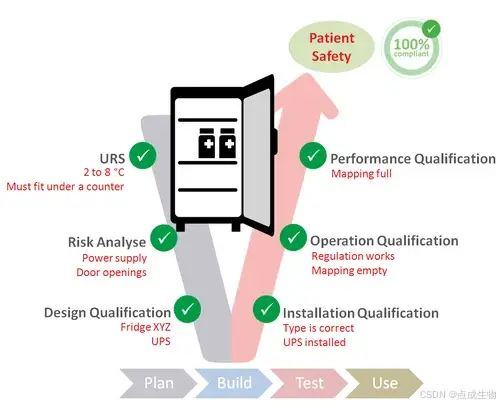
企业通常结合法规要求与具体业务需求,构建标准化的确认体系,以提高设备管理水平。
三、温度分布验证:确保存储环境符合标准
**温度分布验证(Temperature Mapping)**是确认流程的一部分,旨在记录储存环境内不同位置的温度变化,识别最热点与最冷点。根据世界卫生组织(WHO)指南,温度分布验证需遵循以下原则:
-
在x、y、z轴方向均匀布置温度传感器;
-
在潜在的热点和冷点(如门口、出风口附近)额外布置传感器。
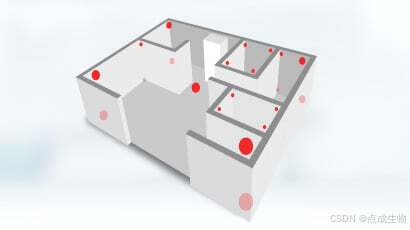
验证工作通常需覆盖不同季节及日夜温差带来的影响。当所有测量点的温度稳定在规定范围内,温度分布验证可视为完成。随后,可在关键位置部署持续监测设备,以进一步保障储存环境的合规性。此外,通过引入数据分析工具进行趋势监测,有助于实现温度环境的动态管理。
四、设备群组确认方法
针对标准化设备,如冰箱、培养箱等,部分企业采用**设备群组确认(Grouping Qualification)**方法以提高效率。具体流程包括:
-
根据供应商、型号、尺寸等标准将设备分组;
-
在每个设备群组中选择一台进行完整的温度分布验证;
-
其余同组设备可进行性能确认(PQ)。
此方法在行业内被广泛应用,有助于在保证合规要求的前提下,合理配置验证资源。
五、总结
设施确认与温度分布验证是保障药品供应链符合GMP/GDP标准的重要环节。通过遵循规范流程、结合风险管理方法,以及合理引入数据分析手段,企业能够提升设施管理的系统性与可靠性,支持全球药品供应链的稳定运行。

























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








