赛隆釉的开发以提高植入式医疗器械的成骨传导性
摘要
通常通过对骨科器械应用生物活性涂层来弥补医疗器械本身生物惰性的不足,并改善其骨整合性能。目前市场上已有磷酸钙、羟基磷灰石(HAp)和生物玻璃用于此目的。直到最近,才极少发现其他具有类似生物功能的无机化合物。然而,氮化硅(Si3N4)作为一种新型骨科材料崭露头角,其独特的表面化学成分可增强成骨传导性。最新研究证实,其次要晶间相——硅钇铝氧氮化物(SiYAlON)——正是实现这一改善的主要原因。因此,人们提出假设:SiYAlON本身或可作为医用器械有效的成骨传导性涂层或釉层。
为验证该假设,开发了一种受传统陶瓷器釉工艺启发的工艺方法。该工艺采用含有与SiYAlON相似组成的玻璃熔块,在Si3N4表面涂覆了晶间硅铝氧氮成分,并通过热处理形成釉层。采用多种分析工具对其化学成分和形貌进行了表征。结果表明,该釉层主要由Y5Si3O12N组成,这种化合物通常被称为氮化磷灰石,与天然HAp同构。将上釉表面暴露于无细胞模拟体液后,促进了仿生HAp样晶体的沉积;而在体外暴露于Saos‐2成骨肉瘤细胞时,其HAp沉积量较对照样品更高。观察发现硅铝氧氮具有增强的成骨传导性,预示其在骨与组织修复中作为治疗辅助手段的潜力。V C 2017威利期刊公司。生物医学材料研究杂志B部分:应用生物材料 00B:000–000,2017。
引言
除了恢复身体功能外,每个人工医疗装置的目标都是实现与肌肉骨骼组织的牢固且永久性结合。这对于大型承重植入物尤为重要,例如脊柱关节融合装置以及全髋或全膝关节置换系统。在过去50年中,植入物设计和生物材料取得了显著进展,包括开发含有生物活性成分(如磷酸钙(CaP)、合成羟基磷灰石(HAp)和生物玻璃)的涂层和复合材料。然而,尽管这些努力具有重要价值,无菌性松动仍然是导致翻修手术的主要原因,需要移除固定不良的植入物。
显然,仍需要开发新型材料以改善生物医学装置的骨整合。然而,除了基于磷酸钙的陶瓷和生物活性玻璃之外,很少有无机材料具有类似的生物功能。
这份列表中相对较新的成员是氮化硅(Si3N4),一种适用于骨科应用的非氧化物材料。它被制备成两相复合材料,由相互锁合的各向异性Si 3 N 4 晶粒组成,晶粒之间由一层连续的薄的硅钇铝氧氮化物(SiYAlON)晶间相(IGP)分隔。致密的整体式Si 3 N 4 表现出优异的耐磨性、抗弯强度和断裂韧性的组合。然而,Si 3 N 4 也可制成高度多孔结构,非常适合用于骨支架。
关节融合装置。16–18它具有生物相容性,19–25部分透射线, 10,27与骨结合良好,6,28,29与聚醚醚酮(PEEK)和钛相比,对细菌定植具有内在抗性。30–32 28,31Si3N4首次于1986年在澳大利亚的一项小型临床试验中用作脊柱植入物。23自2008年以来,已常规用于脊柱融合Cage,至今已有>30,000例植入,且报道的不良事件较少。33
先前的研究表明,通过化学蚀刻处理和可控气氛退火循环,可以调节Si3N4表面BSiAOH和BSiANH2官能团的浓度。这些处理方法能够破坏Si2N2O本征钝化层,要么将其剥离以暴露底层的Si3N4晶粒(例如通过氢氟酸蚀刻),要么进一步氧化形成非晶态SiO2层(例如通过空气中退火)。通过这种方式调控Si3N4表面,显著影响了相关生物材料性能,如亲水性和表面电荷。此外还发现,在氮气氛围中退火时,Si3N4中少量存在的SiYAlONIGP会从陶瓷中析出,并在其表面形成微小的离散岛状结构,实际上形成了一层部分釉层。令人意外的是,这种间断性釉层的存在使表面呈现出超亲水行为(即静态水)接触角<108,并且在生理pH值下具有稳定的净负表面电荷。34随后的体外研究使用Saos‐2成骨肉瘤细胞评估了该表面的成骨传导性潜力,结果表明,在离散的SiYAlON析出物上,细胞密度和类骨质矿化均达到最大值。此外,当通过从培养基中去除抗坏血酸而抑制类骨质矿化时,仍可观察到细胞在这些SiYAlON岛上的优先聚集。6鉴于这些结果,人们假设SiYAlON釉料本身可能是一种潜在的新型生物活性玻璃。进一步推测,将SiYAlON用作可植入生物材料的涂层或釉层,可能会增强真核细胞响应性并改善骨整合。
因此,本研究的主要目标有两个:(1)证明SiYAlON釉料可应用于可植入生物材料表面;(2)从形貌、化学成分及增强的骨传导性潜力方面对釉层进行表征。为实现第一个目标,开发了一种受传统陶瓷器釉工艺启发的方法。为简化实验,选择Si3N4作为可植入生物材料。将含有SiYAlON组分(以熔块形式)的水性浆料涂覆于该Si3N4基底上,随后烧制形成釉层。然后利用多种显微与光谱技术对釉层进行了全面表征。随后通过两种体外方法评估其增强骨传导性的潜力。首先,采用体外无细胞ISO协议测定釉层对磷灰石形成和沉积的亲和性。35其次,采用先前验证过的程序考察Saos‐2骨肉瘤细胞的细胞吸附、增殖、类骨质沉积以及羟基磷灰石形成情况。29
材料与方法
SiYAlON釉料制备
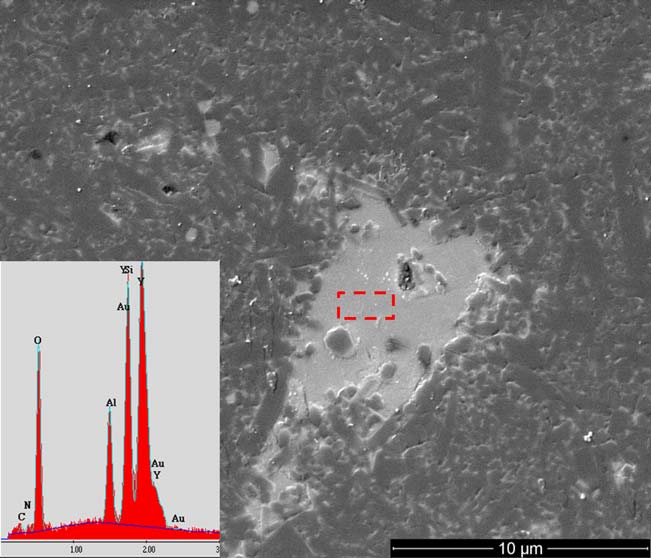
所选的SiYAlON釉层组成是通过对图1所示Si3N4部件抛光截面上填充玻璃的缺陷进行能谱分析(EDS)实验确定的,具体元素比例见表I。该部件按照其他地方描述的标准制造工艺制备。36在确定组成后,通过将二氧化硅(SiO2, 0.5 mm,阿尔法埃萨尔,沃德希尔,马萨诸塞州)、氧化钇(Y2O3, C级,H.C.斯塔克,慕尼黑,德国)、氮化铝(AlN,C级,H.C.斯塔克,慕尼黑,德国)、θ‐氧化铝(u‐Al2O 3, APA‐0.2,萨索尔,休斯顿,得克萨斯州)和Si3N4(宇部SN‐E10,宇部市,日本)在去离子水中混合制备玻璃熔块。
表I. 硅铝氧氮釉料浆料的设计元素与分子组成
| 元素 | IGP 组成(原子%) | 硅铝氧氮浆料(原子%) | 化合物 | 硅铝氧氮浆料(摩尔%) |
|---|---|---|---|---|
| Si | 20.81% | 15.6% | SiO2 | 48.8% |
| Y | 20.81% | 15.6% | Y2O3 | 28.0% |
| Al | 9.50% | 7.1% | AlN | 16.0% |
| O | 44.34% | 54.6% | Al2O3 | 4.8% |
| N | 4.52% | 7.1% | Si3N4 | 2.4% |
IGP通过能谱分析(EDS)测得的元素组成已包含在内用于比较。
水占5体积%(vol%)的固含量。柠檬酸( Sigma‐AldrichCorp.,St.Louis,MO)用作分散剂,添加量为固含量的1重量%(wt%),并加入足够量的氢氧化铵(Sigma‐AldrichCorp.,St.Louis,MO)以将浆料pH值调至10。将浆料置于聚丙烯罐中,在实验室球磨机(U.S.Stoneware,EastPalestine,OH)上滚动研磨约18小时,使用Si3N4研磨介质(直径5mm的球体,St.GobainNorthAmerica,Malvern,PA),以促进混合和软团聚体的破碎。研磨后,将浆料稀释至0.25vol%的固含量,并加入碳酸氢铵(NH4HCO3,,Sigma‐AldrichCorp.,St.Louis,MO),浓度为0.1mol/L水,以促进干燥过程中的颗粒重排。37最后,在用于施釉前,将稀释后的浆料在球磨机上滚动至少2小时以达到平衡。
然后采用浸涂技术将稀释的硅铝氧氮浆料涂覆到Si3N4生物材料圆片(Ø12.733mm2)上。圆片的加工符合标准的商业制造方法。36圆片以“未处理”(AFSN)状态使用,即未经过任何致密化后的机械加工操作。每个圆片通过不锈钢镊子夹住边缘,浸入浆料中,然后缓慢提拉出来进行涂覆。每个涂覆后的圆片随后被放入一个丙烯酸干燥柜(TedPella,雷丁,CA)中,柜内装有吸湿介质(IndicatingDrierite,W.A.HammondDRIERITE公司,Xenia,OH),干燥至少2小时。初始干燥后,样品被放入干燥箱(Binder,博米亚,纽约)中,在90°C下保持至少2小时,以进一步促进干燥以及NH4HCO3添加剂的分解。在此加热干燥步骤之后,浆料涂覆的样品被放入批式炉(型号121224,CentorrVacuumIndustries,纳舒厄,新罕布什尔州)中,抽真空至250mTorr,然后用过滤的N2(1–2psi)回充,随后加热至1400°C,保温30分钟,形成烧制釉层。34
SiYAlON釉层表征
扫描电子显微镜(SEM)和能谱分析(EDS)
使用场发射枪扫描电子显微镜(FEG‐SEM,Quanta,FEI,Hillsboro,OR)进行SEM检测。所有样品均通过溅射镀膜方式覆盖一层薄的金(20–30Å)(108auto,Cressington,Watford,UK)或金钯合金(Model682PrecisionEtchingCoatingSystem,Gatan,Pleasanton,CA)。通常在加速电压为10kV、工作距离为7–10mm、束斑尺寸为4.5mm的条件下对样品进行成像。同时使用连接到SEM的光谱仪(EDAX,Mahwah,NJ)在成像过程中进行EDS分析。采用商业软件(EDAXGenesis,EDAX,Mahwah,NJ)对能谱进行定量成分分析,该软件应用了原子序数、吸收和荧光的矩阵校正(ZAF矩阵校正)。
X射线光电子能谱(XPS)
使用了光谱仪(AxisUltra,克瑞托斯,曼彻斯特,英国)与铝Kα单色X射线源。使用160电子伏特的通过能量进行低分辨率光谱扫描,成分分辨率为0.1原子百分比(原子%)。对目标峰附近的高分辨率扫描使用40电子伏特的通过能量,预计可将成分分辨率提高至约0.01原子%。分析区域设定为700×300μm2,以平均多相表面的成分不均匀性。所获得的数据采用商用软件(CasaXPS,Casa软件,英国)进行处理。通过使用低能电子源,并在样品与夹具之间的接触点涂抹超高真空级胶体银(TedPella,雷丁,CA),减轻了荷电效应。所有报告数据均在氩溅射后获得,以去除吸附的表面污染物,溅射条件为:束流能量4.2千电子伏特,枪角相对于样品为45°,扫描面积为3×3mm2,,样品电流为2 μA。
X射线衍射(XRD)
使用X射线衍射仪(帕纳科X’PertMPD,飞利浦,阿尔梅勒,荷兰)对样品进行检测,仪器和程序设置如下:电压:45千伏,电流:40毫安,发散狭缝:1=2度,防散射狭缝:1=4度,接收狭缝:1/8度,扫描范围:20–7082h,步长:0.0158,速率为每步1.5秒。采用商用软件(X’PertHighscorePlus,飞利浦,阿尔梅勒,荷兰)对样品进行分析。原始数据首先经过处理,包括搜索峰和确定背景。然后在施加元素数据库限制后,将得到的图谱与ICCD/ICSD数据库中的参考图谱进行匹配。数据库搜索提供了一份带有匹配分数的参考图谱列表,该分数表示每张图谱与实验谱中峰强度和峰位置的重叠程度。相的匹配基于软件的评分、参考图谱质量以及定性分析。
拉曼光谱
采用共焦(光学)显微探针在室温下对无机样品进行拉曼光谱测量,所用设备为配备氮气冷却1024×256像素CCD相机(CCD‐3500V,堀场有限公司,日本京都)的单色仪(T‐64000,约宾‐约文/堀场集团,日本京都),并使用商用软件(LabSpec,堀场/约宾‐约文,日本京都)进行分析。实验中使用的激发频率为工作功率100毫瓦的氩离子激光器的532纳米蓝光。光谱积分时间通常为30秒,对三次连续测量记录的光谱取平均值。所有实验均采用共焦构型的拉曼探针,并使用100倍物镜以排除来自探针离焦区域散射的光子。在整个测量过程中,采集氦氖灯信号作为拉曼峰位置的内标。拉曼带参数通过洛伦兹曲线对原始实验光谱进行拟合获得。另外一组针对活细胞的拉曼实验采用了不同的拉曼设备和模式进行,将在下一小节中结合细胞培养的说明进行描述。
成骨传导性测试
在模拟体液(SBF)中的浸泡
采用一种体外ISO方案来评估SiYAlON釉层在其表面诱导HAp沉淀的潜力。Kokubo及其同事证明,按照该方案将潜在生物材料浸入SBF中,可预测其骨传导性行为。具体而言,在体外通过表面电荷引发机制诱导仿生羟基磷灰石从SBF中沉淀的材料,通常也在体内表现出骨传导性和潜在的骨诱导性。本研究中,SBF根据已建立的配方(即m‐SBF)配制,其离子组成与人血浆相近。配制好的SBF在58°C下储存过夜,并在24小时内用于实验。样品大致水平放置于聚丙烯管(50mL,CentriStar,康宁生命科学,康宁,纽约)的锥形底部,管口用橡胶隔垫(自密封,24/40,AceGlass,文兰,新泽西州)密封。SBF通过可变流量蠕动泵(ControlCompany,弗兰德伍德,得克萨斯州)经硅胶管(内径0.2500)和在线过滤器(0.2μm,PolycapTC,沃特曼,白金汉郡,英国)由针头(18号针头,Nokor,BD公司,富兰克林湖,新泽西州)注入每根试管中。使用该过滤器旨在对SBF进行灭菌,并最大限度减少溶液中可能作为异相成核位点的微小颗粒。制备好的样品随后置于水浴槽(W‐10,Anova,斯塔福德,得克萨斯州)内的试管架上,水浴温度通过数字温控器维持在36.5±0.15°C,以符合既定程序。实验过程中样品表面朝下放置,以防止分散相沉淀物沉降在观察表面上而影响结果。经过28天在加热水浴中的浸泡后,取出试管并回收样品。随后将样品依次在三份去离子水中冲洗,以尽量减少残留SBF离子在干燥过程中导致样品表面发生额外的沉淀反应。回收后,样品被放入含有吸湿介质的干燥柜中至少24小时,然后进行表征。另设两组对照样品,其几何形状与测试样品相同,同样经历SBF浸泡试验。这些对照片包括未处理(AFSN)和氮气退火(N2ASN)的Si3N4,选择它们是因为此前已证实其能通过活体Saos‐2成骨肉瘤细胞表现出增强的骨传导性能。所有样品在非测试状态下均存放于干燥柜中,以避免意外的表面污染。
骨肉瘤细胞测试
Saos‐2细胞系的细胞在成骨培养基中培养,该培养基由4.5g/L葡萄糖DMEM(D‐葡萄糖,L‐谷氨酰胺,酚红和丙酮酸钠)和10%胎牛血清组成,并使其在37°C下孵育约24小时,使Saos‐2最终浓度达到5 3 105个细胞/mL。将培养的细胞接种到先前经过紫外线灭菌处理的样品表面,使用成骨培养基,该培养基由DMEM培养基添加50μg/mL抗坏血酸、10mMβ‐甘油磷酸钠、100mM氢化可的松和10%胎牛犊血清组成。接种后的样品在37°C下孵育7天,期间更换培养基两次。孵育结束后,使用激光拉曼显微镜(RAMANtouch,Nanophoton,大阪,日本)配备20倍浸没式物镜和532纳米波长激光源生成拉曼成像图谱。每个像素尺寸为1.02×1.02微米,每幅图像由171行水平扫描、每行400像素构成。分析类骨质形成和矿化时选取光谱中的两个区域:一是位于965±12.5cm21,53,54处与PO23 4四面体中P‐O伸缩振动相关的主要谱带,二是位于2939.5±42.6cm21处反映胶原蛋白中C‐H键伸缩振动的谱带。53,54当两者叠加时,这些图谱可显示胶原蛋白(骨肉瘤细胞外聚合物(ECP)的主要成分)55的沉积情况以及沉积在胶原基质上的羟基磷灰石(HAp)的量,从而实现对骨肉瘤细胞增殖和沉积磷灰石体积的定性与定量比较。需要注意的是,活细胞实验所用光谱仪支持超快速成像,拉曼图谱采集速度比细胞运动更快。仪器配套软件可自动提供选定区域的平均光谱。不同表面活性活细胞的拉曼光谱通过每一样品取103次测量的平均值进行比较。实验结束后,从每种条件下取出一个样品,移出成骨培养基,并用于荧光显微镜观察:先用磷酸盐缓冲液(PBS)冲洗两次,再用4%甲醛在室温下固定并孵育15分钟,再次用PBS冲洗两次,然后加入以PBS稀释至1%的小鼠抗人抗体(骨钙素;克隆2H9F11F8,同型IgG2a,伯乐,日本),在室温下孵育30分钟,再次用PBS冲洗两次,接着加入混合染色液(包含以PBS配制的1%Hoechst33342染料(kex5 352 nm,kem5 461 nm,同仁化学,日本)和以PBS配制的1%山羊抗小鼠IgG‐FITC偶联抗体(kex5 490 nm,kem5 520 nm,伯乐,日本)),避光室温孵育30分钟,最后再用PBS冲洗两次。染色后的样品使用荧光显微镜(BZ‐X700,基恩士,日本)成像。获得的荧光显微照片采用商用软件(Fiji,Fiji贡献者)进行分析。56,57根据每一样品的代表性图像计算两种荧光团的积分强度。另取每种条件下的一个样品,用PBS冲洗、干燥后,按照“SiYAlON釉层表征”部分所述方法进行扫描电镜(SEM)观察。
结果
SiYAlON釉层表征
图2的扫描电镜图像显示了涂覆赛亚隆浆料并在烧制前后Si 3 N 4样品表面的情况。
 1400°C、1–2 psi N2气氛下退火前;(b) 退火30分钟后。图(a)中标注了二氧化硅(暗色球体)、氧化钇(浅色片状物)和氮化铝(浅色棒状物)颗粒以及暴露的Si3N4基底晶粒。)
1400°C、1–2 psi N2气氛下退火前;(b) 退火30分钟后。图(a)中标注了二氧化硅(暗色球体)、氧化钇(浅色片状物)和氮化铝(浅色棒状物)颗粒以及暴露的Si3N4基底晶粒。)
图2(a)显示了浸涂并干燥后的浆料颗粒覆盖情况。在背散射成像下,图像中明暗对比的区域表明其具有多相性质。混合分布的SiO2球体、Y2O3片状颗粒和AlN针状颗粒均清晰可见。较不明显的是u‐Al2O3和Si3N4颗粒,它们在硅铝氧氮浆料中的浓度远低于其他组分。图2(b)展示了该样品在釉层热处理后的形貌。所得釉层表面覆盖均匀,但高度纹理化且不连续。观察到液相形成的迹象,可能是两种或多种组分之间形成低熔点共晶所致,同时还观察到起泡现象。釉层表现出细小(100 nm至1μm)的开孔孔隙,并且平均原子量较高(基于背散射电子强度的增加),高于Si3N4基底。釉层内部背散射图像对比度较低,也表明在热处理周期中组分颗粒发生了显著的迁移、混合和反应。
表II. 通过X射线光电子能谱(XPS)测得的未进一步处理的原始表面、在1–2 psi氮气中于1400°C暴露30分钟后表面,以及经0.25 vol% SiYAlON浆料浸涂并在1–2 psi氮气中随后于1400°C暴露30分钟后的表面元素组成
| 元素 | 未处理 (AFSN) | N2‐退火 (N2 ASN) | SiYAlON 釉层 |
|---|---|---|---|
| Si | 38.9% | 36.4% | 28.1% |
| Y | 0.1% | 2.3% | 10.9% |
| Al | 2.3% | 5.7% | 3.4% |
| O | 19.4% | 18.5% | 33.1% |
| N | 39.3% | 37.1% | 24.6% |
碳(所有样品中占4–10%)被去除,以便直接比较其他组分。Si3N4材料的理论整体成分已包含以供参考。
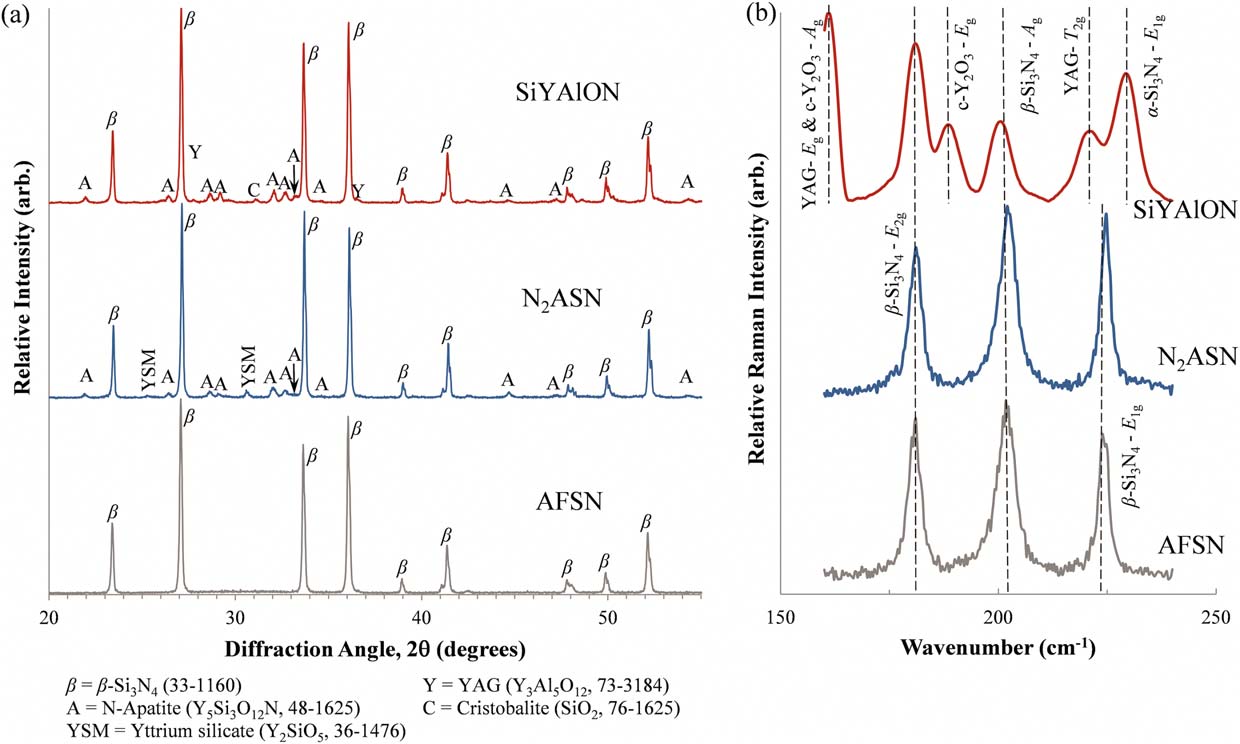
图3(a)显示了AFSN和N2ASN对照样品以及SiYAlON釉层样品在208至5582h范围内获得的XRD谱图叠加结果。三种样品的图谱在衍射角>558处基本相同,仅显示出与β‐Si3N4一致的峰(依据JCPDS33–1160)。在AFSNSi3N4对照中不存在的峰(即推测为釉层成分所致)被识别出来,并与主要相六方氮化磷灰石(Y5Si3O12N,JCPDS48–1625)和次要相匹配单斜硅酸钇(Y2SiO5, JCPDS36–1476)相出现在N2ASN对照样品表面。在SiYAlON釉层中,氮化磷灰石是主要相,同时含有少量钇铝石榴石(YAG,JCPDS73–3184)以及可能残余的以方石英形式存在的SiO2(JCPDS76–1625)。在所有三种图谱中均出现一个额外的未识别峰,位于42.582h处,具有相似的形状和强度。
图3(b)显示了在150–250cm21范围内采集的不同Si3N4样品表面的拉曼光谱。对照样品的光谱非常相似,且在186, 210,和224cm21处解卷积为三个谱带。拉曼分析中最显著的特征是,SiYAlON釉层样品除了在160、188、221和229cm21处出现谱带外,还在186和210cm21处表现出类似的谱带。
模拟体液浸泡
图4(a–c)分别展示了AFSN、N2ASN对照样品以及SiYAlON釉料在暴露于模拟体液之前的代表性显微照片。
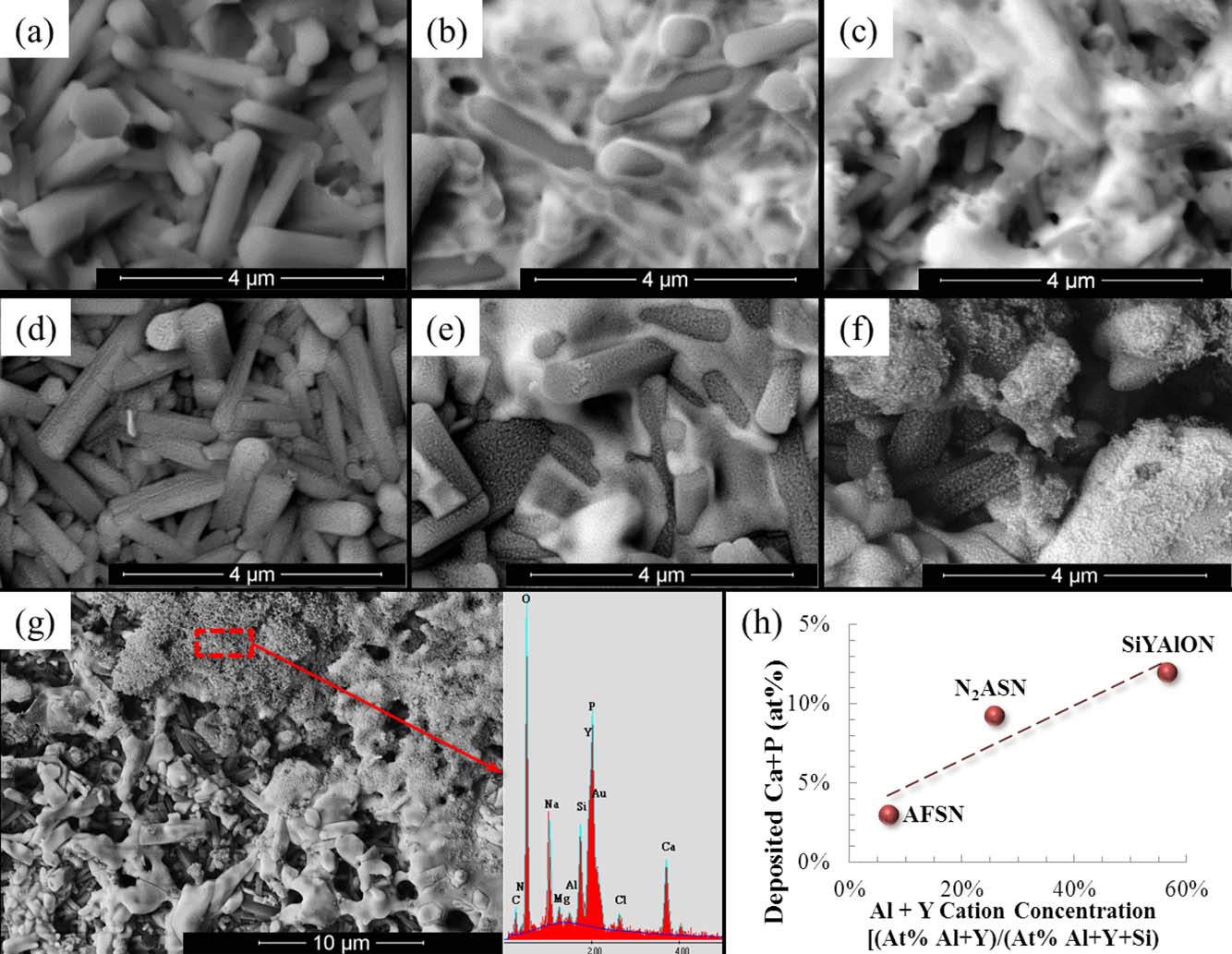
这些相同的样品在模拟体液中暴露后,分别在图4(d–f)中再次显示。对于AFSN和N2ASN对照样品,在晶粒表面观察到一层细小的沉积层。然而,对于SiYAlON釉层样品,明显可见更厚的沉积区域。此外,如图4(g)所示,在SiYAlON釉层表面还沉积了富含仿生羟基磷灰石组分的较大富集区域。通过使用SBF浸泡实验前后获得的XPS数据,图4(h)中的图表将浸泡后表面钙和磷的浓度与浸泡前基底表面铝和钇相对于所有阳离子的浓度(作为硅铝氧氮表面覆盖率的替代指标)进行了关联。简单的线性插值表明,钙和磷的沉积量与硅铝氧氮表面覆盖率成正比。
体外骨肉瘤细胞暴露
图5(a–c)提供了在成骨培养基中与Saos‐2细胞培养共培养7天后,处理过的Si3N4表面的拉曼成像图谱。其中,HAp的PO3–4四面体中P‐O伸缩振动的主要谱带(.cm)以红色显示强度对比,胶原蛋白中C‐H伸缩振动的主要谱带(2939.56cm21)以绿色显示强度对比。在这些图像中,AFSN[图5(a)]和N2ASN[图5(b)]样品显示出相似的胶原蛋白和HAp覆盖情况。然而,SiYAlON釉层样品[图5(c)]相较于两个对照组表现出明显更高的表面覆盖率和更多的HAp沉积。图5(d)展示了对每个样品各自的拉曼成像图谱进行平均后得到的拉曼光谱。
在PO3–4四面体的P‐O伸缩振动峰附近。在965±12.5cm21,范围内定义的峰面积与采样体积内的羟基磷灰石体积成正比。图5(e)中绘制了各样品的平均峰面积(相对于AFSN样品归一化)随表面钇和铝的原子百分比(也通过XPS归一化为总表面阳离子浓度)的变化关系。该图近似反映了沉积的羟基磷灰石体积与表面硅铝氧氮覆盖率之间的关系。明显的趋势表明,随着硅铝氧氮表面覆盖率的增加,羟基磷灰石的沉积量也随之增加。
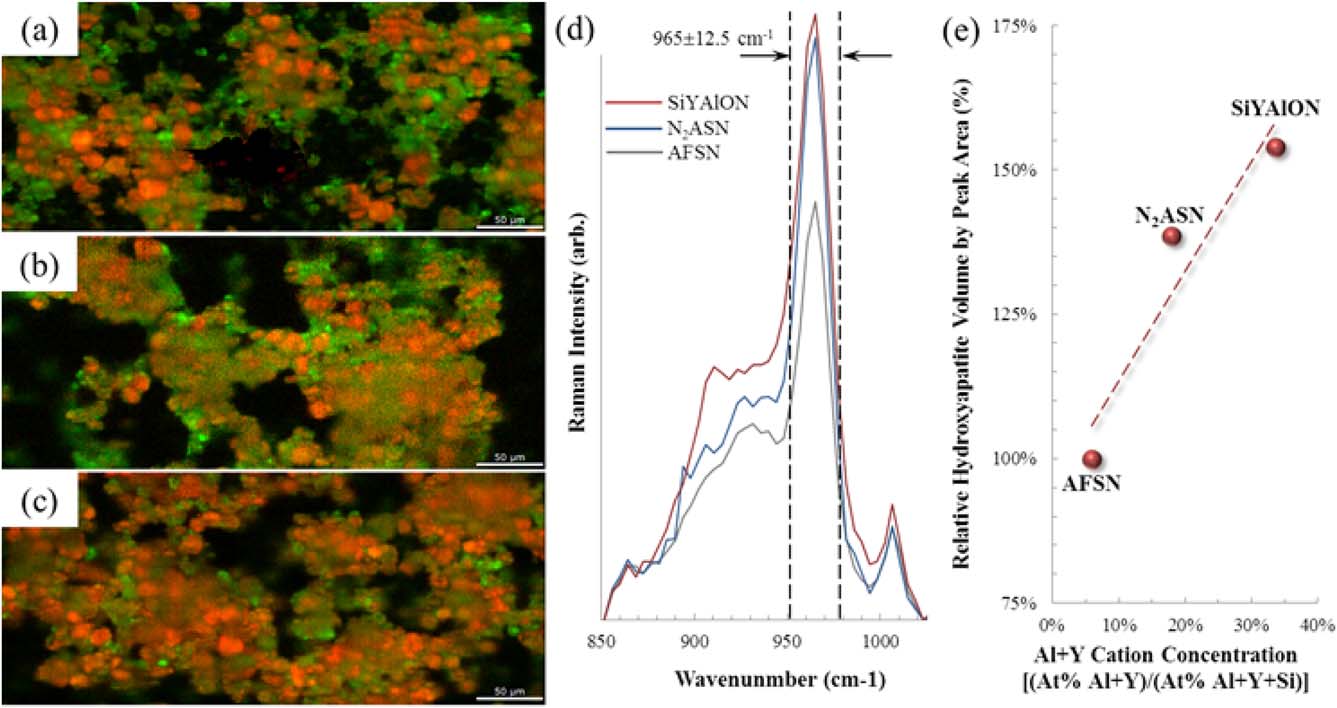 AFSN、(b) N2ASN 和 (c) SiYAlON釉层样品后,羟基磷灰石(红色标度,拉曼位移 965 ± 12.5 cm21)和胶原蛋白(绿色标度,拉曼位移 2939.5 ± 42.6 cm21)的代表性表面覆盖率。(d) 平均拉曼光谱(在 965 ± 12.5 cm21 区域内),以及 (e) 以AFSN样品的值为基准归一化的 965 ± 12.5 cm21, 处曲线下面积,作为通过XPS测得的Al+Y表面阳离子浓度(相对于总阳离子浓度归一化)的函数。)
AFSN、(b) N2ASN 和 (c) SiYAlON釉层样品后,羟基磷灰石(红色标度,拉曼位移 965 ± 12.5 cm21)和胶原蛋白(绿色标度,拉曼位移 2939.5 ± 42.6 cm21)的代表性表面覆盖率。(d) 平均拉曼光谱(在 965 ± 12.5 cm21 区域内),以及 (e) 以AFSN样品的值为基准归一化的 965 ± 12.5 cm21, 处曲线下面积,作为通过XPS测得的Al+Y表面阳离子浓度(相对于总阳离子浓度归一化)的函数。)
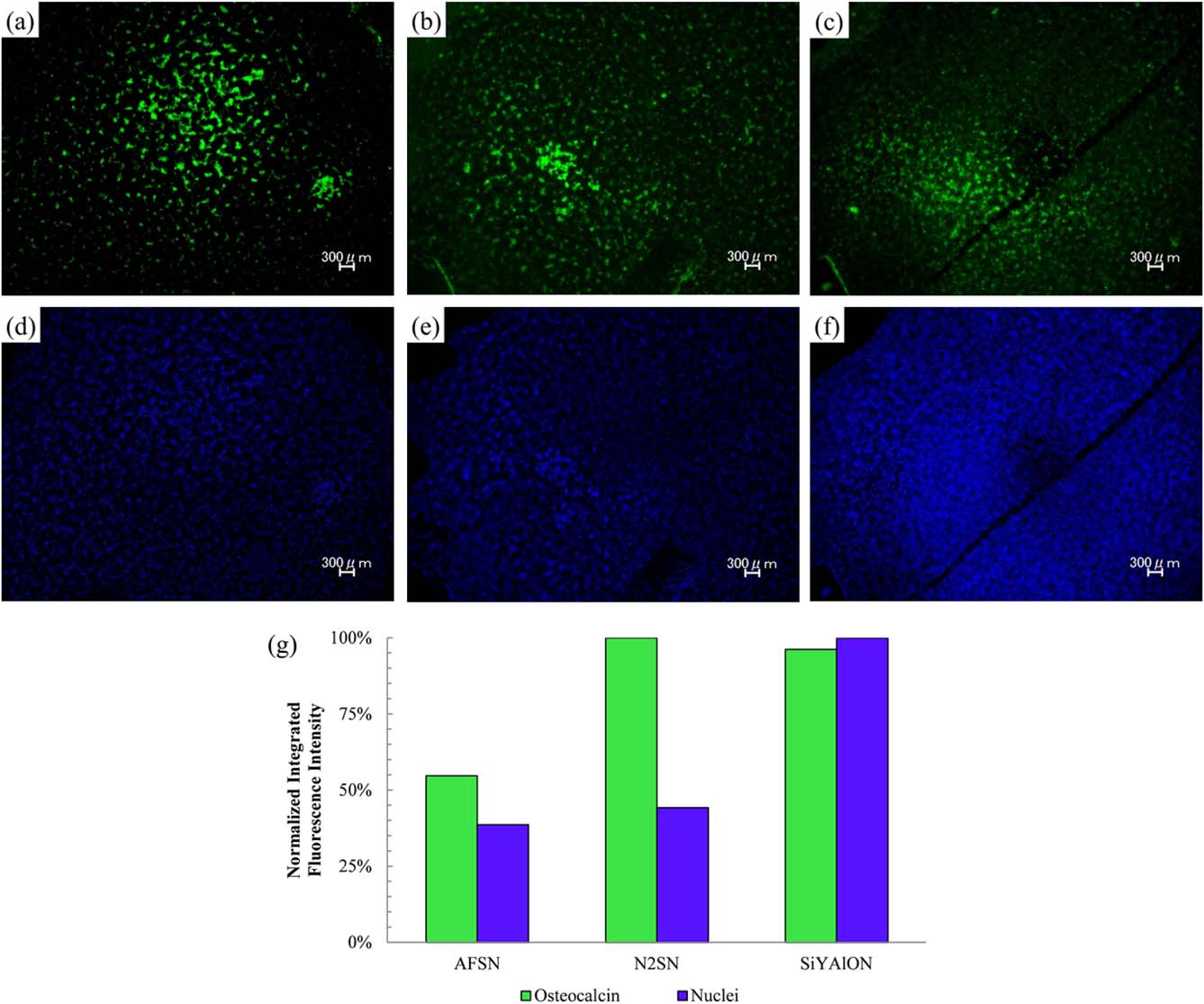 AFSN、(b) N2 ASN 和 (c) SiYAlON 表面与骨钙素结合的抗体在520 nm的发射光。荧光显微图像显示在7天骨肉瘤细胞培养暴露后,(d) AFSN、(e) N2 ASN 和 (f) SiYAlON 表面细胞核中的DNA在461 nm的发射光。(g) 各样品中骨钙素以及细胞核中脱氧核糖核酸的归一化积分荧光强度。)
AFSN、(b) N2 ASN 和 (c) SiYAlON 表面与骨钙素结合的抗体在520 nm的发射光。荧光显微图像显示在7天骨肉瘤细胞培养暴露后,(d) AFSN、(e) N2 ASN 和 (f) SiYAlON 表面细胞核中的DNA在461 nm的发射光。(g) 各样品中骨钙素以及细胞核中脱氧核糖核酸的归一化积分荧光强度。)
图6显示了荧光显微图像,在低倍率下捕捉到与骨钙素相关的520nm发射光,(a)AFSN、(b)N2SN和(c)SiYAlON,以及与骨肉瘤细胞核内脱氧核糖核酸相关的461nm发射光,(d)AFSN、(e)N2SN和(f)SiYAlON。图6(g)是一个图表,展示了每种荧光团在其各自发射波长下的发射强度,该强度通过对每个样品相应图像进行积分,并以样品组中最大的积分强度进行归一化。两种处理后的样品均显示出骨钙素水平大约增加两倍。退火样品的细胞核密度略有增加,而SiYAlON釉涂层样品相对于未退火样品的细胞核密度增加超过两倍。
 AFSN、(b) N2ASN 和 (c) SiYAlON 表面的低倍背散射扫描电镜图像。骨肉瘤细胞培养暴露7天后,(d) AFSN、(e) N2ASN 和 (f) SiYAlON 表面矿化结节的高倍图像及其EDS谱插图。)
AFSN、(b) N2ASN 和 (c) SiYAlON 表面的低倍背散射扫描电镜图像。骨肉瘤细胞培养暴露7天后,(d) AFSN、(e) N2ASN 和 (f) SiYAlON 表面矿化结节的高倍图像及其EDS谱插图。)
图7显示了AFSN、N2SN和SiYAlON在骨肉瘤暴露后(a, b和c)低倍率和(d, e和f)高倍率下的背散射扫描电镜图像。低倍率图像显示了表面被胞外聚合物覆盖的程度以及矿化结节簇的分布。高倍率图像显示了矿化结节簇的细节。EDS谱作为插图嵌入高倍率图像中,以显示矿化结节的定性原子组成,这些组成与天然HAp和胞外聚合物的混合物一致。
讨论
SiYAlON釉层表征
有人假设,可以通过上釉的方法在Si3N4表面涂覆一层成分类似于IGP的薄层材料。这一设想通过将含有接近IGP成分的亚微米颗粒的稀浆料涂覆于材料表面,随后进行热处理得以验证。从图2(a)可以看出,浆料分散较为均匀,且在干燥过程中各组分的混合状态得以保持。经过热处理后,明显发生了组分之间以及组分与基底之间的反应,同时伴有一定程度的熔融和起泡现象。需要注意的是,釉层内部存在的大量孔隙可能有利于增强通过增加介质与样品表面之间电荷介导和/或溶解相互作用的有效表面积,促进骨整合。SiYAlON釉层的表面成分(参见表II)相较于理论体相、AFSN以及N2ASN对照样品,显示出钇和氧的含量显著增加。这表明有更多的底层Si3N4基底被SiYAlON混合物覆盖。表面铝浓度未出现显著变化,因为其在原始材料中已达到3 at%,而SiYAlON釉层本身也含有相似的铝浓度。SiYAlON釉层与N2ASN对照样品之间的另一个关键差异是氮氧比(即N:O),N2ASN样品为2:1,而SiYAlON釉层样品为2:1.5,说明相对于N2ASN样品,SiYAlON釉层样品上的SiYAlON覆盖程度更高。
图3(a)中的XRD数据显示了外涂SiYAlON釉层与N2ASN表面SiYAlON岛在相组成上的进一步差异。在N2ASN情况下,主要相为被鉴定为氮磷灰石(Y5Si3O12N),并含有少量单斜硅酸钇(Y2SiO5)相。在SiYAlON釉层的谱图中,氮磷灰石同样作为主要相存在。然而,与少量钇硅酸盐组分不同,SiYAlON釉层中的次要组分为钇铝石榴石(YAG, Y3Al5O12)和方石英(SiO2)。这些相由原始浆料组分(Y2O3, SiO2, Al2O3, Si3N4,和AlN)形成并不意外,表明尽管SiYAlON釉层在成分上与IGP相似,但并非完全复制。此外,SiYAlON混合物仅在1400°C下处理,显著低于IGP初始形成的17008°C。除了表面覆盖率的差异外,这些相的存在也解释了N2ASN与SiYAlON样品之间氮氧比(N:O)的差异。由于在所有三个样品谱图中,42.582h处的未识别次要峰均表现出相似的形状和强度,因此推测其对应于基底组分。
拉曼光谱分析进一步证实了SiYAlON釉层的多相特性。在图3(b)中,所有样品的拉曼光谱在180.1、201.4和224.5cm21处出现的三个谱带分别对应于β‐Si3N4晶体中骨架SiAN键的E2g、Ag和E1g振动模式。59,60对于SiYAlON样品,E1g谱带可能存在于221和229cm21附近的谱带中但被掩盖。此外,该样品的光谱中还出现了161和188cm21处的两个额外谱带。161和221cm21处的谱带分别对应于YAG61–63的Eg和T2g谱带,而188cm21处的谱带可能对应于立方氧化钇64,65的Eg谱带,还在161cm21处显示出Ag振动模式的谱带。229cm21处的谱带可能对应于α‐Si3N4,66的E1g谱带,这是由于处理温度低于诱导转变为β相所需温度,导致釉料浆料中残留未反应的物质。YAG结果补充了该样品获得的XRD谱,该谱图在与YAG标准一致的位置上出现了峰。鉴于氧化钇是釉料混合物的主要组分,存在未反应残留物并不意外。N2ASN样品谱图中缺乏非基板谱带,可能是由于表面表达的IGP相对于SiYAlON釉层样品的覆盖率和厚度较低所致。
在模拟体液中的浸泡
SBF浸泡前的样品表面在图4(a–c)中以背散射模式成像。所有样品上均观察到随机突出、表面光滑的β‐Si3N4晶粒,在N2ASN和SiYAlON釉层样品中,硅铝氧氮材料不同程度地与这些晶粒混合并覆盖其表面(分别见图4(b,c))。相同的表面在经过30天模拟体液浸泡后的形貌显示于图5(d–f)。在三种情况下,均观察到一层薄而颗粒状的沉积层。对于AFSN和N2ASN对照样品,可见一层较薄的沉积物。然而,该颗粒层厚度不足以成功进行能谱分析以确定其成分。相比之下,在SiYAlON釉层样品表面则明显可见更多大而厚的岛状沉积物,其能谱提示为仿生羟基磷灰石。
[与图5(g)]相比。这些岛状物在形貌上似乎也符合此前其他研究者在类似实验中观察到的沉积羟基磷灰石特征。47,49,67–69采用X射线光电子能谱(XPS)测定所观察到的颗粒层的元素组成。结果显示其富含钙和磷,同时含有少量的钠、镁、氯和碳,这与仿生羟基磷灰石或其前驱体一致。图5(h)中的图表显示了模拟体液浸泡后表面钙和磷的原子%之和随浸泡前铝和钇(以阳离子总浓度归一化)的变化关系。该图示对比表明,随着SiYAlON釉层表面覆盖率的增加,类羟基磷灰石物质的沉积量也随之增加。
体外骨肉瘤细胞暴露
每种样品类型在暴露于Saos‐2细胞7天后的代表性拉曼光谱见图5(a–c)。绿色对比区域表明有沉积物形成胶原蛋白,即Saos‐2细胞胞外基质的主要成分。观察胶原蛋白的沉积情况可以反映Saos‐2细胞在样品表面铺展并形成类骨质的程度。红色对比区域是羟基磷灰石(HAp)沉积到类骨质上的部位。AFSN[图5(a)]和N2ASN[图5(b)]对照样品表现出相似的胶原蛋白覆盖和矿化程度。然而,SiYAlON釉层样品[图5(c)]显示出更显著的胶原蛋白覆盖和HAp沉积。
图5(d)显示了各样品在960 cm21处以HAp中PO324四面体的P‐O伸缩振动为中心的平均拉曼光谱。与AFSN材料相比,N2ASN样品的谱带强度和峰面积明显增加,表明其基质矿化程度更高。然而,SiYAlON釉层样品的谱带强度和峰面积进一步显著提高。
所有三种条件下均显示出骨钙素的表达[图6(a–c)],,这表明存在细胞介导的基质矿化现象以及细胞活性增强。70与未退火样品相比,两种处理后的样品上骨钙素的浓度大约高出一倍[图6(g)]。DNA染色显示细胞核在所有三个样品表面均有铺展[图6(d–f)]。对于N2ASN[图6(e)],,整体细胞密度有中等程度的增加,相对于AFSN样品表现出更高密度下的零星聚集[图6(d)]。而对于SiYAlON釉涂层样品[图6(f)],,差异尤为显著,其发射强度超过AFSN两倍以上[图6(g)],并出现大范围的高密度聚集区域。
低倍率下的背散射电子显微照片[图7(a–c)]展示了每种样品条件下沉积物质的表面覆盖率和形貌。沉积物质的图谱与荧光显微图像(图6)中观察到的图谱相对应。骨钙素和细胞核。AFSN[图7(a)]表面约有一半被ECP连接网(深色物质)覆盖,其间分布着矿化结节簇岛(浅色物质),通常彼此相隔200 lm。中等灰色物质为部分暴露的Si3N4,其表面覆盖有一层ECP薄层。ECP本身零星覆盖有细小矿物沉淀,这些可能是由于距离结节簇较远而形成的异相成核位点。N2ASN样品[图7(b)]显示ECP(深色物质)几乎完全覆盖表面,矿化结节簇的分布相较于AFSN样品略显不规则,基底材料表面几乎不可见。最后,SiYAlON釉样品[图7(c)]显示出65%的ECP连接网(深色物质)覆盖率,矿化结节簇(颜色较ECP略浅)之间的间距比其他样品更近(相距100 lm)。此外还可观察到部分暴露的多孔SiYAlON釉区域(最浅)。高倍图像及相应的EDS图谱[图7(d–f)]清晰地展示了结节形貌和定量原子组成。所有矿化结节均表现出与矿化骨一致的能谱特征:即ECP(富含碳)与缺陷型羟基磷灰石(含钙、磷和氧,并含有钠、氯、镁、钾和HCO–3杂质)的混合物。AFSN样品上的结节[图7(d)]富含矿物质,表现出较高的钙、氧与碳的比例。N2ASN样品[图7(e)]的结节富含如C与主要矿物成分钙、磷和氧的高比例所示,ECP存在。最后,SiYAlON釉样品[图7(f)]表面的结节似乎表现出与AFSN样品上存在的结节相似的富矿物组成。
关于Saos‐2细胞吸附、增殖和HAp矿化的机制,先前研究表明,在生理pH值下,由于表面基团混合呈现出负电荷(BSi–O-)和正电荷(@YAOH12,@AlAOH12, BSiANH13),SiYAlON具有类两性离子表面。6,29通过接枝含有此类功能的聚合物来构建具有两性离子特性的表面,也已证明因其高度的表面极化而表现出极强的亲水性。71–73此外,经接枝两性离子功能化聚合物改性的钛合金在经历Kokubo的体外模拟体液浸泡试验变体时,表现出增加的HAp沉积。7335表现出高净负表面电荷的材料,50例如高比表面积二氧化硅38,39和Si3N4,74,也已证明能够诱导SBF中异相HAp沉淀,这是由于在其高电荷表面周围的反离子云中Ca21离子浓度升高所致。此外,SiYAlON釉料中存在的氮磷灰石相与天然HAp同构,可能因异相成核的能量势垒降低而进一步促进HAp沉淀。75最后,细胞外环境、生物材料表面与成骨祖细胞之间的化学相互作用可影响成骨细胞分化和代谢、细胞外胶原蛋白的产生、细胞迁移、基质小泡的生成以及调控骨重塑过程的分子表达。76–79例如,最近一项研究发现,当非晶氮掺杂氧化硅薄膜(即化学性质与SiYAlONs相似的材料)暴露于人骨膜细胞时,其在体外生成了更高量的仿生沉积的羟基磷灰石。氮的存在诱导了成骨基因80和SOD1,81(即对交联胶原形成至关重要的抗氧化剂)的表达。
结论
研究发现,可采用一种类似于传统白瓷上釉的工艺,在Si3N4生物陶瓷表面施加一层薄而致密的硅钇铝氧氮涂层。通过多种显微和光谱技术对所得釉层进行了形貌上和化学上的表征,结果显示该釉层具有多相性。釉层中的主要晶相被确定为氮化磷灰石Y5Si3O12N。体外评估表明,所有Si3N4表面均具有诱导磷酸钙沉积的倾向,且沉积量随表面硅钇铝氧氮覆盖率的增加而增加,且不依赖于成骨细胞的存在。在平行的体外实验中使用类成骨细胞Saos‐2时,SiYAlON釉层表面相较于未涂层的Si3N4(AFSN)表现出更优的细胞增殖和类骨质矿化能力。氮气退火(N2ASN)Si3N4对照组的结果再次与表面硅钇铝氧氮覆盖率的相对含量相关。除了验证先前关于细胞反应在硅铝氧氮表面上改善的研究外,SiYAlON釉料还提供了一种潜在的新型生物活性材料,不仅可作为釉层应用于Si3N4,还可作为涂层用于多种现有的骨与组织修复治疗用生物医学设备。
未来研究将采用不同的涂层技术、变化的釉料成分和烧结温度,以及制备釉料材料整体结构,以更深入地理解这些新发现的生物活性SiYAlON材料的相组成和结构。其他正在进行的工作还将聚焦于在除Si3N4以外的基底上进行SiYAlON型材料的涂层和浸渍。这些实验中表现出前景的样品将接受体外和体内测试,以表征其与生物介质的相互作用及其对骨和其他组织类型再生能力的影响。




















 892
892

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








