【通俗理解】Gibbs自由能是如何推导并应用的?
——从定义到关键公式
【核心结论】
Gibbs自由能是热力学中的一个重要概念,它描述了系统在等温、等压、等粒子数条件下做非体积功的能力,是判断系统反应方向的重要依据。
【通俗解释】
Gibbs自由能就像是一个“能量货币”,它衡量了系统在特定条件下(等温、等压、粒子数不变)能够“花费”多少能量去做非体积功,比如化学反应中的化学键形成或断裂。当Gibbs自由能降低时,系统就倾向于发生某种变化,就像人们倾向于花费更少的钱去完成某件事情一样。

【表格】Gibbs自由能的关键概念和公式
| 概念/公式 | 描述 | 表达式/解释 | 备注 |
|---|---|---|---|
| Gibbs自由能定义 | 系统在等温、等压、等粒子数条件下的热力学势 | G = − k B T ln Z ( N , P , T ) G = -k_BT \ln Z(N, P, T) G=−kBTlnZ(N,P,T) | Z Z Z是配分函数, k B k_B kB是玻尔兹曼常数 |
| 配分函数 | 描述系统微观状态数量的函数 | Z ( N , P , T ) = ∫ e − β H − β P V d V Z(N, P, T) = \int e^{-\beta H - \beta PV} dV Z(N,P,T)=∫e−βH−βPVdV | β = 1 k B T \beta = \frac{1}{k_BT} β=kBT1, H H H是哈密顿量 |
| 物理量计算 | 通过Gibbs自由能计算其他物理量 | S = − ∂ G ∂ T S = -\frac{\partial G}{\partial T} S=−∂T∂G | 熵 |
| V = ∂ G ∂ P V = \frac{\partial G}{\partial P} V=∂P∂G | 体积 | ||
| μ = ∂ G ∂ N \mu = \frac{\partial G}{\partial N} μ=∂N∂G | 化学势 | ||
| 重要公式 | Gibbs自由能等于单粒子化学势之和 | G = N μ G = N\mu G=Nμ | 适用于粒子数可变的系统 |
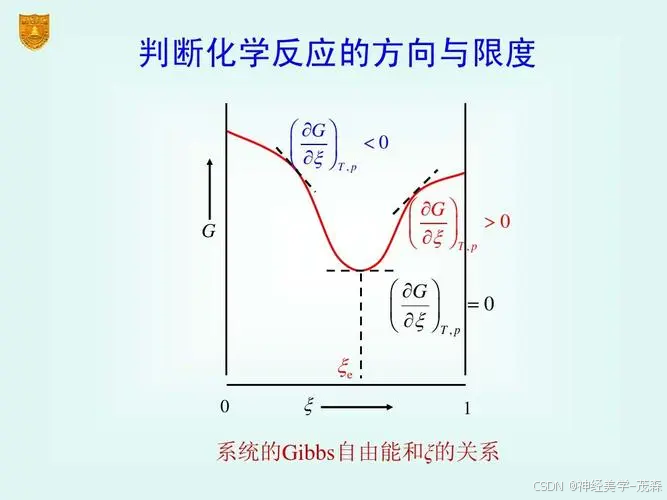
| 应用 | 判断反应方向 | Δ G < 0 \Delta G < 0 ΔG<0反应自发进行 | Δ G \Delta G ΔG是反应前后Gibbs自由能的变化量 |
关键点关系描述:
- Gibbs自由能定义:Gibbs自由能是描述系统在等温、等压、等粒子数条件下热力学状态的物理量,它可以通过配分函数来计算。
- 配分函数:配分函数是描述系统微观状态数量的函数,它考虑了系统中所有可能的状态,并通过玻尔兹曼因子进行加权求和。
- 物理量计算:通过Gibbs自由能,我们可以计算出系统的其他物理量,如熵、体积和化学势。这些物理量在描述系统的热力学性质时非常重要。
- 重要公式:Gibbs自由能等于单粒子化学势之和,这个公式在粒子数可变的系统中特别有用,它揭示了Gibbs自由能与化学势之间的紧密联系。
- 应用:Gibbs自由能在判断反应方向方面有重要应用。当反应前后的Gibbs自由能变化量 Δ G \Delta G ΔG小于0时,反应会自发进行。这是热力学第二定律的一个重要应用。
参考文献:
- Atkins, P. W., & de Paula, J. (2010). Atkins’ Physical Chemistry. Oxford University Press. [【经典教材,详细讲解了物理化学的基本原理,包括Gibbs自由能等概念】]
- Callen, H. B. (1985). Thermodynamics and an Introduction to Thermostatistics. John Wiley & Sons. [【该书深入浅出地介绍了热力学和统计热力学的基本概念,对Gibbs自由能有详细的阐述】]
Keywords:
#Gibbs自由能 #热力学势 #配分函数 #物理量计算 #化学势 #反应方向 #热力学第二定律





























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










