小罗碎碎念
推文主题:人工智能在癌症检测以及早筛中的最新研究进展

之前有一篇推文介绍了哈佛发表的3D病理,当时应该有不少老师/同学对于数据的获取是有些懵的,那么今天你在第一篇文章中或许能找到答案。
一直看我推送的,并且不跳过我最开始这段话的,你们会发现看第二篇文章时,非常亲切,因为文章的观点和我一直以来阐述的内容非常相似。所以,你可以相信小罗把握方向的能力,哈哈。大佬虽然经验丰富,但是他们不在一线,并且学科交叉的领域,亲自下场或许比过往经验更有实际价值。
第三篇&第五篇文章,还是大家最关心的弱监督问题,这是我推文中第二次涉及教师-学生模型,今天还是一个改进版,如果我在后续的顶刊中,还见到这个模型,就出一期推文盘它。
一、胰腺癌前病变(PanINs)的3D基因组图谱研究

文献概述
这篇文章是一项关于人类胰腺癌前病变(PanINs)的3D基因组图谱研究。
研究团队利用机器学习技术对46个大体正常的人类胰腺样本进行了3D组织学重建,并结合多区域微切割和目标及全外显子测序技术,分析了PanINs的微观解剖结构、细胞特征和体细胞遗传变异。
研究发现,每个正常成人胰腺中可能含有数百个PanINs,其中大多数含有致癌的KRAS热点突变。研究还揭示了PanINs具有显著的多灶性和遗传异质性,大多数PanINs起源于具有不同体细胞突变特征的独立克隆。此外,研究还发现一些空间上连续的PanINs含有多种KRAS突变,表明它们具有多克隆起源。
这项研究提供了人类PanINs分子变化的详细3D基因组图谱,为胰腺癌的早期检测和合理干预提供了实证基础。研究结果对于理解胰腺癌的早期发展机制、癌症起始和进展风险的差异具有重要意义,并可能有助于开发新的预防和治疗策略。
重点关注
图1展示了用于胰腺组织3D建模和测序的组织处理工作流程和队列。

-
组织切片与染色:每个胰腺组织块被连续切片,每隔两片取出一片进行苏木精-伊红(H&E)染色,并进行成像,以用于3D建模。
-
3D建模:使用CODA(一种机器学习管道)技术,将H&E染色的连续切片进行配准,创建数字体积。通过深度学习对组织类型进行标记,实现胰腺微观解剖结构的3D重建。
-
3D建模分析:共38个组织块仅用于3D建模分析。这些组织块的3D模型用于量化PanINs的数量和连接性。
-
3D引导的多区域微切割:另外8个组织块除了进行3D建模外,还利用间隔的未染色切片进行3D引导的多区域微切割。这些微切割的区域被用于下一代测序(NGS)和全外显子测序(WES),以评估PanINs的遗传异质性。
整个流程涉及高度专业化的技术,包括组织学、分子生物学和计算机科学,以实现对胰腺癌前病变的深入理解。通过这种综合方法,研究人员能够从宏观和微观层面上分析PanINs,为胰腺癌的早期诊断和治疗提供重要信息。
二、人工智能(AI)在肝癌研究和患者管理中的应用

文献概述
这篇文章是《Nature Reviews Gastroenterology & Hepatology》上发表的一篇关于人工智能(AI)在肝癌研究和患者管理中应用的观点性文章。
文章指出,肝癌在全球范围内的发病率和死亡率都很高。AI技术近年来迅速发展,并对癌症护理产生了影响。AI系统已经被批准用于某些肿瘤类型的临床应用,例如结直肠癌筛查。
研究显示,AI能够分析肝癌的组织病理学、放射学和自然语言,并能取代手工任务,从常规可用的临床数据中获取隐藏信息。然而,对于肝癌而言,这些应用中很少有转化为大规模临床试验或临床批准的产品。
作者主张在肝癌管理的所有阶段整合AI技术,并提出了一个AI在肝癌应用的分类,突出了具有学术和商业潜力的领域,并概述了包括跨学科培训研究人员、临床医生和患者在内的AI基础的肝癌管理政策。AI在肝癌中的潜力巨大,但需要努力确保AI能够满足期望。
文章还讨论了AI在肝癌诊断、生物标志物提取、风险分层、治疗反应预测等方面的应用,并指出了临床转化中的挑战和加速策略。此外,还提到了大型语言模型(LLMs)在医学领域的潜力,以及AI在基因组学数据中的应用。
最后,文章提出了提高AI在研究和临床工作流程中应用的策略,包括AI素养和医学素养、生物标志物开发和政策建议,并讨论了与AI相关的潜在风险。
作者强调,尽管AI在肝癌管理中的应用前景广阔,但要实现其在临床实践的广泛应用,还需要克服包括确保算法的公平性、有效性验证、医疗人员对AI的理解和使用、资金支持、监管框架适应等挑战。
重点关注
Fig. 1提供了原发性肝癌的概述,包括疾病进展期间的临床挑战以及人工智能(AI)如何融入管理。
该图分为两个部分:
a部分

提供了不同类型的原发性肝癌的诊断方法、主要挑战和生物学特征的概览。原发性肝癌主要包括肝细胞癌(HCC)、肝内胆管癌(iCCA)和混合性肝细胞-胆管癌(cHCC-CCA)。每种类型的癌症都有其特定的诊断方法,例如MRI或CT扫描、组织病理学检查,以及它们的特征,如晚期诊断、异质性、复发率高等。
b部分

着重于肝细胞癌(HCC),这是肝癌病例中最常见的类型。它描述了从健康肝脏到HCC的疾病发展过程以及AI在各个阶段的潜在应用。
当健康肝脏暴露于诸如乙型和丙型肝炎病毒、代谢综合征和酒精消费等风险因素时,可能会出现酒精相关肝病(ALD)或代谢功能障碍相关的脂肪肝病(MASLD,以前称为非酒精性脂肪肝病)。
这些病理状态可以引起肝炎,进一步发展为肝纤维化,其特征是细胞外基质的形成,最终可能导致肝硬化,这是以肝脏大量瘢痕为特征的一种状况。肝硬化反过来又增加了患HCC的风险。
在这一复杂过程中,AI模型可以在以下多个方面发挥作用:
- 筛查:在疾病早期阶段识别高风险个体。
- 鉴别诊断:帮助区分不同类型的肝癌。
- 评估可手术性:确定患者是否适合进行手术治疗。
- 亚型分类:根据肿瘤的特定特征将HCC进行分类。
- 生物标志物提取:识别与疾病进展和治疗反应相关的分子标志物。
- 随访:监测疾病进展和治疗反应。
总的来说,Fig. 1强调了AI技术在肝癌管理全过程中的潜在整合点,从疾病早期的筛查到治疗后的随访。
三、BRAIxDet:检测乳腺X光照片中的恶性病变

文献概述
这篇文章是关于一种新的医学图像分析方法,名为BRAIxDet,它被设计用来检测乳腺X光照片中的恶性病变。
该方法特别针对现实世界中常见的不完全标注数据集,这些数据集中有一部分是完全标注的(包括病变的位置和分类),另一部分则是弱标注的(只有全局分类,没有病变位置信息)。
BRAIxDet通过一个两阶段的学习策略来解决这一问题:
- 预训练阶段:使用整个数据集进行弱监督预训练,训练一个多视角乳腺X光分类器,即使用全局标签来训练模型。
- 半监督学生-教师学习阶段:将预训练的分类器扩展为多视角检测器,使用学生-教师学习方法进行训练,其中学生模型从完全标注和弱标注的数据子集进行学习,而教师模型则基于学生模型参数的指数移动平均值进行训练。
文章通过在两个真实世界的乳腺X光照片数据集上进行广泛的检测结果展示,证明了BRAIxDet在不完全标注的情况下,检测恶性乳腺病变方面达到了最先进的结果。
此外,文章还探讨了与乳腺X光照片中的病变检测相关的工作,包括两阶段和单阶段的检测方法、弱监督疾病定位方法、半监督对象检测方法,以及医学图像分析中的预训练方法。
作者强调,BRAIxDet的主要贡献在于探索了一种新的实验设置,提出了一种新的两阶段训练方法,并且在半监督学生-教师检测学习中引入了创新,解决了依赖于学生训练样本的问题,以及学生和教师模型参数之间的不匹配问题。通过大量实验,BRAIxDet在两个数据集上都取得了最先进的性能。
重点关注
ADMANI 数据集的结构:完全标注的乳腺X光照片和弱标注的乳腺X光照片。

- 完全标注的乳腺X光照片:这些照片在数据集中的比例为47.78%。完全标注意味着这些图像不仅有整体的分类标签(例如,是否包含恶性病变),而且还包括了病变的具体位置信息,比如病变的边界框坐标。
- 弱标注的乳腺X光照片:这些照片占据了数据集剩余的52.22%。弱标注的图像只有整体的分类标签,没有病变的具体位置信息。也就是说,这些图像仅告诉我们图像中是否存在恶性病变,但没有指出病变的确切位置。
这种数据结构反映了现实世界中医学图像数据集的常见情况,即并非所有图像都能获得详尽的标注。在大规模的筛查项目中,由于需要专家放射科医师进行耗时且成本高昂的标注工作,因此完全标注的数据可能只占一部分。
BRAIxDet 方法正是为了解决这种不完全标注问题而设计的,它能够在利用完全标注数据的同时,也有效地利用弱标注数据来提高病变检测的准确性。
四、一种新型无细胞DNA片段组检测技术,提高肺癌早期检测的效率

文献概述
这篇文章是关于一种新型无细胞DNA片段组检测技术(DELFI,即DNA Evaluation of Fragments for Early Interception)的临床验证研究,旨在提高肺癌早期检测的效率。
研究团队通过前瞻性病例对照研究,在958名适合进行肺癌筛查的个体中开发了一种基于血液的肺癌检测测试。这项测试通过分析血液中的无细胞DNA(cfDNA)片段化特征(fragmentomes),利用机器学习技术来识别可能患有肺癌的个体。
研究分为两个阶段:训练阶段和验证阶段。在训练阶段,研究者使用576名病例和对照组的样本来训练分类器;在验证阶段,使用另外382名病例和对照组的样本来测试分类器的性能。结果显示,该测试对肺癌具有很高的敏感性,并且在不同的人群和伴随疾病中显示出一致性。
此外,研究还模拟了在五年时间内,使用这种测试可能对人群健康结果带来的潜在改善。模拟结果表明,即使在适度的使用假设下,这种测试也有可能预防数千例肺癌死亡。
文章还讨论了这项研究的潜在局限性,包括可能存在的选择偏差,以及测试在临床实践中的实际应用方式与研究设计的不同。尽管存在这些局限性,研究结果表明,这种基于血液的肺癌检测测试有潜力提高肺癌筛查率,从而带来显著的公共卫生益处。
重点关注
Figure 1展示了用于提高肺癌早期检测的无细胞DNA片段组检测技术(DELFI)的临床验证方法的总体流程。
这个流程包括以下两个主要部分:

a. DELFI方法的说明:
- 该方法通过非侵入性地评估无细胞DNA(cfDNA)片段化特征来进行肺癌检测,特别是通过比较短片段与长片段的比例。
- 当肺癌细胞死亡时,它们会释放出带有可变长度连接DNA的核小体DNA进入血液循环。
- 通过全基因组映射cfDNA片段,发现与非癌症个体的cfDNA相比,癌症细胞的cfDNA片段显示出更异常的模式。
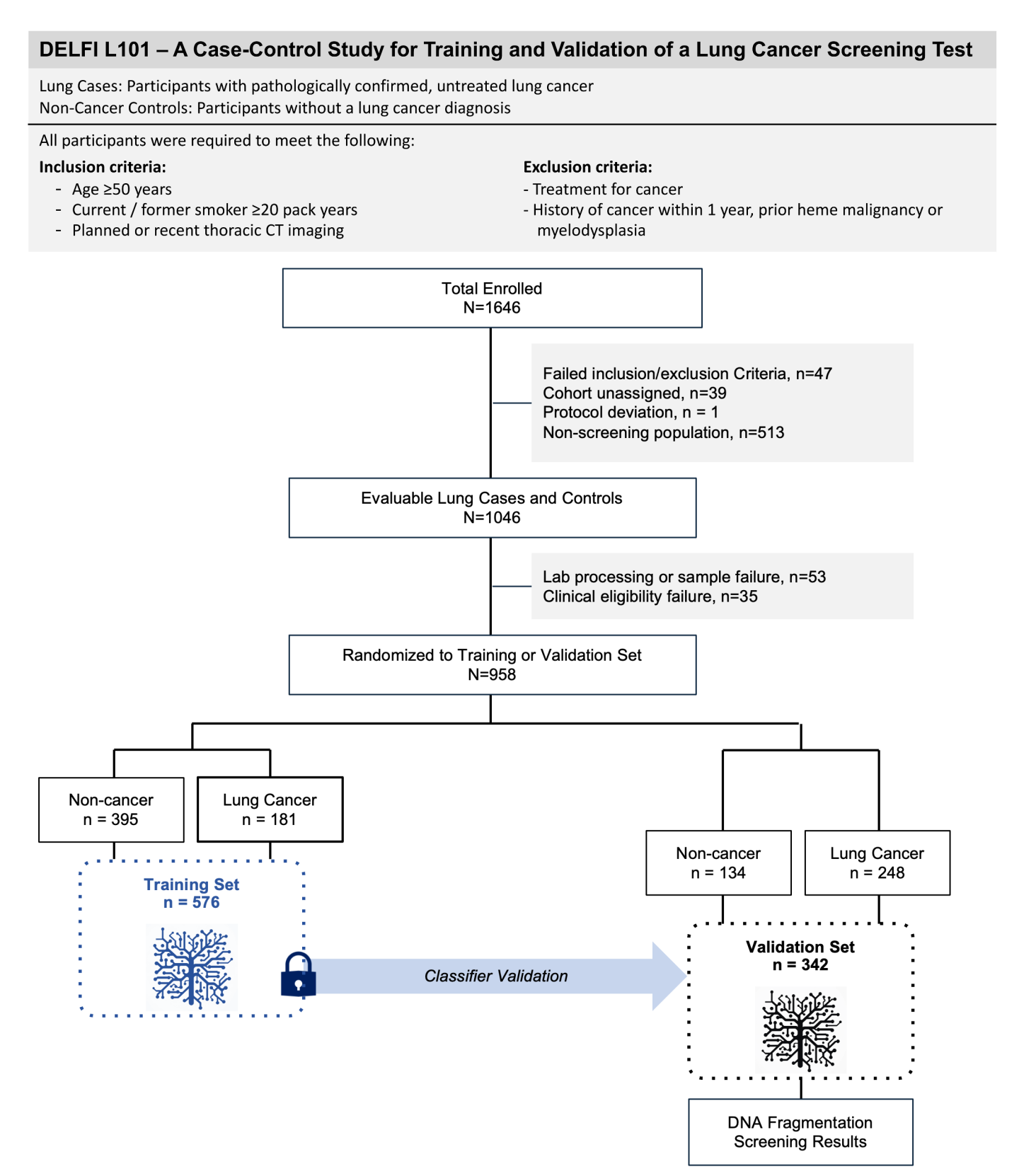
b. DELFI-L101研究设计:
- DELFI-L101研究是一项前瞻性病例对照研究,研究编号为NCT04825834,还包括两个机构补充协议NCT00301119和NCT01775072。
- 流程图说明了基于临床、样本和检测资格标准纳入和排除L101参与者的过程。
- 参与者被分配到分类器训练集(n=576)和临床验证集(n=382)。
- 使用训练集中全基因组cfDNA片段化特征的机器学习来开发一个锁定的分类器,并在临床验证集中进行评估。
这个流程图强调了DELFI方法的两个关键步骤:首先是对cfDNA片段化特征的非侵入性评估,其次是利用机器学习技术来开发和验证一个能够区分肺癌和非肺癌个体的分类器。通过这种方式,研究旨在提高肺癌的早期检测率,从而可能改善患者的治疗结果和生存率。
五、AI+临床信息,改善膀胱癌分割模型的效率

文献概述
这篇文章是关于一种新的医学图像分析方法,特别是针对从医学放射图像中分割膀胱肿瘤的方法。
-
背景与动机:膀胱癌是泌尿系统最常见的肿瘤疾病之一。从医学放射图像中准确分割出膀胱肿瘤对于早期发现、诊断和预后评估至关重要。深度卷积神经网络(DCNNs)已被成功用于膀胱肿瘤的分割,但这些基于数据驱动的方法依赖于大量的标注图像数据,并且忽略了临床知识。
-
研究问题:现有的基于DCNN的分割方法在数据有限的情况下表现不佳,并且缺乏领域知识和模型解释能力。
-
方法:文章提出了一种新的方法,将临床逻辑规则整合到DCNN中,以改善膀胱肿瘤的分割。临床逻辑规则提供了一种语义化且易于从临床医生那里获取的知识表示方式。该方法通过减少基于逻辑规则的真实分割掩模和预测分割掩模之间的差异,使分割结果与临床逻辑规则一致。
-
实验:作者在来自合作医院的膀胱MR图像上进行了实验,验证了所提出方法的有效性。实验结果表明,即使在有限的标注图像数量下,该方法也能实现精确的分割结果。
-
贡献:
- 制定了膀胱肿瘤定位的临床逻辑规则。
- 提出了一种新的通过整合临床逻辑规则到DCNN中的膀胱肿瘤分割方法。
- 作为会议论文的扩展版本,本期刊版本还包括对临床逻辑规则提取和向量化的详细说明、提出了一种新的数据增强方法、进行了基于逻辑规则的不同损失项的消融研究,以及与其他最先进的基于先验的分割方法进行了额外的比较实验。
-
相关工作:文章还回顾了增强医学图像分割的先验知识、膀胱肿瘤分割的先前工作,以及将逻辑规则与DCNN结合的相关研究。
-
结论:文章总结了通过融合临床逻辑规则到基于DCNN的分割方法中,可以显著提高分割的准确性,尤其是在训练数据有限的情况下。
文章的研究对于提高医学图像分析的准确性和减少对大量标注数据的依赖具有重要意义。
重点关注
Fig. 1 展示了所提出的膀胱肿瘤分割方法的框架图。
这个框架由两部分组成:
-
分割网络的主体(左侧部分):这是一个基于深度卷积神经网络(DCNN)的分割网络,例如U-Net。这个网络负责从医学图像中预测出肿瘤的位置和形状。
-
临床逻辑知识提取模型(右侧部分):这部分模型的目的是提取与膀胱肿瘤和膀胱壁相关的临床逻辑规则,并将这些规则嵌入到DCNN的潜在特征空间中。

框架的工作流程如下:
- 首先,从地面真实分割掩模(ground-truth segmentation masks)和预测的分割掩模中提取与膀胱肿瘤和膀胱壁相关的逻辑规则。
- 然后,将这些逻辑规则转换为图(graphs),并使用图卷积网络(Graph Convolutional Network, GCN)将它们嵌入到潜在特征空间中。
- 通过最小化地面真实分割掩模的逻辑规则嵌入与预测分割掩模之间的差异,确保分割结果与逻辑规则一致。
整体而言,Fig. 1 描述了一个结合了深度学习和临床逻辑知识的复杂系统,旨在提高膀胱肿瘤分割的准确性和可靠性。通过整合临床逻辑规则,该方法减少了对大量标注数据的依赖,并提高了模型的解释能力。
六、非侵入性人工智能系统,在乳腺癌新辅助化疗(NAC)期间早期预测残留癌负担(RCB)评分

文献概述
这篇文章是关于一种非侵入性人工智能(AI)系统的开发,该系统用于在乳腺癌新辅助化疗(NAC)期间早期预测残留癌负担(RCB)评分。
研究背景指出,RCB III表示乳腺癌的药物抗性,而目前缺乏早期检测方法。
研究方法包括从四家机构招募了1048名接受NAC治疗的乳腺癌患者,收集了NAC前后的磁共振成像(MRI)图像,并提取了放射组学和深度学习特征。开发了一个多任务AI系统,用于将患者分为三个组别(RCB 0-I、II和III),并在初级队列(PC)中进行了特征选择和模型集成,然后在三个外部验证队列(EVCs)中进行了验证。
研究结果显示,在442名(42.18%)患者中RCB为0-I,462名(44.08%)为RCB II,144名(13.74%)为RCB III。
- 模型I在区分RCB III和RCB 0-II方面,在PC中达到了0.975的曲线下面积(AUC),在EVCs中达到了0.923。
- 模型II在区分RCB 0-I和RCB II-III方面,在PC中AUC为0.976,在EVCs中为0.910。
分组分析证实了AI系统在不同的临床T阶段和分子亚型中的一致性。
研究结论是,多任务AI系统提供了一种非侵入性工具,用于早期预测乳腺癌中的RCB评分,支持NAC期间的临床决策。
文章还讨论了研究的局限性和未来方向,包括需要前瞻性临床试验的验证,以及完全自动化分割方法的潜力探索。


























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








