
电子,化学的灵魂。
九年级《化学》教材上册告诉我们:
核外电子决定元素的化学性质。
最外层电子数,与元素的化学性质密切相关。
一、电子排布决定元素周期律
电子在原子核外的排布,随着原子序数的增加,从内到外,一层一层,一个一个地排布,美好地展示出了
元素周期律
1.1 电子排布决定原子半径
电子排布决定元素原子的
原子半径
元素的原子半径呈现周期性的变化。
1.2 原子半径决定元素性质
原子半径的大小,决定了元素的
金属性四强
非金属性四强、
一一剧烈、
一一稳定、
一一还原性
但是,电子比较诡异,电子们还真不是一层一层、规规矩矩地排布的。
二、电子层、能级、轨道、电子数
原子核外,电子层(能层)、能级、轨道之间的关系,稍许复杂。
2.1 原子核外的能级是不连续的
各能级之间,中学认为没有电子存在(显然是错误的)。
能层、能级、轨道之间的关系有点复杂,用一张图可以概括。
2.2 能层-能级-轨道全貌图
选修一这本教材《物质结构与性质》,关键是 “核外电子的排布”,重点是 “核外电子的排布”,难点还是 “核外电子的排布”。
能量高低看能级
电子排布看轨道
电子在原子核外的排布规律,看下面这张图——全貌图。这张图是全貌,具体内容,下面一一解说。
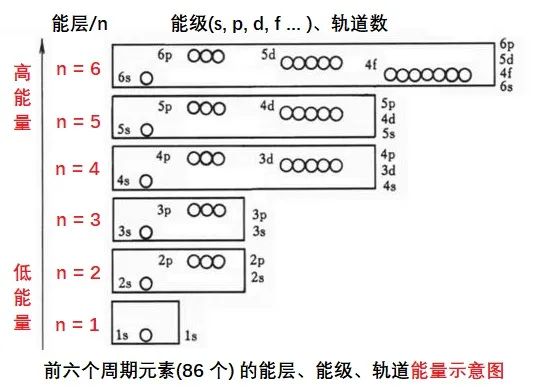
2.3 电子层-能级-轨道-电子数
原子核外的能层 (电子层)、能级、轨道、所能容纳的电子数如下。
说明:所能容纳的电子数,要根据后面的 “构造原理和电子排布三原则” 来确定。
(1)能层
我们俗称的电子层,用 n 表示,n=1、2、3、4、5、6、7……。
国际上,n 还用大写英文字母表示,n = K、L、M、N、O、P、Q……
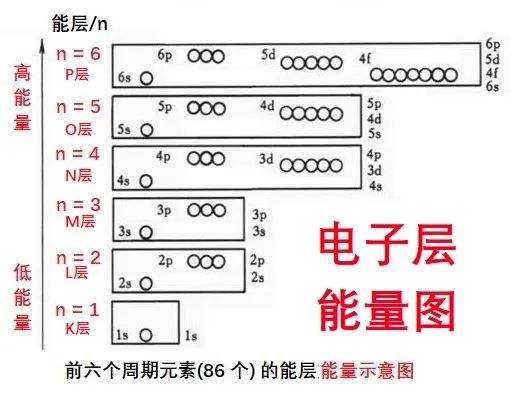
n = 1 的能层最靠近原子核,能量最低,电子最稳定;n 越大,能量越高,对应的电子越容易得到或失去。
说明:用大写英文字母表示,n = 1 是 “开始—Kai-shi” 的那一层,然后按照英文字母表的顺序,一遍就记住了。高考中,会问到这样的问题
“元素周期表第 37 号元素的第 M 层有几个电子”
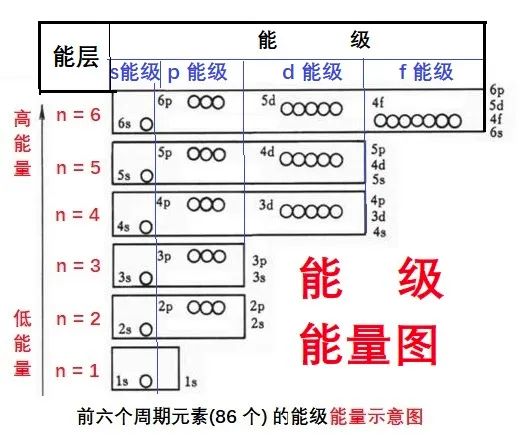
(2)能级
每一能层 (电子层) 内,可以包含不同能级。电子层 n 等于几,就有几个能级。
电子层 能级数
1 s 能级
2 s、p能级
3 s、p、d能级
4 s、p、d、f能级
5 s、p、d、f、g能级
6 ... ... ... ... 六个能级
s、p、d、f、g等能级
能量逐渐增高
s、p 能级都正常
d、f 能级不正常
s、p 能级都正常
d、f 能级不正常
(n-1)d 跳到 ns 上:
3d 跳到 4s 上;
(n-1)f 跳到 np 上:
4f 跳到 5p 上。
(3)能级内的轨道
电子在原子核外分为能层;
能层内分为能级 s、p、d、f;
能级内又分为
能量相同的
轨道
不同能级内的轨道数不同:
能 级 轨道数
s 能级 1 个
p 能级 3 个
d 能级 5 个
f 能级 7 个
g 能级 …………
(4)每层的轨道数、电子数
原子核外,每个能层 (电子层) 的轨道数、所能容纳的电子总数不同。
电子层 轨道 轨道数 电子数
1 (K层) s 1 2 个
2 (L层) s p 4 8 个
3 (M层) s p d 9 18 个
4 (N层) s p d f 16 32 个
5 (O层) …… …… ……
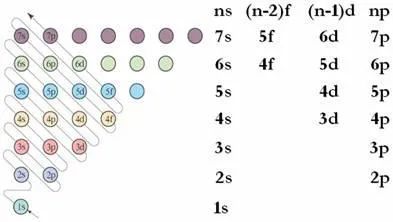
三、构造原理、电子排布三原则
按照玻尔模型,电子是一层一层排布的。
但是,按照实验测定的结果,电子层之间有交叉;按照量子化学计算,电子能级之间有重叠。
电子排布
不一定是
一层一层排布的
3.1 构造原理
各个电子层内的能级不同,能量也不同。
电子按照构造原理从低到高排布。
3.2 电子排布三原则
电子在原子核外,按照以下三个原则排布。
(1)保利原理
保利原理,又称为保利不相容原理,意思是:
能层内的每个轨道,最多只能容纳 2 个电子,而且这 2 个电子的自旋方向相反。
(2)洪特规则
洪特规则,意思是在相同能级内,电子尽量占据更多的轨道。当同一能级的所有轨道的电子达到半满时,能量较低;电子达到全满时,能量最低。
洪特规则,可以解释为什么稀有气体元素的化学性质是非常稳定的,因为它们的轨道内的电子是全满的。
洪特规则还可以解释为什么 24 号元素 Cr、29 号元素 Cu 等元素的核外电子异常排布。
(3)能量最低原理
按照构造原理,电子优先排布在能量最低的能层、能量最低的能级、轨道上。
结语
电子排布之后,还要写出它们的电子排布式、电子排布图,这是下次课的内容。
作者简介:
赵老师,男,副教授。
中科院催化化学博士、结构化学硕士,吉林大学结构化学学士。曾任日本北海道大学有机化学客座研究员、马拉西亚马尼拉大学英语化学老师,
从2008年至今,在北京做高中化学、竞赛化学、英语化学、初中化学教师,谙熟高考化学考点、化学竞赛考点,高中化学、竞赛化学、AP化学、ib化学、A-Level化学、初中化学教学具有丰富经验。
(衷心感谢您的光临)

————————————————————




————————————————————
微信号/QQ号:157 246 961
地址:北京市海淀区西三环北路 72 号
微信:teacher_zhao_beijng







 本文详细阐述了电子排布如何决定元素周期律,包括电子排布对原子半径、元素化学性质的影响。介绍了电子层、能级、轨道的概念,并通过能层-能级-轨道全貌图解析电子排布规律。同时,讲解了构造原理和电子排布的三个基本原则:保利不相容原理、洪特规则和能量最低原理,为理解元素化学性质提供基础。
本文详细阐述了电子排布如何决定元素周期律,包括电子排布对原子半径、元素化学性质的影响。介绍了电子层、能级、轨道的概念,并通过能层-能级-轨道全貌图解析电子排布规律。同时,讲解了构造原理和电子排布的三个基本原则:保利不相容原理、洪特规则和能量最低原理,为理解元素化学性质提供基础。

















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








