
已有热心读者指出我昨天一文:分子的世界,原来也是江湖(上)中的严重错误,因为已发出的文章无法修改,只好在此更正:在“1、共价键的极性如何定义?”中“极性键”与“非极性键”应调换位置;在“3、如果按上述思路来思考分子的极性,该如何定义?”中“极性分子”与“非极性分子”应调换位置。感谢大家仔细阅读,欢迎继续批评指正!
我们接着昨天继续说:极性分子的极性会有大小之分吗?若要定量,需关联哪些物理量?
想来应当有大小之分,“极”就是“端”的意思,就是偏在一边。
那它偏的程度怎样呢?
它与正负电荷重心偏离多少距离有关(不偏离自然就是非极性分子),还应当与偏离电荷量的多少有关啊。偏的距离相同的话,电荷量越大当然越“极端”啦!
确实如此,分子极性的强弱,可以用偶极矩(dipole moment,μ)表示。偶极矩是表示分子电荷分布情况的一个物理量,等于极性分子正负电荷之重心间的距离d(又称偶极长)与偶极电荷量q的乘积,μ=qd。
眯起眼睛想想,就能明白,这个偶极矩是有方向的,总得告诉人家你朝哪边偏吧(化学上按习惯规定其方向是由正到负),可以通过实验测得。根据偶极矩大小可以判断分子有无极性,或比较分子极性的大小。
μ= 0,为非极性分子;μ值愈大,分子的极性愈大。
下表列出了一些常见分子的偶极矩实测值。
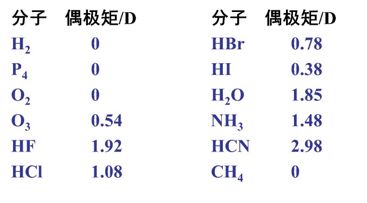
想一想:
1. O3分子的偶极矩为0.54,奇怪吗?应当类似于H2、P4、O2等,μ= 0啊。
O3分子有弱的极性让我们推测出什么?首先,分子中的氧氧键一定是由极性的,否则分子的极性哪儿来呢?第二,这个分子还不该是直线型的,否则极性抵消。确实——O3分子是V型的!
2. 卤化氢分子的极性怎么递变?从HF到HI,极性在减弱。可是从HF到HI,键长在增加啊!呵呵,不是一回事。由于F到I的电负性在减小,因此与H的电负性差值在减小,偶极长d在减小,偶极长并不是键长啊!另外,看出来没有,HF的极性特别大(几乎是HCl的两倍了),H2O、NH3的极性也非常大,这点在后面还将再提到。
极性是分子的一种性质,也就是分子重要的先天基因。微观层面上这种分子的性质会对宏观层面物质的许多物理性质有影响,比如溶解性。
现在我们回到开头的问题:物质也是有“派系”的,I2和CCl4是“一伙”的,而H2O显然是另 “一伙”的。至于C2H5OH,有些让人迷惑,好象和“两伙”都可以很好。
极性相似的往往是“一伙”的,相互溶解性较好。回到开头的问题,I2和CCl4是哪一伙的呢?都是非极性分子,互溶;而H2O和它们不是一伙的,它是极性分子,与它们不互溶;至于C2H5OH呢,想来这个分子的极性(μ值)应当介于0~1.85之间吧,因此与两伙都能搭上。当然,也许还有些别的原因,后面慢慢再去发现。
既然分子的世界是有“帮派”的,那我们就可以理解前面曾经知道的现象了:I2和H2O不是一伙儿的吧,因此,I2在H2O中溶解得不情不愿的,极为勉强。这时候,CCl4来了,它与I2可是一伙儿的啊!I2分子终于见着亲人了,欢天喜地地投入到CCl4的怀抱啦!当然,大自然从不把事情做绝,大部分I2进入CCl4中,很少部分的I2留在H2O中,这就是萃取。
(关于大自然从不把事情做绝这点,随着化学的学习,你会越来越有体会的。)
分子的江湖也复杂着呢!即使都是极性分子,极性大小不同,分子质量不同,它们之间的“亲疏”程度也会有所差异。如果我们将菜汁点在滤纸上,有合适的溶剂经过这滴菜汁向上漫延时,菜汁中的各中色素就在溶剂和滤纸上水份之间作着各种“亲疏”权衡,有的跟着溶剂跑得快,有的赖在滤纸上跑得慢,逐渐拉开了距离。这就是层析法分离。

最后,提一个问题大家思考:讨论分子的极性的时候,大家可能已经关注了分子的对称性。可是,CCl4分子有对称性,是非极性分子;H2O分子也有对称性,是极性分子,那么分子的对称性与分子的极性到底有什么关系呢?

往期文章(点击即可查看)
科学思维是怎样发展出来的?
分子的世界,原来也是江湖(上)

责任编辑:博雅
“说梦”系列文章持续更新中
欢迎关注、共同进步!
公众号留言功能暂未开通
预计还需要1周左右
如果你有什么想说的
欢迎来稿:
WanderingBY@qq.com
我会择优发布在本公众号上哦
有理有梦 不急不躁
走进保老师的教育世界▶

























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








