
早期历史
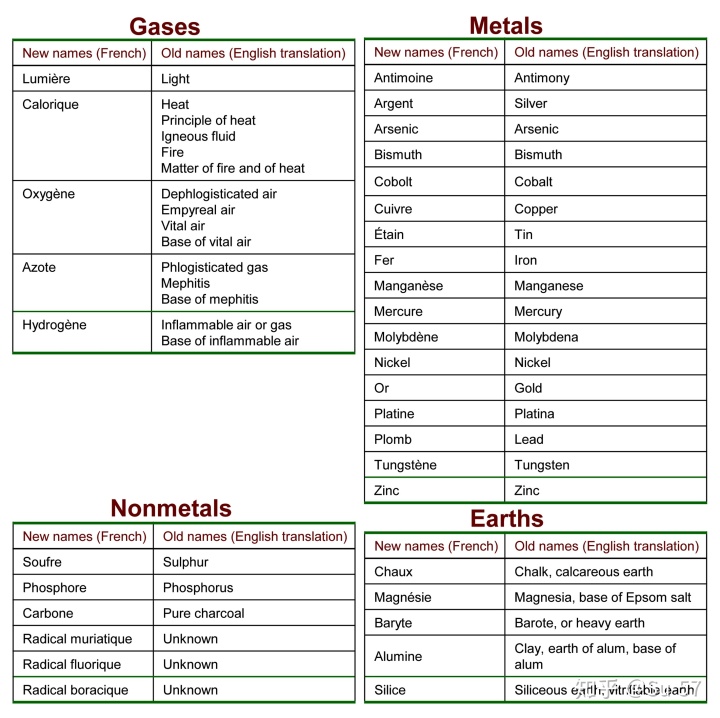
1789年,拉瓦锡发表《化学基础论》这部集他的观点之大成的教科书,在这部书里拉瓦锡定义了元素的概念,并对当时常见的化学物质进行了分类,总结出33种元素(尽管一些实际上是化合物)和常见化合物,将其分为气体、金属、非金属矿物和土元素四组,这应该是世界上第一张有关元素的分类表格。
1803年12月与1804年1月道尔顿在英国皇家学会作关于原子论的演讲,1808年他的代表著作《化学哲学的新体系》正式出版。书中,他首次提出用相对比较的办法求取各元素的原子量,并发表第一张原子量表。

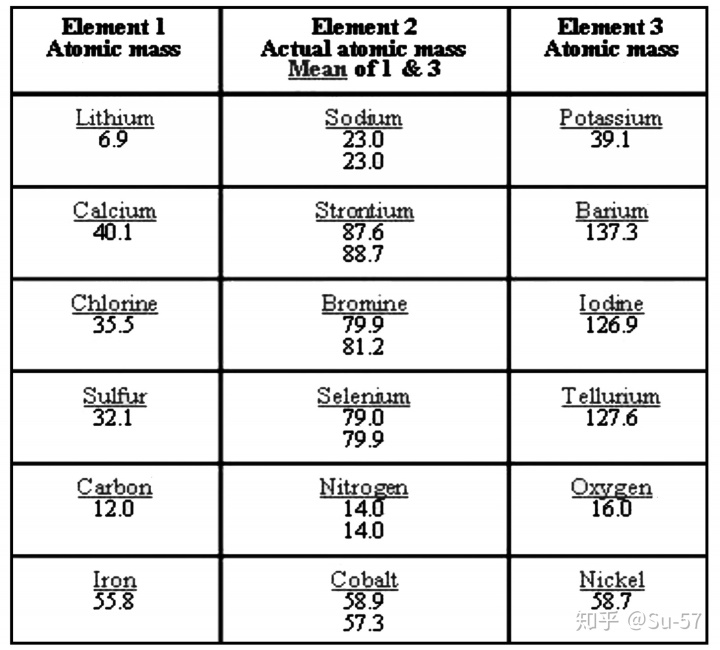
1829年,在约翰·沃尔夫冈·德贝莱纳发现在选出的三元素群组(triad)中某些属性有一定的趋势。例如,锂和钾的原子量的平均数与钠的原子量非常接近。同样的事情也发生在钙,锶,钡、硫,硒,碲,以及氯,溴,碘之间。他还发现,若每组按原子量排序,第二个元素的原子量约等于第一个和第三个元素原子量之和的一半。这也被称为德贝莱纳三元素组定律。
1857年,凯库勒提出,碳原子为四价原子:这个理论来自于原子价的观念,特别是碳的四价(Kekulé在1857年末宣布),和碳原子相互联系的能力(在1858年5月发表的一篇论文中宣布)以确定分子中所有原子的键合顺序。过去这是一个在周期表形成时常被忽略的概念,在门捷列夫和迈耶尔的初期研究中充分体现了化合价的作用。
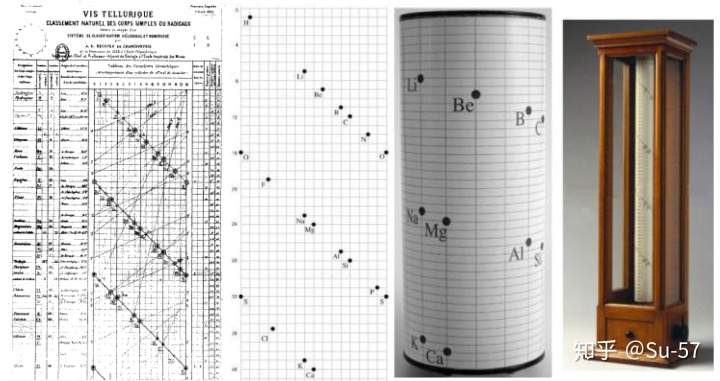
1862年,法国地质学家De Chancourtois绘制了周长为16个单位的圆柱体表面上的原子量,由此产生的螺旋曲线(De Chancourtois称为方圆三角形)将相似的元素带到圆柱体上彼此上方或下方的相应点上。因此,他提出“元素的性质就是数字的性质”。这张图表成为元素周期表的雏形,他是第一位注意到元素按原子量顺序排列的周期性的科学家:他注意到相似的元素以规则的原子量间隔出现。但他的著作却鲜能引起世界各地的化学家的注意。他将论文提交给了法国科学院,并在该学院的期刊Comptes Rendus上发表。De Chancourtois的原始图表被遗漏在出版物之外,这使得该论文难以理解。但是,该图确实出现在不太广为人知的地质手册中。该论文文涉及到地质概念,许多化学家并不感兴趣,直到门捷列夫的研究之后才得到关注。
1864年,英国化学家威廉∙奥德林进一步修改了他1857年发表过的以当量为基础的“元素表”,而以“原子量和元素符号”为标题重新发表。该表基本按原子量排列元素,只对碘和碲未顾及其原子量而按性质排列,并在适当地方留下空格,也部分地发现元素性质出现周期性变化的规律。但是,表中错误地将Li、Na、K、Rb、Cs分别放在了三个横列里。全表列入47种元素,他提到了周期律的想法但未深入研究。随后,他在1870年提出按化合价分类元素。
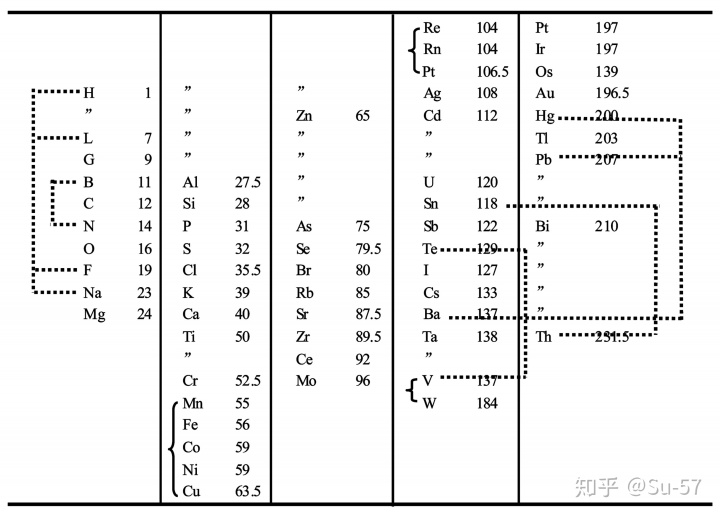
同样在1864年,迈耶尔在其名著《现代化学理论》第一版中附了一张包含28种元素的周期表,并将其分成6个族,即《六元素表》:在这张周期表中,同族元素的化合价相同,相邻周期之间元素的原子量差值呈现一定的规律。虽然这张元素周期表包含的元素种类并不多,但是已具备了元素周期表的基本要素,堪称元素周期表的雏形。
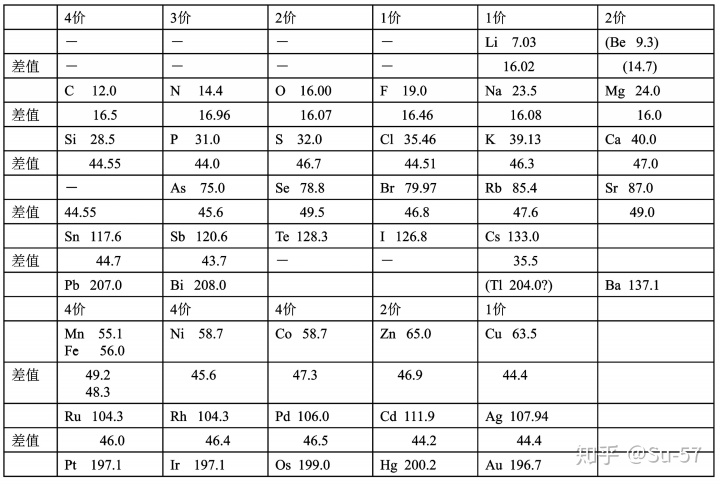
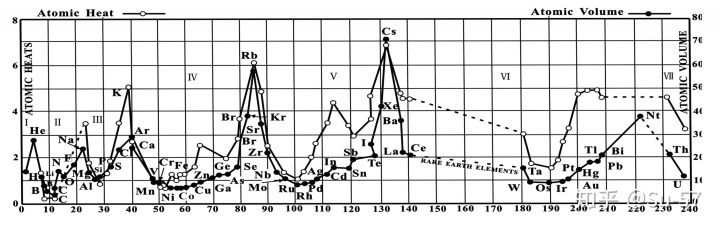
1868年,迈耶尔在他的《现代化学理论》第二版中使用了第二张元素周期表,这张表包含52种元素和15个纵列,比起第一张表增加了24个元素和9个纵行,只是在他去世后人们整理其原稿时才被发现;1869年12月,迈耶尔在一篇论文中发表了第三张元素周期表,包含了55种元素,同时给当时尚未发现的元素留下来空位;此外,这篇论文还附有“原子体积周期性图解”,这张图非常直观地表现出元素的物理性质随原子量的周期性变化规律。这篇论文在1870年正式出版。
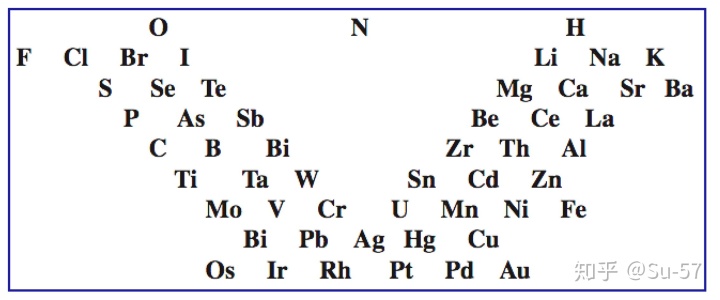
1863年开始,英国化学家约翰∙亚历山大∙雷纳∙纽兰兹注意到了并开始研究化学元素性质的周期性。1865年他受德国化学家德贝莱纳的“三元素组”的启发,把当时已知的61种元素按照当时的相对原子质量的递增顺序排列,发现每隔7种元素便出现性质相似的元素,如同音乐中的八度音程一样,因此称为元素八音律。该表的前两个纵列几乎相对应于现代元素周期表的第二、第三周期,但从第三列以后就不能令人满意了。其缺点在于既没有充分估计到原子量测定值会有错误,又没有考虑到还有未被发现的元素应留出空位。纽兰兹元素分类的成功之处在于用“序号”这个概念取代了原子量。由此,他克服了前人那种拘泥于原子量数值规则的倾向,即便不完整但也抓住了元素整体的规则。遗憾的是他仅仅停留在分类上,而没能深入到元素具体的物理、化学性质当中去探讨他发现的规则并展开新的研究。这个想法当时未被人们接受,甚至遭到了很多科学界同行的嘲讽,皇家化学会也拒绝发表他的论文。

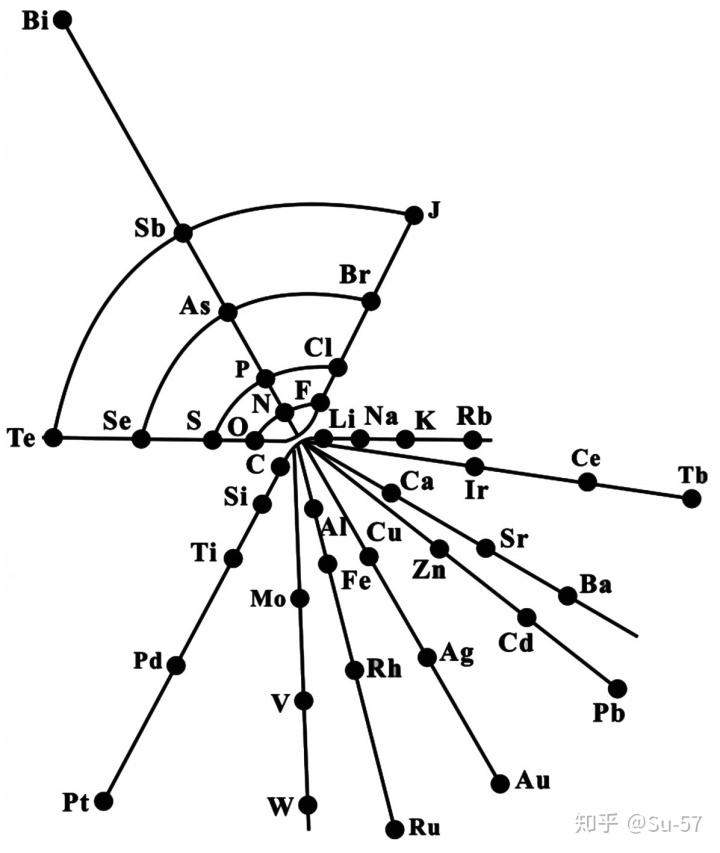
1867年,出生于丹麦的美籍化学家Gustavus Detlef Hinrichs提出一个基于原子光谱、原子量和化学性质的螺旋周期体系:把元素按原子量的大小排列在不等的半径线上,在同一个半径线上分布着性质相似的元素。但当时的人们认为他的研究古怪、复杂、虚有其表,并没有接受和承认这个理论。
1869年3月,门捷列夫在他题为《元素性质与原子量的关系》的一篇论文中首次提出了元素周期律,发表了第一张元素周期表。这个表包括了当时科学家已知的63种元素,表中共有67个位置,尚有4个空位只有原子量而没有元素名称,门捷列夫假设,有这种原子量的未知元素存在。在表中,他还对铟、碲、金、铋四种元素当时公认的原子量表示质疑。比如根据碲在元素周期表中的位置在碘的前面,门捷列夫认为碲的原子量应该比碘小,而不是当时人认为的比碘大。这是门捷列夫发现元素周期率的最初思想。在他的第一张元素周期表发表以后,门捷列夫对元素周期律继续进行了深入研究。特别是重新审定了许多元素的原子量。1871年,门捷列夫出版新版元素周期表,把性质相似的元素排在同一纵列当中(此前版本以横向排列),并且按照常见氧化态将几组元素纵列标记I到VIII的编号。对于几种他此前认为理应存在但尚未发现的元素,门捷列夫也详细地给出了他预测的元素性质。随着科学家发现更多自然存在的元素,周期表中的空白也逐渐被填补。例如元素钫(之前被门捷列夫称为铯下元素)于1939年被法国科学家玛格丽特·佩里发现,也是最后一个在自然界中发现的元素;元素钚于1940年合成生产,于1971年证实在自然界中微量存在。

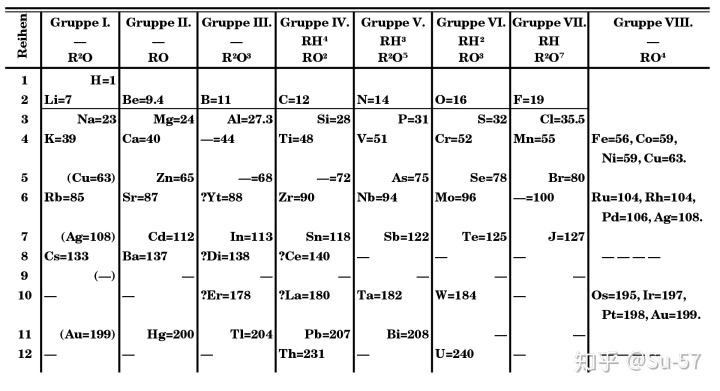
门捷列夫的周期表逐渐获得广泛的承认和接受,这源于他作出的两个决定:其一,他在表中为未知元素留下空位(门捷列夫并不是第一个这样做的化学家,但是他被认为是第一个用元素的周期性质预测未知元素的)。例如门捷列夫利用同族元素具有相似性质的特性,大胆提出未知元素的原子量、物理及化学性质等,而这些元素都在随后陆续被发现,如镓和锗;其二,他为了让同族元素应具有相似性质这一特点,偶尔会刻意不跟从原子量的大小去安放元素,如碘这元素的原子量较碲为低而应在碲的前方,但碘与其他卤素十分相似的性质让门捷列夫刻意让碘和碲的位置对调。门捷列夫在1869年发表它的元素周期表时,虽说原子量的测量尚算精准,这些数据亦大大推动他的设计,但门捷列夫利用如元素的热容量去比较,大胆修订部分已发现元素的原子量,包括铟及铈,并建议钍及铀的原子量应增大一倍。这些后来被证实或扩充的预言令科学界广泛承认及接受门捷列夫的周期表。
后续发展
现流行的周期表布局,也称为通用形式或标准形式,是由美国化学家霍勒斯·戴明确定的。1923年,戴明发表简短版本(门捷列夫式)和中等版本(18列)的周期表。1928年,默克公司发布戴明的中等版本的18列周期表的讲义版,此版在美国的学校广为流传。到了1930年代,戴明的周期表已经出现在诸多化学手册和百科全书中。萨金特-威尔奇科技公司(Sargent-Welch Scientific Company)也将此版本发行多年。
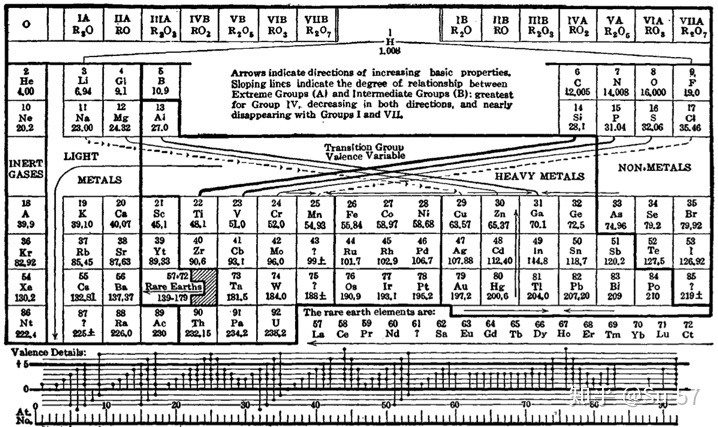
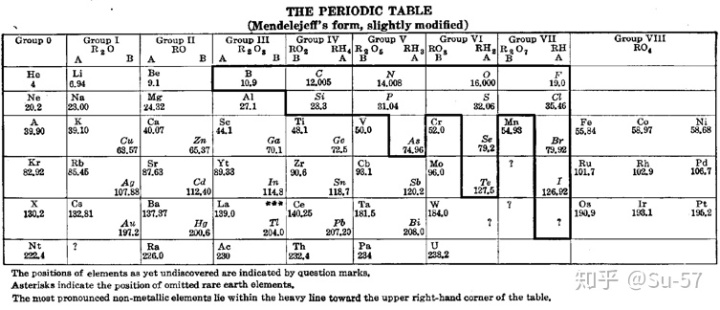
随着现代量子力学对原子内电子排布理论的发展,这包括1900年德国著名物理学家和量子力学重要创始人马克斯∙普朗克根据黑体辐射实验提出的量子学说,1905年犹太裔瑞士物理学家阿尔伯特∙爱因斯坦为解释光电效应实验提出的光子学说,1913年玻尔为解释氢原子光谱实验提出的玻尔理论把量子化条件引入原子结构中;1927年美国人戴维森与革末成功做了电子衍射实验证实,1923年法国理论物理学家路易∙维克多∙德布罗意提出实物微粒的波粒二象性,以及1926年奥地利理论物理学家埃尔温∙薛定谔提出对实物微粒运动的统计解释,1927年德国物理学家维尔纳∙卡尔∙海森堡提出微粒运动遵循的测不准关系;电子排布的能量最低原理、洪特规则(Hund′s rule)、泡利不相容原理(Pauli exclusion principle),斯莱特规则(Slater′s rules)和徐光宪规则(Guangxian Xu′s rules),以及鲍林近似能级顺序图(Pauling′s approximate energy-level diagram)和科顿能级图(Cotton′s energy-level diagram),推论出表中每个周期实际对应着电子层的电子填充。较大的原子有更多的电子亚层,因此后来的周期表需要更长的族表示元素。
1940年以前,铀元素始终处于周期系的末端。以往,人们在化学上用“超铀元素”泛指原子序数在92以上的重元素。1944年,美国著名核化学家格伦∙西奥多∙西博格根据重元素的电子结构提出了锕系理论,即在周期表中存在着与镧系元素位置相似的另一系列重内过渡元素——锕系元素,就如镧系元素一样地填充着f亚电子层。在这个构想之先,锕系元素被认为是对应填充第四行的d区壳层。他本人于1951年赢得诺贝尔化学奖,以表彰他对锕系元素合成的贡献。
超铀元素大都是不稳定的人造元素,它们的半衰期很短,这给人工合成这些元素带来困难。合成它们的大致方法是:较轻的超铀元素(从Z=93的镎到Z=100的镄)可以用中子俘获法(反应堆稳定中子流或核爆炸)来获得。Z>100的元素要用耗费巨大的加速器重离子轰击(如直线加速器将重粒子束最大能量达每个核子10.3MeV,回旋加速器为8.5MeV)来制备(即带电粒子核反应法)。1939年,人类成功合成第一个超铀元素:镎。由于许多超铀元素非常不稳定且很快衰变,所以即使成功合成,探测和描述其性质就是很大的挑战。此外,因为首个发现某元素的一方拥有对该元素的命名权,人们对某些新元素的发现顺序存在争议,需要第三方的独立审查。最新发现的一个元素是在2010年俄罗斯莫斯科州的杜布纳,一个美俄联合科学团队声明合成六个Tennessine(117号元素)原子。117号元素和113号元素、115号元素以及118号元素是最新命名的四个元素,2016年11月28日,这四个新元素的命名都得到官方认可。
现存争议
IIIB族与第6、7周期上的元素:尽管钪和钇一直都是第三族元素的前两个,接下来的所属两个元素仍有待商榷。一般认为它们是镧和锕,但有时是镥和铹。这是因为历史上将镧系元素在表中位置一直无法确定,加上f区元素的范围一向存在争议。第三种排列方式将镧系元素和锕系元素放在钇下面的两个位置。
已经有化学和物理论据提出来支持镥和铹要置于这两个位置,2015年12月,国际纯化学和应用化学联合会成立了一个项目,并建议那个位置要么是镧和锕,要么是镥和铹。
镧与锕:镧和锕通常被描述为剩余的第3族元素。研究指出这种布局起源于20世纪40年代,其排列依据是元素的电子构型和区分电子的概念。铯、钡和镧的构型是
在化学行为方面,以及第3族关于熔点,电负性和离子半径等性质的趋势,钪、钇、镧和锕类似于它们的1-2族对应物。在该变体中,f区块元素的最常见(三价)离子中的f电子的数量始终与它们在f区块中的位置匹配。例如,前三个f-区元素的三价离子的f-电子计数是Ce为1,Pr为2和Nd为3。
镥与铹:在其他表格中,镥与铹是剩余的第3族元素。早期人们用化学方法分离钪、钇和镥,其理论依据是当时人们认为这些元素一起出现在所谓的“钇族”中,而镧和锕一起出现在“铈族”中。因此,在20世纪20、30年代,一些化学家将镥而不是镧归入第3族。此外,20世纪50、60年代的一些物理学家将镥的物理性质与镧互相比较后,也认为这个位置应当属于镥。由于镧没有f电子,因此一些学者反对将镧定为f区的第一个元素。但是也有人认为,元素周期表其他的一些位置也有不合规律的排列方式,因此这个问题没有意义——例如,钍尽管没有f电子,但它还是f区的一部分。至于铹,其气相原子电子构型在2015年被确认为
在化学上,钪,钇和镥(可能也有铹)表现得像1-2族金属的三价形式。另一方面,元素的熔点,电负性和离子半径等性质下降的趋势与4-8族相似。在该变体中,f区原子的气态形式中的f电子的数量通常与它们在f区中的位置相匹配。例如,前五个f区元素的f电子计数是La为0,Ce为1,Pr为3,Nd为4和Pm为5。
镧系与锕系:一些学者将镧系和锕系的所有30个元素都放在了钇下面的两个位置(通常通过脚注标记)。这一排列方式强调了15种镧系元素化学性质的相似性,规避了“具体把哪两个元素放在钇下面”的问题,但会导致f区块有15列宽(f区任意一行中只能有14个元素)。
过渡元素:按照IUPAC的定义,过渡金属(即过渡元素)是指其原子或阳离子含未充满的d亚层的元素。 此定义下,第3~11族的元素是过渡金属,而第12族的锌、镉、汞和鿔不是。
部分化学家认为“d区元素”和“过渡金属”是同义词。按此定义,过渡金属包括3~12列的所有元素。这时12族的元素就成了过渡金属中的特例——他们的d电子通常并不参与成键。2007年,有报告称在四氟化汞(
还有部分化学家将第3族元素从过渡金属的定义中排除出去,其理由是第3族元素所形成的阳离子的d亚层全是空的(而典型的过渡金属则有部分填充),因此第3族没有表现出过渡金属特有的化学性质。此时只有4~11族被视为过渡金属。尽管3族元素的化学性质与典型的过渡金属不尽相同,他们的物理性质却较相似。(因其每个原子上有且仅有1个d电子)
化学性质未知的元素:118号及其之前的元素均已发现,然而目前为止,在108号之后的10个元素中,科学界只对112号、113号和114号的化学性质略知一二,而112号是唯一足够了解、可以进行归类的元素。其他元素可能因相对论效应而表现出与目前的预测(用外推法得到)不同的性质。例如,尽管 位于碳族,它被预测拥有与稀有气体类似的性质。但目前的观测尚不能确定 的性质更接近金属还是稀有气体。
元素周期表可能存在一个上限:超重元素指原子序数大于等于104号的元素,它们的6d亚层被填入电子。对超重元素进行合成方面的研究有助于探索原子核质量存在的极限,最终确定化学元素周期表的边界,同时也是对原子核壳模型理论正确与否的实际检验。根据核结构的“液滴模型”,当质子增加时核内的凝聚力不再能平衡库仑斥力,重元素的稳定性降低,原子核迅速分裂,形成了一个不稳定的核素海洋。然而,按原子核“壳层模型”预期,一个后于双幻数铅同位素
稳定岛理论是核子物理中的一个理论推测,核物理学家推测原子核的质子数和中子数为“幻数”的超重元素会特别稳定。假如这个猜测正确的话,那么某些特定的超重元素的同位素将比其他同位素更稳定,这些同位素的放射性衰变过程可能会相对非常慢。
稳定岛理论最初是格伦·西奥多·西博格提出的。他认为原子核中的核子与原子核外的电子一样是分布在不同的“壳层”中的,实际上每个壳层就是一组相近的量子能级。不同壳层之间的能量差则比较大。假如一个原子核中的质子和中子正好填满一个壳层的话,那么每个核子之间的结合能就会达到最大,因此这个原子核就最稳定,比其附近核子没有填满或超出一个壳层的同位素要稳定。
饱和的壳层的中子和质子数被称为“幻数”(也称为“魔数”),中子和质子数同时为幻数的原子核被称为“双幻核”。一个可能的中子魔数是184,可能的质子魔数是114、120和126,也就是说,
处于稳定岛的元素非常可能依然是放射性元素,只是它们相对于其附近的同位素比较稳定,虽然有人怀疑有些同位素的半衰期可能大于一日或甚至更长,但也可能小于一秒,而在目前发现的元素中,
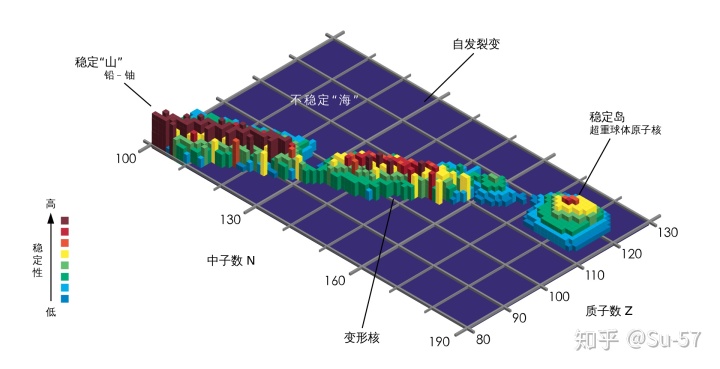
理论上超重核素的半衰期最长可达10-15年。为了跨过不稳定核素的海洋真正登上稳定岛,科学家采用重离子作为入射粒子有效地引发了合适的核反应。现在,104-118号元素皆已被成功合成,并得到了IUPAC的承认和命名,七个周期的元素周期表已经完整。但是,确切地说目前只是刚刚踏上超重元素稳定岛的边缘地带,还没有完全进入稳定岛。
1969年,约翰内斯∙格鲁门等认为下一个超重稳定岛将以164为中心,超重核的寿命为几分钟,甚至可长达若干年。这样不但可以完成元素周期表的第七周期,还可填充5g-6f超锕系和6g-7f新超锕系两个内过渡系(各32种元素),完成每周期50种元素的第八、九超长周期,直至Z=218。应该说,这是一个带有幻想式的大远景周期表。
俄罗斯联合原子核研究所的官员透露,俄研究人员将联合美国科学家,尝试合成元素周期表里的第119号元素(暂定名为Uue)的实验。有人认为它应是碱金属钫下方的元素,可称为类钫,甚至推测了它的性质。然而相对论效应使这一结论存在着一些不确定性。合成Uue的首次尝试发生在1985年:科学家在美国加州伯克利的超重离子直线加速器(super HILAC)中用钙-48轰击锿-254,结果未鉴别出任何原子。因而其收率限制为300nb
这一反应选择了
周期表的后续扩展:目前的元素周期表中有七个周期,并以118号元素Og终结。如果有更高原子序数的元素被发现,则它将会被置于第八周期、甚至第九周期。这额外的周期预期将会比第七周期容纳更多的元素,因为经过计算新的g区将会出现。g区将容纳18个元素,各周期中均存在部分填满的g原子轨道。这种拥有八个周期的元素表最初由格伦·西奥多·西博格于1969年提出。第八或以上周期的元素未曾被合成或于自然发现。g区内第一个元素的原子序数应该为121(Ubu)。根据IUPAC元素系统命名法命名为Unbiunium,符号Ubu。此区域内的元素很可能高度不稳定,并具有放射性,且半衰期极短。然而稳定岛理论预测126号元素Ubh会在稳定岛内,不会有核裂变,但会有α衰变。而稳定岛以外还能存在多少物理上可能的元素至今仍没有结论。根据量子力学对于原子结构解释的轨道近似法,g区会对应不完全填满的g轨道。不过,自旋-轨道作用会削弱轨道近似法所得结果的正确性,这可能会发生在较大原子序的元素上。
原子序数最大的元素:我们仍不知道存在多少物理上可能的元素。光速限制了电子在更大电子层中运行,因此电中性原子的原子序最大可达到173(Ust);缺少部分或全部核外电子的原子核则有可能达到更重的水平,但这样的原子核根据核外电子排布分区将变得无意义;核壳层模型则限制离子状态的元素最大至210号。不过,有研究认为周期表有可能在更早的地方就结束了,或许就在稳定岛之内,代表元素的数目将为大约126个。另外,元素表及核素表的扩展也受质子滴线和中子滴线的限制。
玻尔模型:理查德·费曼指出,根据玻尔模型,原子序大于137的元素,其内层轨道可能电子无法稳定存在,因为在1s原子轨道中的电子的速度v计算如下
当中Z是原子序,α是描述电磁力强度的精细结构常数。在这个计算中,任何原子序高于137的元素的1s轨道电子速度计算结果会比光速c还大,因此任何不建基于相对论的理论(如波尔模型)不足以处理这种计算。
若将其结果转化为动量
对于任意高的p,我们可以找到满足该等式的v<c。且电子的速度与原子核存在与否无关,因此此计算矛盾并不意味着Uts会是元素周期表上的最后一个元素.
相对论性狄拉克方程:相对论的狄拉克方程可以计算出原子的基态能量:
其中,m为电子静止质量、c为光速、Z为质子数、α为精细结构常数。
以
当质子数为138或更大时,根号中将会出现负值,导致其值不是实数,因而导致狄拉克基态的波函数是震荡的,并且正能谱与负能谱之间没有间隙,正如克莱因悖论所言.




 元素周期表的发展始于18世纪末,拉瓦锡定义了元素概念并初步分类。19世纪中叶,道尔顿提出原子论并制定原子量表,接着德贝莱纳发现三元素组定律,门捷列夫提出元素周期律并发表第一张周期表。20世纪初,量子力学的发展完善了元素周期表,现代形式由戴明确定。超铀元素的发现和稳定岛理论拓展了周期表的边界,目前元素周期表仍在理论和实验中不断探索和完善。
元素周期表的发展始于18世纪末,拉瓦锡定义了元素概念并初步分类。19世纪中叶,道尔顿提出原子论并制定原子量表,接着德贝莱纳发现三元素组定律,门捷列夫提出元素周期律并发表第一张周期表。20世纪初,量子力学的发展完善了元素周期表,现代形式由戴明确定。超铀元素的发现和稳定岛理论拓展了周期表的边界,目前元素周期表仍在理论和实验中不断探索和完善。
















 1668
1668

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








