通过微流控芯片将肠道、肝小叶与肾小管模型连接形成生理级联通路,结合大数据分析可显著提升药物研发效率和预测精度。以下从技术实现和大数据价值两个维度解读:
一、微流控级联模型的技术实现
-
肠道模型
Caco-2细胞或类器官在微流控芯片中可形成具有绒毛结构和黏液分泌功能的肠上皮屏障。例如:- 通过流体压力和机械拉伸模拟肠道蠕动,促进绒毛结构形成;
- 集成胶原支架增强细胞色素P450 3A4活性,提升药物代谢功能;
- 与杯状细胞(HT29-MTX)共培养,实现黏液层动态分泌。
-
肝小叶模型
HepG2或原代肝细胞通过以下方式模拟肝脏代谢:- 与Kupffer细胞共培养,重建肝窦结构并维持细胞色素P450酶活性;
- 微流控动态灌注提升代谢效率(如环磷酰胺代谢活性比静态培养提高40%);
- 3D凝胶培养技术复现肝小叶空间结构,增强药物-肝细胞相互作用。
-
肾小管模型
HK-2细胞在芯片中模拟肾小管功能:- 开放腔室与Gelrin ECM结合,形成肾小管上皮细胞极性结构;
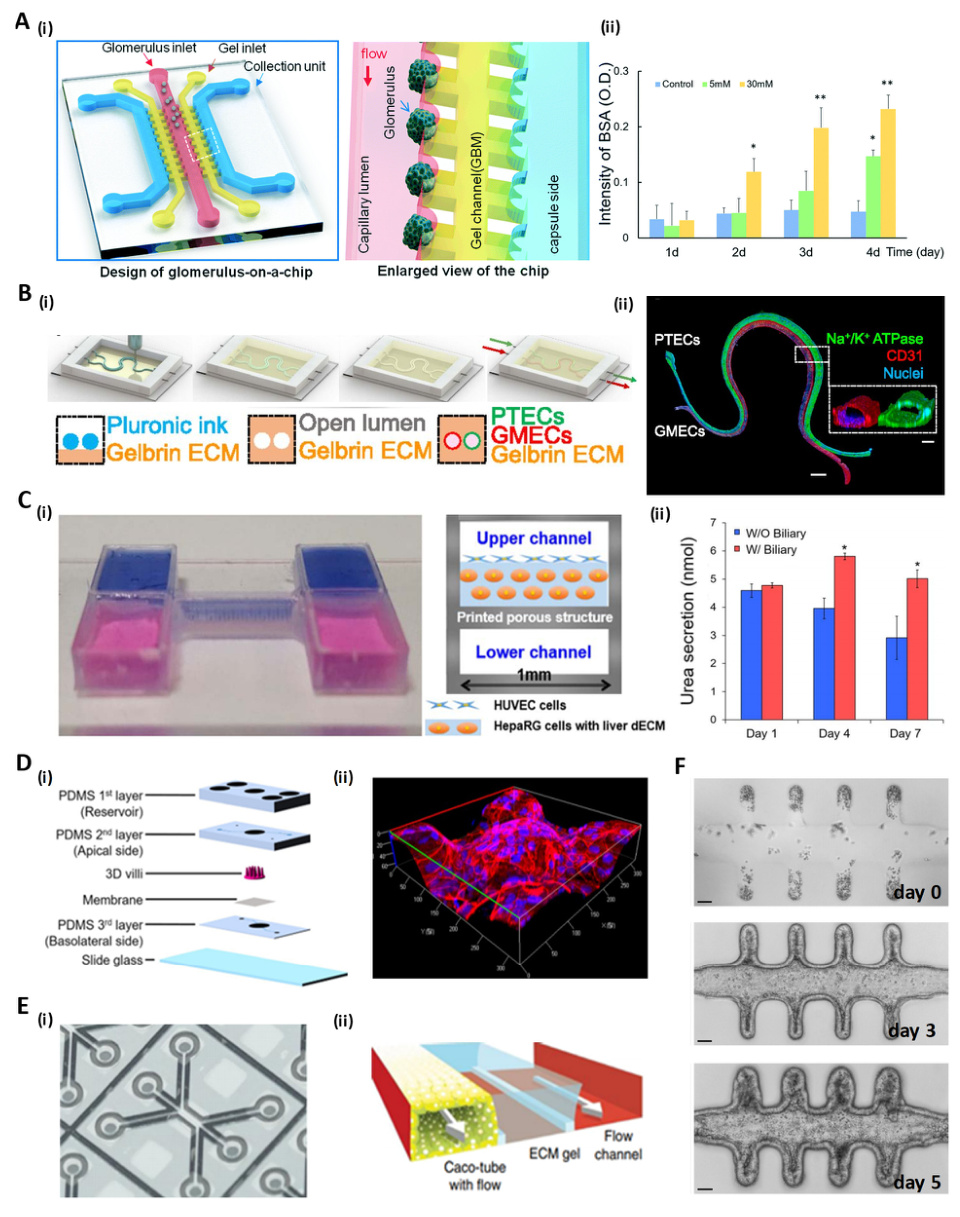
- 通过微通道连接实现代谢产物的滤过与排泄。
- 开放腔室与Gelrin ECM结合,形成肾小管上皮细胞极性结构;
-
级联整合
- 通过公共循环通道模拟血液循环,实现跨器官动态物质交换(如普萘洛尔的吸收-代谢-排泄全过程监测);
- 多器官芯片(如肠-肝-肾四器官模型)可同步检测CYP3A4活性、尿素浓度等生理指标;
- 模块化设计允许灵活组合器官模型,适应不同研究需求(如肠-肝-乳腺癌芯片用于抗肿瘤药效评估)。
二、大数据角度的价值挖掘
-
多维数据采集
- 实时监测药物浓度、代谢产物、细胞活力(如芯片中HepG2的生存能力与代谢活性动态关联);
- 高通量获取屏障渗透性(TEER值)、酶活性(P450)、基因表达等参数。
-
模型优化与验证
- 通过机器学习分析跨器官药代动力学(PK)数据,优化剂量-效应关系(如紫杉醇在芯片中的IC50与临床数据高度吻合);
- 对比动物实验与芯片数据,建立体外-体内相关性(IVIVC)模型,减少临床试验失败率。
-
毒性预测与机制解析
- 整合肝毒性(ALT释放)、肾损伤(KIM-1表达)等多器官数据,构建毒性预警系统;
- 聚类分析揭示器官间相互作用(如肠道吸收效率对肝代谢负荷的影响)。
-
个性化医疗应用
- 结合患者来源类器官与基因组数据,预测个体化药物响应(如类器官芯片用于克罗恩病治疗筛选);
- 建立器官芯片数据库(如FDA认可的肝芯片数据集),支持AI驱动的药物重定位。
三、挑战与前景
当前瓶颈包括器官体积比标








 最低0.47元/天 解锁文章
最低0.47元/天 解锁文章



















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










