摘要:神经元回路的空间布局对其功能特性具有不可或缺的作用,因为神经元的特定位置往往与其承担的功能紧密相关。在探索小脑功能的奥秘时,我们注意到小脑皮层的主要输出信号源自于Purkinje细胞至小脑核神经元的突触连接,然而,关于这些突触连接在空间上的具体布局,我们的了解尚显不足。为了填补这一知识空白,我们在急性矢状小脑切片上巧妙地运用了全细胞电生理学和光遗传学技术,深入剖析并绘制出了小鼠小脑皮层输出的详尽空间连接图谱。实验结果显示,Purkinje细胞的输入并非随机散布于小脑横区,而是呈现出明显的聚集特征:尽管众多核神经元仅接收来自某一特定区域的输入,但我们同样观察到了跨越多个小脑带的复杂连接模式。尤为值得注意的是,在我们的数据中,存在一类显著过度代表的神经元,它们能够接收来自小脑所有四个主要区域的输入。这一发现不仅揭示了小脑皮层输出在空间维度上的结构化特征,还强有力地支持了小脑作为多模态信息整合中枢的重要地位,为小脑功能的全面理解提供了新的视角和证据。
1. 引言
神经元间的相互连接编织成错综复杂的回路,这些回路正是塑造大脑功能的核心。为了深入理解这些电路的工作机制,明确这些连接的组织模式至关重要。小脑,作为一个高度保守且功能复杂的结构,广泛接收来自大脑多个区域的输入信息。在小脑皮层中,Purkinje细胞以小叶为单位组织起来,而神经影像学研究与疾病模型均揭示,小脑皮层不同区域的Purkinje细胞专门处理着不同类型的信息,这进一步凸显了它们功能的特异性。
作为小脑皮层的唯一输出门户,Purkinje细胞的轴突精准地靶向小脑核(CN)中的神经元,这些神经元不仅具有强烈的抑制性突触连接,还构成了小脑输出信号的主要来源。先前的研究已经揭示,每个CN神经元都能汇聚来自约40个Purkinje细胞的输入,且这些Purkinje细胞在解剖学上呈现出窄带会聚的特征,即相邻的Purkinje细胞倾向于将它们的轴突投射到CN中的相似区域。然而,尽管Purkinje细胞-CN神经元突触在小脑信息处理中扮演着核心角色,但关于Purkinje细胞如何在空间上汇聚至CN神经元的具体功能机制,我们仍知之甚少。
为了填补这一知识空白,我们深入研究了Purkinje细胞对CN神经元输入在矢状面内的空间组织模式。我们特别关注了小脑的顶核,因为这个核团主要接收来自小脑蚓部的Purkinje细胞输入,且能够在急性切片实验中较好地保存下来。通过结合电生理学与局灶性光遗传学刺激技术,我们成功地绘制出了Purkinje细胞输入到顶核内单个CN神经元的空间连接图谱。我们的研究结果显示,CN神经元的Purkinje细胞输入遵循着小脑发育过程中定义的四个横向区域组织模式。值得注意的是,虽然许多CN神经元主要接收来自单一区域的Purkinje细胞输入,但也有一部分神经元能够汇聚来自多个区域的Purkinje细胞输入,且这种汇聚并非随机发生。
为了进一步验证我们的功能发现,我们对来自不同区域的Purkinje细胞进行了病毒标记,并观察到它们的轴突在CN内紧密相邻地终止,这一发现为我们的功能数据提供了有力的解剖学支持。此外,我们还通过细胞附着和全细胞记录技术,研究了单个CN神经元在接收Purkinje细胞突触输入时的输出响应。我们的实验结果显示,即使是微小的突触输入也能显著地影响CN神经元的输出特性,这表明Purkinje细胞的输入可能无需完全同步即可对CN神经元的输出产生有效调控。
综上所述,我们的研究不仅揭示了Purkinje细胞对CN神经元输入在矢状面内的空间组织模式,还强调了CN神经元作为小脑内信息整合关键位点的重要性。这些发现不仅为我们深入理解小脑的信息处理机制提供了新的视角和证据,也为未来针对小脑相关疾病的治疗干预策略提供了重要的理论依据。
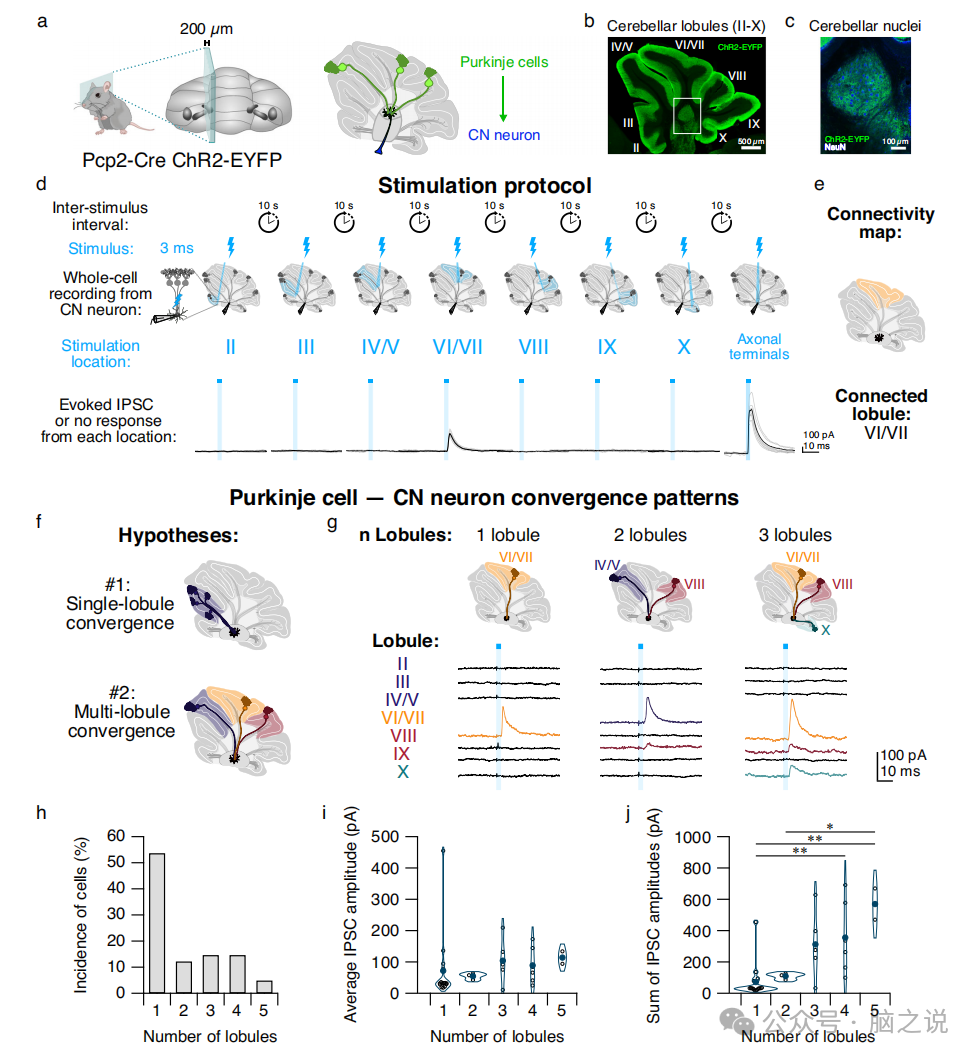
图1 小脑核CN神经元接收单小叶和多小叶输入
2. 结果
2.1 将Purkinje细胞输入映射到 CN 神经元
为了构建Purkinje细胞向CN神经元趋同的功能连接图,我们使用在Purkinje细胞中表达修饰的Channelrhodopsin-2的转基因小鼠(图la-c)。为了确定光在组织中的传播,我们对Purkinje细胞在同一小叶和相邻小叶中受刺激的轴突进行了对照记录,发现对Purkinje细胞相邻小叶的刺激不会引起Purkinje细胞的活性,与我们之前的发现一致。在确认了我们的刺激的空间限制之后,我们在电压钳配置下记录了CN神经元,并使用聚焦蓝光刺激单个小叶底部的Purkinje细胞轴突,顺序从小叶II到X(图1d),以激发CN神经元中的抑制性突触后电流(IPSCs)。在CN神经元中,对单个小叶的刺激通常不能引起突触反应(图1d),但偶尔观察到具有快速上升和衰减时间常数和低故障率的IPSC(图1d),这与先前关于Purkinje细胞- CN突触在顶核主要兴奋性神经元上的描述一致。通过用局部受限光顺序刺激单个小叶,我们确定了Purkinje细胞和CN神经元之间功能连接的位置,这使我们能够构建Purkinje细胞在单个CN神经元上趋同的连接图(图1d, e)。作为阳性对照,我们将光照射在Purkinje细胞轴突末梢上,直接围绕着修复的CN神经元体,并能够产生大的IPSCs。我们发现大约一半的CN神经元没有接收到来自切片内小叶刺激的突触输入,这表明它们接受来自刺激区外的Purkinje细胞的输入,并且可能接受来自切片附近的Purkinje细胞的输入。
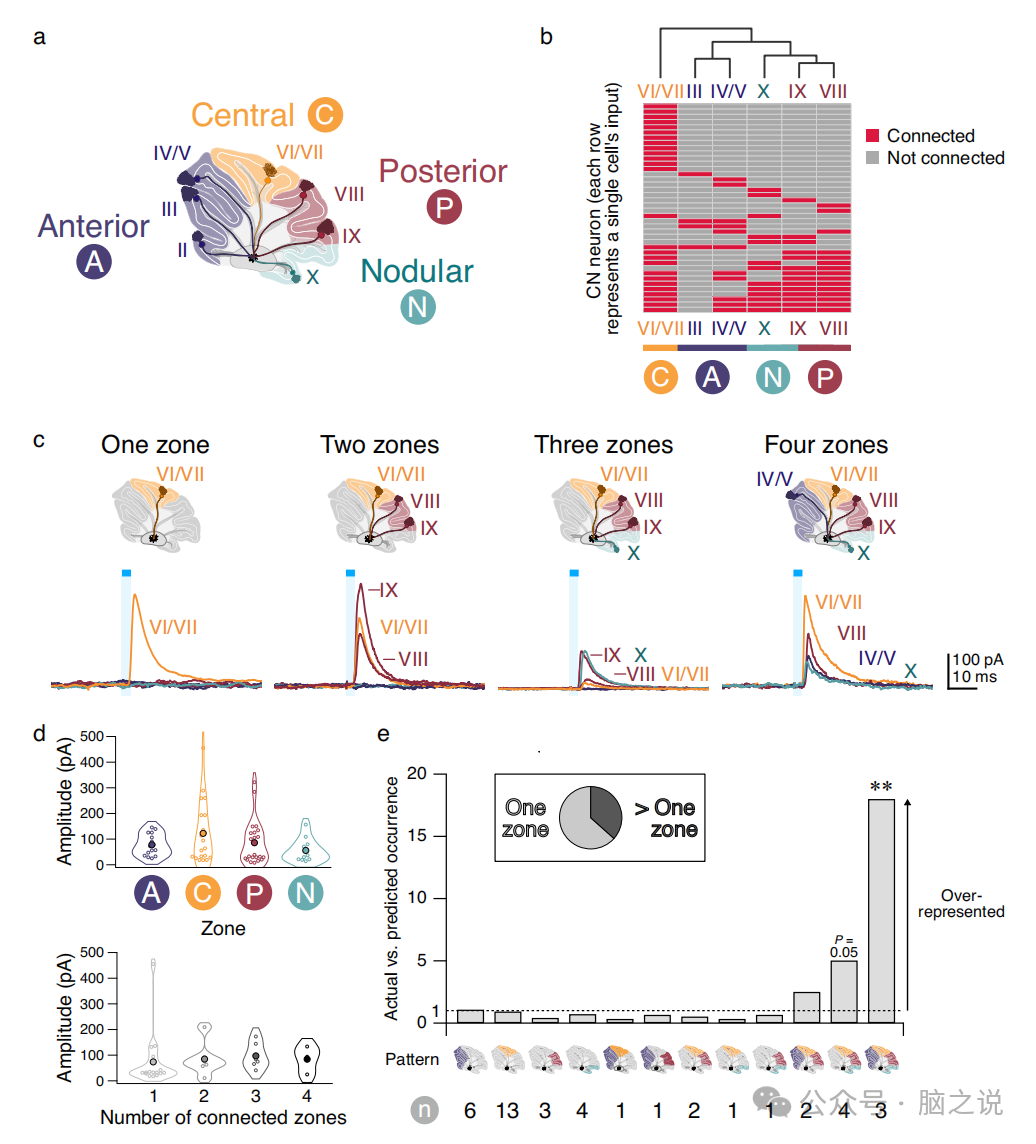
图2 Purkinje细胞——CN 神经元连接不是随机的
确定来自单个小叶或多个小叶的Purkinje细胞是否会聚在单个CN神经元上对小脑功能具有重要意义。我们发现,在小叶刺激后产生IPSCs的-50%的CN神经元接受来自位于单个小叶的Purkinje细胞的输入(图1g),而剩余的-50%的CN神经元接受来自两个到五个小叶的Purkinje细胞输入(图1h)。我们观察到,与接受多小叶输入的CN神经元相比,单小叶刺激的IPSC振幅没有差异,表明空间上不同输入的总数不会影响来自单个小叶的连接强度。此外,通过小叶的总输入的累积IPSC振幅随着细胞接收输入的小叶数量的增加而增加(图1j)。为了确定Purkinje细胞输入到CN神经元的亚细胞位置是否存在差异,我们检测了IPSC振幅和上升时间的差异指数。我们发现,基于连接小叶的数量,单个CN神经元的IPSCs的特性没有差异。这些发现表明,在CN神经元上的Purkinje细胞收敛过程中,观察到单小叶和多小叶神经支配模式。
解剖学上定义的小脑皮层小叶不是离散的处理单元。相反,小脑皮层在矢状面内被细分为四个主要的横向功能区:前区、中央区、后区和结节区(图2a)。由于逆行标记实验表明,CN神经元接收来自邻近Purkinje细胞窄带的输入,我们想知道在汇聚到CN神经元上的不同小叶的输入之间是否存在任何模式。为了解决这个问题,我们对连接数据执行了无监督的分层聚类分析。我们观察到,同一功能区小叶中的Purkinje细胞比跨功能区小叶中的Purkinje细胞更经常地聚集在同一个CN神经元上(图2b)。这表明Purkinje细胞输出倾向于尊重小脑皮层功能区的边界,为横带在小脑信息编码中的功能意义提供了额外的证据。
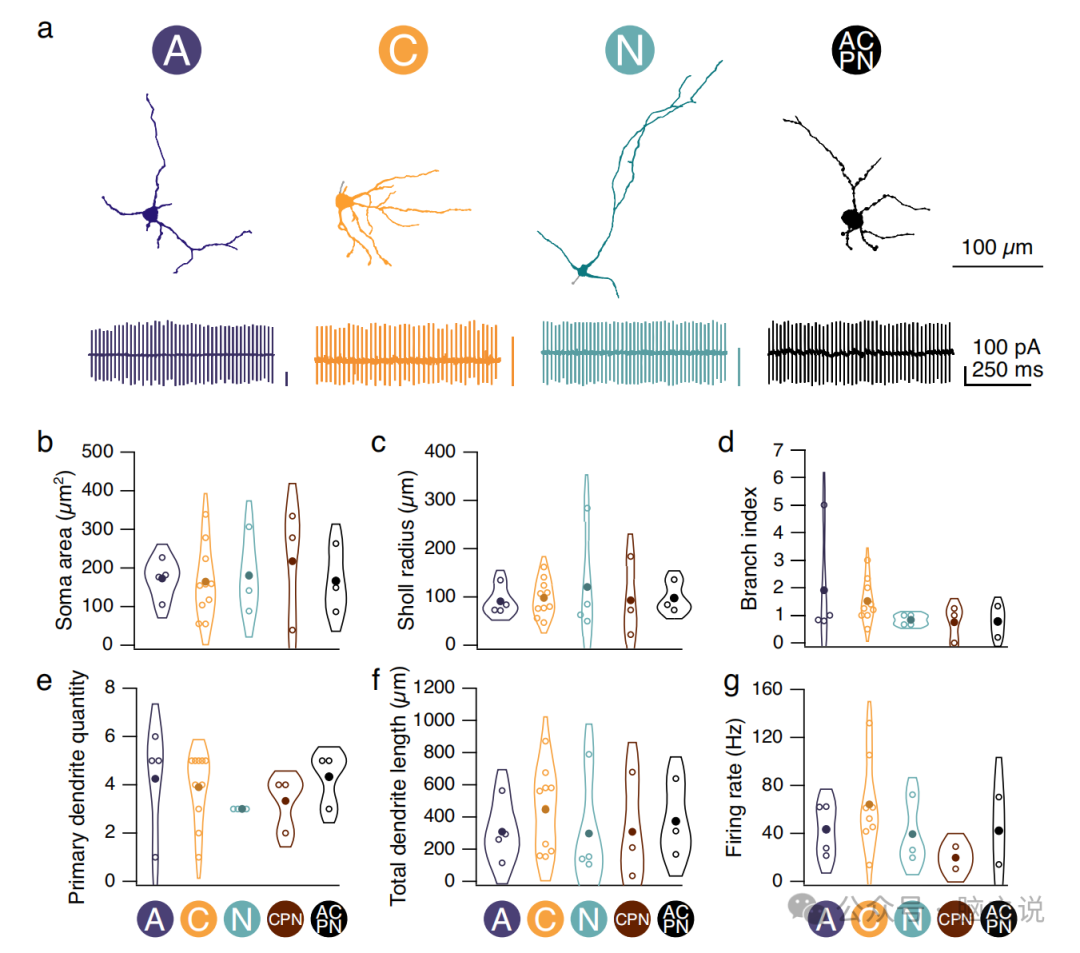
图3 具有不同输入连接模式的 CN 神经元在形态上相似
2.2 Purkinje细胞中的连接基序输入到 CN 神经元
接下来,我们选择从横向带的角度更仔细地观察连接模式,并观察到单区和多区收敛(图2c)。我们观察到不同区或不同区数支配的CN神经元在IPSC振幅或其他特性上没有差异(图2d),表明不存在对CN神经元形成系统更强输入的区域。我们发现多区域输入并不罕见:超过三分之一的中枢神经网络接受多区域输入(图2e)。在我们的数据集中,不同的连接模式以不同的频率出现,表明存在非随机连接基序。
为了确定Purkinje细胞是否在非随机模式下跨区域聚集在单个CN神经元上,我们使用了一个随机模型,该模型假设Purkinje细胞从每个区域的连接独立于其他区域发生,并确定它如何很好地描述我们的数据(图2e)。我们发现,在我们的数据集中,4区收敛发生的频率是模型预测的18倍,并且3区连接也趋向于显著的过度代表。这种过度表征表明,4区连接基序可能是小脑信息传递的一个重要特征,并由此延伸,CN可能是小脑信息整合的一个重要位点。
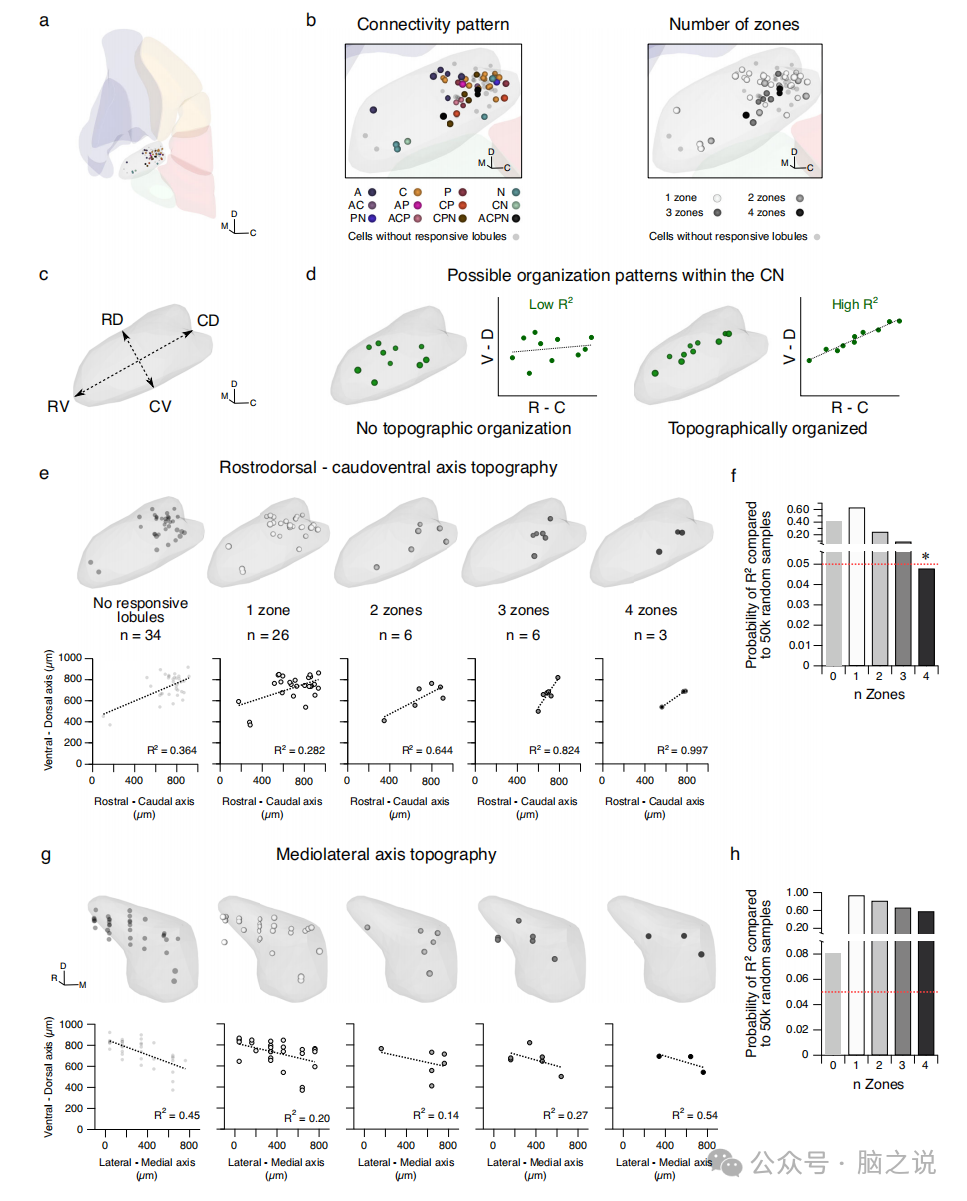
图4 接收来自所有四个区域的输入的 CN 神经元沿前腹侧-尾背轴偏向
2.3 不同输入模式下的神经网络神经元没有形态特征
不同类型的神经网络神经元通过其形态和生理特性来区分。为了确定形态特性的差异是否可以用于分类具有不同连接模式的CN神经元,我们用AlexaFluor 594填充CN神经元,并在表征其突触输入后对填充细胞进行双光子成像(图3a)。为了表征它们的生理特性,我们在记录突触输入之前,在细胞附着模式下对它们的自发放电进行了采样(图3a),发现对于具有不同连接模式(图3b-g)或输入区数量的CN神经元,这些属性是无法区分的。因此,我们观察到,不同类型输入的CN神经元不能通过其形态或生理特性来区分。
接下来,我们想知道CN神经元树突的方向是否与其Purkinje细胞输入的位置有关。我们发现大多数细胞至少有一些树突指向Purkinje细胞输入,但这通常是树突树的一小部分。随着连接到给定CN神经元的区域数量的增加,树突-区域重叠的数量也会增加,这可能是由于来自多个小叶的输入方向覆盖的面积更大,这表明CN树突的方向不受其输入的影响。我们也没有观察到IPSC振幅或上升时间与重叠程度之间的关系,这表明树突不是优先定向的。
CN先前已被描述为表现出与CN神经元突触后目标相对应的地形组织。我们想知道CN神经元是否也根据其输入连接模式显示地形组织。使用来自Allen小鼠脑图谱的坐标,我们在正态CN34内以3d方式可视化了我们记录的细胞(图4a)。CN神经元似乎没有通过连接模式聚集(图4b)。然而,在我们的数据中,基于输入区数量的CN神经元聚类并不明显(图4b)。为了确定是否观察到沿任何轴的地形组织(图4c, d),我们观察了具有不同数量的分区输入(图4e)的细胞的拟合。我们为接收n个区域输入的每组细胞拟合一条线。然后,我们执行自举分析,从总分布中随机抽取等量的单元格50000次。为了确定观察到的样本的拟合与我们的数据的相似程度,我们对数据中位于自举R2值分布的前5%的R2值赋予显著性。显著的R2值仅在沿轴的4区细胞中观察到一次(图4f),而在沿中外侧轴的4区细胞中没有观察到(图4g, h)。这表明4区细胞可能在顶核内显示出一些地形组织。
图5 来自不同区域的Purkinje细胞点终止于 CN 附近
2.4 来自不同区域的Purkinje细胞点在靠近的地方终止到CN神经元上
为了补充我们在单个CN神经元上多区域收敛的电生理发现,我们使用了一种解剖跟踪方法。事实上,先前的研究已经确定了来自不同小叶的Purkinje细胞纵向条纹的解剖收敛性。通过立体定向手术,将多达3种表达不同荧光团的腺相关病毒注射到成年阴性小鼠的不同小脑区,以标记Purkinje细胞及其轴突。这使我们能够从CN内不同位置可视化Purkinje细胞的轴突和终末(图5a)。我们发现来自不同区域的Purkinje细胞(图5b, c)在细胞核内的投射模式(图5d)显示出明显的差异,正如之前报道的。然而,在CN的许多地区,我们观察到来自不同区域的近距离点(图5e)。事实上,来自一个区域的Purkinje细胞的-20%的小点位于来自不同区域的小点的17.5 um内,这是我们测量的CN体细胞平均直径(图5f),>85%的小点位于100.5 μm内,这是我们数据集中CN树突的平均长度(图5f)。使用免疫组织化学,我们证实许多小点表达了水疱GABA的标记物。
图6 来自单个小叶的小输入足以改变 CN 输出
2.5 同时激活单区Purkinje细胞输入足以暂停CN神经元
研究表明,Purkinje细胞输入同步是影响CN神经元输出的必要条件。我们的观察表明,多个神经元区集中在单个CN神经元上,这提出了一个问题,即是否需要跨功能区同步来影响小脑输出。为了探索这一点,我们记录了自发活动的CN神经元子集的动作电位(图6a, b),然后进入电压钳配置进行IPSC记录(图6c),并如上所述刺激Purkinje细胞轴突。这使我们能够测量Purkinje细胞刺激对CN放电的影响以及同一CN神经元内的突触反应。我们在光脉冲后立即测量了CN神经元的峰间间隔(ISI),作为每个有规律放电的CN神经元每次试验平均ISI持续时间的比率(图6d)。我们发现,在刺激与CN神经元相连的小叶后,ISI比率通常高于未与CN神经元突触相连的小叶(图6e)。我们还发现,IPSC幅度与ISI比率正相关(图6f),其中小输入产生小停顿,大输入产生大停顿。虽然小叶刺激可能激活多个Purkinje细胞轴突,因此可能反映多个同步输入,但即使是- 60pa范围内的小输入也足以暂停CN放电,从而影响小脑输出。
3. 讨论
我们的研究结果揭示了顶状核中的CN神经元如何接收来自小脑多个矢状位置的Purkinje细胞的输入,并表明CN神经元是小脑整合的一个被忽视的位点。利用电生理学结合Purkinje细胞输入的局部光遗传刺激,我们将输入的空间模式映射到矢状面内的CN神经元上。我们发现Purkinje细胞的输入倾向于在小脑皮层的横向区域内聚集,大约三分之二的CN神经元接受单区域输入。然而,一些CN神经元接收来自多个区域的输入。从所有四个功能区接收输入的细胞比随机模型预测的要多,并且这些4区细胞在地形上似乎位于CN的轴的中线附近。为了证实这些发现,我们使用立体定向病毒表达多种荧光蛋白来提供形态学证据,证明来自不同功能区的Purkinje细胞的点靠近CN内其他区域的点。最后,我们发现小的突触输入可以暂停CN神经元,这表明广泛的Purkinje细胞同步可能不是影响CN神经元输出的必要条件。综上所述,我们的研究结果表明,CN神经元是动态计算单元,对小脑整合的贡献比以前所认识的要大。
我们研究的局限性之一是连通性仅限于矢状面切片制备厚度内的轴突。虽然体顶神经元以空间受限的方式接受蚓部的大部分输入,但这表明我们报告的连接模式对应于一个下限,并且由于错过输入,一些多区细胞可能被错误地分类为单区细胞。值得注意的是,树突树的大小在具有不同数量的带状输入的细胞之间没有差异,这表明这不是切片制备的系统伪影。因此,尽管我们发现4区连通性被过度代表,但我们可能仍然低估了这些细胞在CN中的患病率。
我们观察到,基于小脑皮层功能性横区对 CN 神经元簇的输入强调了小脑区域组织的重要性。我们观察到,从Purkinje细胞接收 4 区输入的 CN 神经元的观察量高于均匀随机模型的预期。多区收敛到 CN 神经元表明多模态集成和输出的站点以前未知。这种多模式整合之前在颗粒细胞中小脑的输入水平已经观察到,这也是Purkinje细胞的一个特征,它将大量输入整合到其广泛的树突状树中。然而,目前尚不清楚 CN 是否发生了多式联运整合。
4 区 CN 神经元在我们的数据集中被过度代表,但仍然只占网络中总细胞的一小部分。由于许多轴突在切片制备中被切割,因此我们的数据代表了它们在韧骨核中普遍性的下限,而不是上限。这种高度连接但稀疏的神经元如何在 CN 中发挥作用?文献中有几个例子表明,高度互连但稀疏的神经元在大脑中发挥着强大的作用,包括发育中的海马体中驱动同步网络活动的枢纽神经元,并触发新皮层中的神经元。未来探索多区 CN 神经元的功能影响将非常重要,这些神经元可能在小脑回路中充当“整合神经元”。
尽管有人提出 CN 是从保守细胞类型的复制事件进化而来的,我们在 Fastigial 核中观察到的连接模式可能与在中间核和齿状核中观察到的连接模式不同。造成这种情况的原因可能是每个细胞核不同的三维特征,以及它们不同的下游靶标。最近,Wang 及其同事在快核中发现了一类 CN 神经元,它们在下橄榄核中的神经元上产生兴奋性突触,而这在其他 CN 中是没有发现的。这使得确定我们在 fastigial 核中观察到的Purkinje细胞输入基序在其他 CN 中是否保守变得很重要。
最近的大量工作都集中在 CN 的不同类别的神经元上,基于它们的投射、分子表达和生理特性。我们想知道不同的 CN 神经元类别是否可能接收不同的输入基序,但无法找到这方面的证据。然而,我们无法根据连接基序检测细胞类别之间的形态或生理差异并不意味着它们不存在。虽然不同类别的 CN 神经元的放电速率等特性被描述为不同,但每个类别的放电速率分布是重叠的,这意味着需要大量数据来区分这些细胞类型。我们不太可能辨别 CN 神经元类别之间重叠分布的微小差异,因为我们为每个连接基序表征的神经元数量相对较低。然而,4 区输入细胞的地形富集沿前腹侧-尾背轴扩散,其中 4 区输入细胞紧密聚集在正交的喙背-尾腹轴上,可能对 CN 的输出电路产生影响,尽管它们似乎并不代表迄今为止确定的任何已定义的输出像元群。
CN 神经元和Purkinje细胞都以高频触发自发动作电位。关于这些突触信息传递的一种理论是,如果来自不同Purkinje细胞的输入被异步激活,则单个输入可能不足以影响 CN 输出,而同步收敛Purkinje细胞可能产生更强的输入,更可能影响 CN 输出。我们的数据表明,~60 pA 的相对较小的输入可以改变 CN 神经元输出,这小于先前估计的Purkinje细胞。以前的工作表明,在 CN 神经元上注射 ~100 pA 的超极化电流改变了自发放电率,而来自Purkinje的单个诱发抑制性突触后电位 (IPSP) 在影响 CN 放电方面不如诱发电列诱发电成功。尽管这似乎与我们的研究结果形成鲜明对比,其中单个输入会改变 CN 神经元尖峰的时间,但由于Purkinje细胞通常在体内以高频发射,因此探索以更真实频率传递的光学诱导 IPSP 对自由尖峰 CN 神经元的影响将很有趣。
鉴于我们通常在接收来自多个区域输入的单个 CN 神经元上观察到各种 IPSC 振幅,我们的数据表明,来自不同区域的输入可能会对 CN 神经元放电产生不同的影响,但较小的输入仍然可能对小脑输出产生一些影响。然而,虽然来自靶向给定 CN 神经元的收敛Purkinje细胞的同步可能不是影响 CN 神经元输出的必要条件,但由于较大的输入似乎对输出的影响更强烈,同步收敛输入可能提供更强大的方法来改变 CN 神经元输出。此外,由于 CN 神经元在体内接收的输入可能比在体外接收更多的输入,因此单个 IPSP 的影响在行为动物中可能会减弱,因此很难从我们的研究结果中推断出来。在未来的研究中,确定同步多区Purkinje细胞输入是否有必要影响体内 CN 神经元输出将非常重要,因为这将阐明 CN 信息处理在小脑中的作用。
4. 方法
4.1 动物
我们利用特定针对Purkinje细胞的Cre重组酶转基因小鼠[品系:B6.Cg-Tg(Pcp2-cre)3555Jdhu/J,简称PCP2-Cre],与携带光敏感通道蛋白视紫红质-2(ChR2)/H134R突变体上游被loxP侧翼序列包围的终止盒,并融合有增强型黄色荧光蛋白(EYFP)的转基因小鼠[品系:B6;129S-GT(ROSA)26SorTM32(CAG–COP4*H134R/EYFP)Hze/J,简称Ai32]进行杂交,成功培育出半合子PCP2-Cre/Ai32小鼠。这些小鼠在Purkinje细胞中特异性表达ChR2或其突变体ChR2(H134R)-EYFP,从而实现了对Purkinje细胞活动的光遗传学操控及可视化追踪。所有实验用小鼠均购自Jackson Laboratories,并饲养于遵循12小时光照/12小时黑暗循环(光照时段为上午7点至晚上7点,其余时间为黑暗)的环境中,室内温度维持在18°C至24°C之间,相对湿度保持在30%至70%的适宜范围内。所有动物实验均严格遵循加拿大动物护理委员会制定的伦理准则与指导原则,并获得了麦吉尔大学动物护理委员会的正式批准与监督。
4.2 急性切片制备
为了制备急性矢状切片,我们选取了共计47只小鼠(包括22只雌性和25只雄性),这些小鼠的年龄介于出生后第21天至第32天之间。在实验过程中,首先通过异氟醚对小鼠实施深度麻醉,直至其对脚趾夹捏刺激无反应,随后迅速进行斩首处理。紧接着,我们小心地取出大脑,并将其置于预先准备好的、部分蔗糖替代的切片溶液中。该溶液的具体成分包括:50 NaCl、2.5 KCl、0.5 CaCl₂、10 MgCl₂、1.25 NaH₂PO₄、25 NaHCO₃、25 葡萄糖以及111蔗糖。此溶液通过95% O₂与5% CO₂的混合气体持续鼓泡,以维持pH值在7.3左右,并确保渗透压约为320 mOsm。根据实验设计,部分切片在加热至约37°C的溶液中处理,而另一部分则在冰冷的切片溶液中操作。利用Leica VT 1200 S振动切片机,我们在加热至37°C的腔室内,对左侧小脑旁区域进行了矢状旁切片的制备,切片厚度设定为200 μm。随后,这些切片被转移至人工脑脊液(ACSF)中进行孵育,ACSF的组成(以mM为单位)包括:125 NaCl、2.5 KCl、2 CaCl₂、1 MgCl₂、1.25 NaH₂PO₄、25 NaHCO₃和25葡萄糖。ACSF同样通过气体鼓泡以维持其理化性质,渗透压也调整至约320 mOsm。在37°C的暗室中孵育30至45分钟后,切片被移至室温下继续保存,最长可达6小时。
4.3 电生理学
在实验中,我们采用了表达光敏感通道蛋白ChR2的Purkinje细胞小鼠的急性矢状切片,专门针对快小脑(即内侧)核的CN神经元进行了精细的细胞附着和全细胞膜片钳记录。为实现这一目标,我们运用了P-2拉拔器来精心拉制硼硅酸盐玻璃微电极,并填充了特制的内部溶液,其成分精确调配为:150葡萄糖酸钾、3 KCl、10 HEPES、0.5 EGTA、3 Mg-ATP,确保溶液渗透压为302 m且pH值经KOH调节至7.2。为了后续成像与形态学重建,我们还向内部溶液中添加了AlexaFluor 594荧光染料。
记录过程在SliceScope Pro 3000显微镜的精准控制下进行,利用Multiclamp 700B放大器从维持在34 °C ± 1 °C、含氧ACSF浴中的CN神经元切片中捕获数据。我们精心准备了包含左紧骨核的三张连续200 μm厚度切片,每只小鼠的总采样宽度达到600 μm,以确保数据的全面性和代表性。
为确保CN神经元采样的一致性和准确性,我们将切片统一放置于钻机浴中,并专注于记录每个切片的中外侧位置。特别地,我们注意将记录电极定位在远离光刺激区域的感兴趣位置,以排除外部干扰。对于每张切片,我们执行了系统化的逐行扫描策略,从fastigial核的最腹侧位置开始,逐步向背侧推进,直观识别并选定待修补的CN神经元。
在细胞附着记录模式下,我们从展现自发放电活动的CN神经元开始记录,直至成功转换至全细胞膜片钳配置。而对于电压钳记录,我们将CN神经元钳制在-60 mV,并持续监测静息膜电位,一旦电阻(R)波动超过20%,则立即采取相应措施。整个数据采集过程依托定制化的Igor Pro软件高效完成,确保了数据的精确性与可靠性。
4.4 光遗传学和空间映射
我们使用了带有 470 nm LED 光源的 Polygon400E 图案空间照明器,估计焦平面功率密度为 100 mW/mm2通过 40X 水浸物镜对Purkinje细胞轴突进行局部光学刺激使用 3 ms 的蓝色矩形光脉冲,试验间隔为 10 ms。为了评估细胞健康状况,我们刺激修补的 CN 神经元直接激活细胞的大部分突触输入。在 CN 神经元的一个子集中,我们通过在其他位置刺激Purkinje细胞轴突对连接进行采样。
为了评估突触输入对 CN 神经元自发放电的影响,我们在 CN 神经元中进行了细胞附着记录,并在进入电压钳模式之前如上所述依次刺激了单个小叶。我们排除了在刺激每个小叶至少一次之前突破进入全细胞模式的细胞、自发放电频率为 <20 Hz 的试验,以及以爆发而不是强直放电为标志的试验。在细胞附着模式下完成刺激方案后,我们突破并膜片钳 CN 神经元,将电压钳记录的 IPSC 与其相应的自发放电数据进行比较。
4.5 电生理数据分析
使用定制的 Igor Pro 数据分析软件分析所有电生理数据。为了评估突触电流的衰减阶段,我们使用双指数来拟合 IPSC 的衰减阶段,并通过评估指数的每个分量对峰值 IPSC 振幅的贡献来计算加权衰减 τ 时间常数。失败的比例被测量为反应性小叶未能引发 IPSC 的试验次数,而贴片仍然成功就位,由轴突末端刺激确定。对于接收来自多个小叶或区输入的 CN 神经元,我们使用差异指数或诱发的 IPSC 振幅变化系数的量度比较了单个 IPSC 之间的振幅和上升时间的差异。
4.6 识别连接模序
为了深入探究连接模式中的潜在结构特征,我们设计并执行了两项关键分析。首先,我们构建了一个精心筛选的二进制数据集,该数据集聚焦于每个CN神经元与小叶III至X(小叶II因切片完整性问题被排除在外)的连接情况,同时剔除了那些连接小叶身份未明的神经元(共计34个细胞)。这一步骤确保了数据集的准确性和分析的有效性。随后,我们采用无监督分层聚类方法,针对那些已明确功能连接的神经元(n=41)进行了深入分析。此步骤旨在揭示单个小叶内Purkinje细胞与特定CN神经元之间可能存在的潜在连接模式。我们的假设是,位于相近进化分支(如小叶IX与VIII)的Purkinje细胞,相较于位于不同分支的细胞(如小叶VI/VII与X),更可能与同一CN神经元形成功能联系。聚类结果中的叶子与进化枝长度直观地反映了小叶之间在功能连接上的相似程度,其中较短的叶子与进化枝意味着相应的小叶在功能上更可能与同一CN神经元紧密相关。为了直观展示这些复杂的连接模式,我们利用Seaborn库绘制了细胞间二进制连接的clustergram图。在构建此图时,我们基于小叶之间的Hamming距离(采用未加权平均联动算法计算),有效地捕捉了它们与不同CN神经元连接模式的异同。此外,我们还根据小叶的解剖位置和功能特性,将输入进行了区域划分:来自小叶II、III和/或IV/V的输入被归类为前区;小叶VI/VII为中心区;小叶VIII、IX(在排除小叶X的情况下)作为后区;而来自小叶IX和X的联合输入,或仅来自小叶X的输入,则被定义为结节区。这一区域划分不仅有助于我们更好地理解小脑内部的连接架构,也为后续的功能研究提供了重要的参考框架。
为了验证CN神经元接收的特定输入模式是否在我们的数据集中构成了显著的基序或统计上过度表示的连接模式,我们设计并实施了一项假设检验。具体而言,我们基于充分采样的CN神经元数据,提出了一个核心假设:即来自小脑四个不同区域(前区、中心区、后区、结节区)的输入事件是相互独立的,一个区域的输入发生不依赖于其他区域的输入情况。在此假设框架下,我们首先独立计算了数据集中每个小脑区域输入单独出现的概率,这些概率计算未考虑区域间的相互影响。随后,为了评估多区域联合输入模式的统计显著性,我们采用了一种乘积方法,即将每个区域输入的概率与其余区域输入(或未输入)的概率相乘,以得出多区域联合输入或特定排除模式的预测概率。接下来,我们将这些基于假设的预测概率与数据集中实际观察到的多区域联合输入模式的频率进行了对比,采用二项式概率检验作为评估工具。任何实际发生频率显著高于或低于预测频率的组合,均被视为数据集中的基序,即这些特定的输入模式在统计上呈现出过度表示的特征,可能反映了CN神经元连接模式中的某种规律性或功能性偏好。
4.7 图像采集和分析
电生理学实验后,我们立即在定制的双光子显微镜上对 AlexaFluor 594 填充的 CN 神经元进行实时双光子成像。我们使用 Zeiss Zen 软件在 4% 多聚甲醛中免疫组织化学染色和固定后,使用 LSM800 激光扫描共聚焦显微镜以10倍和20倍重新成像包含填充的CN神经元的切片。使用相同的共聚焦显微镜分别使用488 nm和405 nm二极管激光器对标记Purkinje细胞点到 CN 神经元的切片进行成像,以区分兔抗GFP抗兔Alexa594 标记和豚鼠抗 NeuN 抗豚鼠 DyLite 405 标记。
对准备好的切片进行成像后,我们使用斐济分析来自电生理学和免疫组织化学实验的填充、染色的 CN 神经元。我们通过将 AlexaFluor 594 填充的 CN 神经元与实时电生理学实验后获得的初始双光子图像进行比较来确认它们的身份,并确定了填充细胞切片中的树突状和小叶方向,以评估 CN 形态和输入模式之间的关系。我们使用 Neurolucida 软件在膜片钳实验后的双光子成像会话中手动执行 CN 神经元的形态重建。我们在 3-D 中追踪细胞,以获得图像堆栈内的细胞胞体轮廓、树突投影和轴突。我们将描踪导入 Neurolucida Explorer 以提取形态数据,包括胞体面积、体直径、树突数量和长度。通过将来自细胞胞体 25 μm 的树突交叉数除以初级树突数来计算分支指数。使用 Igor Pro 制作极坐标图,以评估树突方向和Purkinje细胞输入之间的重叠。树突极坐标图被归一化为最长树突的长度。
为了评估颅内立体定向手术后源自不同小脑区的病毒标记的Purkinje细胞点的接近程度,我们使用 LSM-800 共聚焦显微镜在10倍、20倍和63倍油浸下对安装的100μm厚切片进行成像,并使用405 nm、561 nm和488 nm激光获取平铺堆栈,以区分mCerulean、 TdTomato 和 GFP 表达。图像分别以蓝色、洋红色和绿色为伪色,并且代表性图像的亮度和对比度值得到增强。原始图像在 ImageJ 中被阈值化,并用于识别各个通道中每个点的 X 和 Y 坐标。使用自定义 Python 脚本,我们确定了具有不同成像通道的不同纬向输入中的最近邻点,以确定跨区域最近点的欧几里得距离。为了确认同一Purkinje细胞中几乎没有多种病毒的共定位,我们对 ImageJ 中每个通道的Purkinje细胞点进行了阈值化,并使用 ImageJ 的绘图剖面分析功能获取了点在 X-Y 平面中的位置,并使用自定义 Python 脚本来识别每个堆栈中每个切片的共定位像素的百分比,从而确定通道之间几乎没有共定位。
4.9 统计学
我们使用 JMP 软件对正态分布的数据集执行学生 t 检验,并使用 Igor Pro 软件对非正态分布的数据集进行非参数 Mann-Whitney U 检验。除非另有说明,否则执行的所有统计检验均为双尾检验。为了评估连接基序,我们使用了二项分布计算器,然后使用 Benjamini-Hochberg 方法进行多个假设校正。除非另有说明,否则数据以 SEM ±平均值报告。
























 3万+
3万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








