
12分钟
8分钟
来源:腾讯视频--赵胜、嘲讽-诺
1. 排布原则(没有2n2,没有最外层限制等等,一切自然而然就出现了!)
1) 能量最低原理 电子由能量低的轨道向能量高的轨道排布,即电子先填充能量低的轨道,后填充能量高的轨道。
2) Pauli(保利)不相容原理 每个原子轨道中只能容纳两个自旋方向相反的电子,即同一原子中没有运动状态完全相同的电子,亦即无四个量子数完全相同的电子。
3) Hunt(洪特)规则 电子在能量简并的轨道中,要分占各轨道,且保持自旋方向相同。保持高对称性,以获得稳定。包括:轨道全空,半充满,全充满三种分布。下面所示的为原子轨道,不是我们必修一所说的K、L、M、N、O、P分层排布形式,而是将每一层更细分为不同的原子轨道。黑色箭头表示电子填充的顺序。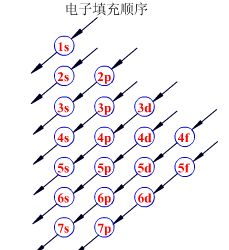
2. 核外电子的排布(轨道字符的右上角数字代表该轨道中填充的电子数,s轨道最多2个电子,p轨道最多6个电子,d轨道最多10个电子,f轨道最多14个电子)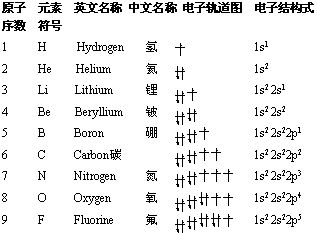
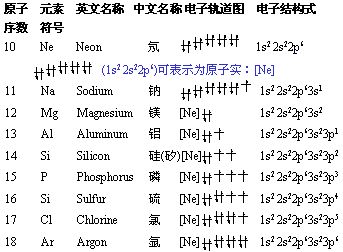
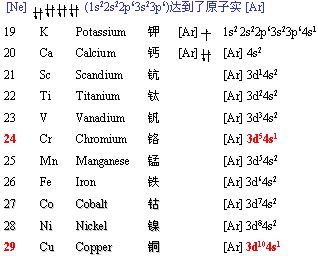

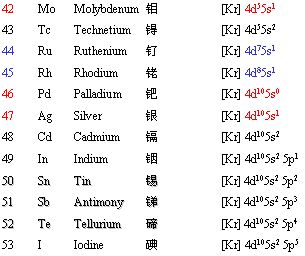
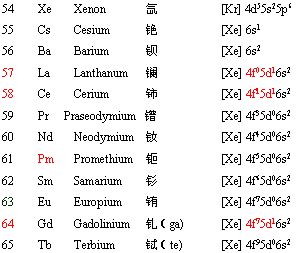

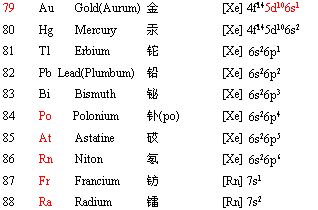
对于过渡元素,根据电子填充顺序:先填充 ns,达到ns2之后,再填内层(n-1)d;但当 (n-1)d 轨道处于半充满,全充满或全空时,会出现特殊的填充填现象。如:

当元素参加化学反应时,失电子顺序则按照最外层开始,并不是电子填充顺序的逆向!如Cu填充的时候是4s先填充,然后填充3d的,但失电子是从4s开始的,所以固态下亚铜离子比铜离子稳定。铁原子先失去4s上的两个电子,形成亚铁离子,但因为3d上有6个电子,不是5电子的半满状态,因此亚铁离子又很希望失去一个电子形成更加稳定的3d半满稳定状态,所以表现出很强的还原性。







 本文详细介绍了原子中电子的排布原理,包括能量最低原理、Pauli不相容原理和洪特规则。内容涉及电子如何按照能量顺序填充不同轨道,以及过渡元素的特殊填充情况。同时,提到了在化学反应中电子的失电子顺序,并以铜和铁为例说明了稳定性的考虑。
本文详细介绍了原子中电子的排布原理,包括能量最低原理、Pauli不相容原理和洪特规则。内容涉及电子如何按照能量顺序填充不同轨道,以及过渡元素的特殊填充情况。同时,提到了在化学反应中电子的失电子顺序,并以铜和铁为例说明了稳定性的考虑。

















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








