1. His-tag——历久弥新的6组氨酸标签
金属螯合亲合层析,又称固定化金属离子亲合层析(Immobilized metal ion affinity chromatography, IMAC),是近30年发展起来的一种新型分离技术。最早由Paroth等人提出[1]。该方法利用蛋白质表面的一些氨基酸,如组氨酸、色氨酸、半胱氨酸等能和金属离子发生特殊的相互作用的原理,从而对蛋白质加以分离。这些作用包括配价键结合、静电吸附、共价键结合,其中以配价键结合为主,而且这其中又以6组氨酸标签(His-Tag)应用最为广泛。
以His-Tag纯化标签结合金属螯合亲合层析,为重组蛋白质的分离纯化提供了一个有力的工具。由于金属螯合亲合层析具有配体简单、吸附量大、分离条件温和、通用性强等特点,上样条件可选择范围广,在高盐、一定浓度的变性剂以及去垢剂的条件下,带6His纯化标签的蛋白质都可以和亲合填料特异性结合,逐渐成为分离纯化蛋白质等生物工程产品最有效的技术之一[2]。
1.1 His-tag是蛋白纯化的首选标签
Susanne Graslund等人[3]在对10,000多个不同蛋白的表达纯化进行总结,认为His-tag是蛋白纯化的首选标签,主要有五方面的因素(表9)。

1.2 His-tag亲和层析填料
His-tag可与多种金属离子发生特殊的相互作用,包括Ca2+、Mg2+、Ni2+、Co2+等,其中以镍离子使用最为广泛。镍琼脂糖凝胶FF的配基是最经典的IDA,镍离子有六个螯合价位,Ni-IDA螯合了三价,剩余三价,而Ni-NTA螯合了四价的,剩余是两价。因此,Ni-IDA琼脂糖凝胶作用力要比Ni-NTA琼脂糖凝胶的强。也正因为这个原因,IDA的载量要比NTA高,而在同样条件下Ni-IDA洗杂质和目标蛋白的要比Ni-NTA的咪唑浓度高。但是NTA的填料更稳定,能耐受更强的还原剂,更不容易脱落。
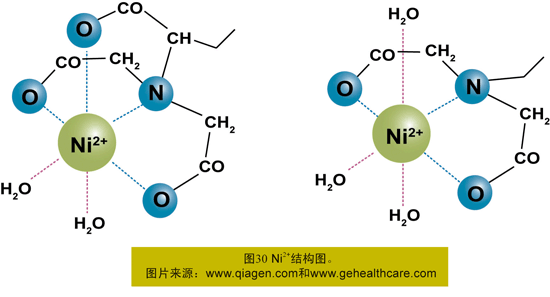
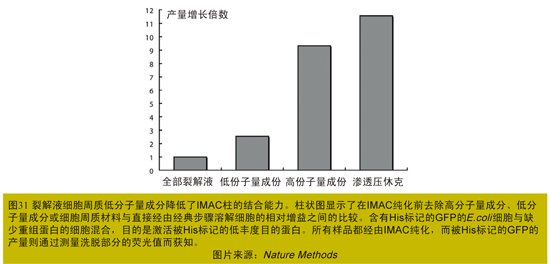
固定化金属离子亲合层析(IMAC)是非常稳定的,但在有螯合剂的情况下其金属离子就会脱落,所以在纯化His-Tag融合蛋白时,不能有任何的螯合剂存在。Audur Magnusdottir等人认为,在E.coli的裂解液普遍存在一些非特异的弱螯合剂,如在三羧酸循环中产生了二羧酸类物质;E.coli在面临某些压力情况下,会产生高特异性的金属螯合剂——Metallophores,这是由于这些螯合剂的存在导致His-Tag融合蛋白纯化的纯度和产量大大降低。这些螯合剂一般存在于细菌的细胞周质中,通过一个简单的步骤就可除去这些螯合剂,使得His-TagTM蛋白的纯度和产量得到提高[4]。
参考文献
Porath J, Carlsson J, Olsson I et al. (1975) Metal chelate affinity chromatography, a new approach to protein fractionation. Nature, 258(5536): 598-9.
Chaga GS. (2001) Twenty-five years of immobilized metal ion affinity chromatography: past, present and future. J Biochem Biophys Methods, 49(1-3): 313-34.
Structural Genomics Consortium, Architecture et Fonction des Macromolécules Biologiques, Berkeley Structural Genomics Center, et al. (2008) Protein Production and Purification, Nature Methods, 5(2): 135-146.
Audur Magnusdottir, Ida Johansson, Lars-Göran Dahlgren et al. (2009) Enabling IMaC purification of low abundance recombinant proteins from E. coli lysates. Nature Methods 6(7): 477-478.







 His-tag,一种包含6个组氨酸的标签,已成为蛋白质纯化的首选方法。通过金属螯合亲和层析(IMAC),尤其是与镍离子结合,实现高效、温和的蛋白质分离。His-tag的优点包括配体简单、吸附量大、通用性强,但需注意E.coli裂解液中可能存在的非特异性螯合剂对其纯化效果的影响。去除这些螯合剂可以提高纯度和产量。
His-tag,一种包含6个组氨酸的标签,已成为蛋白质纯化的首选方法。通过金属螯合亲和层析(IMAC),尤其是与镍离子结合,实现高效、温和的蛋白质分离。His-tag的优点包括配体简单、吸附量大、通用性强,但需注意E.coli裂解液中可能存在的非特异性螯合剂对其纯化效果的影响。去除这些螯合剂可以提高纯度和产量。

















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








