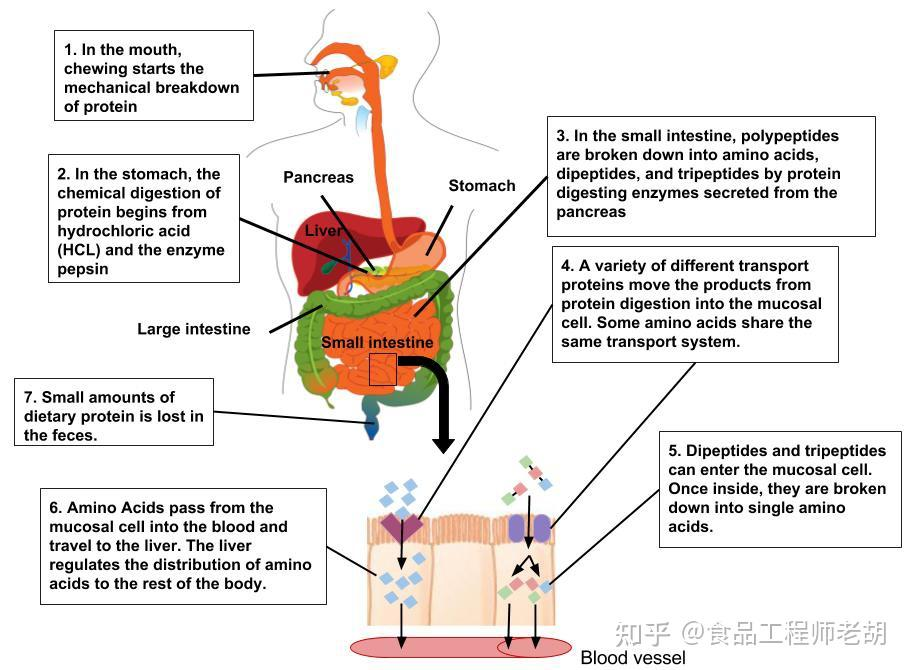
蛋白质未经消化不易吸收,有时某些抗原、毒素蛋白可少量通过黏膜细胞进入体内,会产生过敏、毒性反应。一般情况下,食物蛋白质水解成氨基酸及短肽后方能被吸收。由于唾液中不含水解蛋白质的酶,所以食物蛋白质的消化从胃开始,但主要在小肠。
蛋白质消化后形成的氨基酸或2~3个氨基酸构成的短肽在小肠内吸收,吸收入血的氨基酸主要与体内组织蛋白质分解产生的氨基酸共同参与体内蛋白质的合成和分解的代谢;此外,部分氨基酸还可合成体内其他含氮物质,如激素、神经递质等;摄入蛋白质过量时,多余的氨基酸可用来合成葡萄糖和脂肪。

一、蛋白质的消化
(一)胃内消化
胃内消化蛋白质的酶是胃蛋白酶(pepsin)。胃蛋白酶是由胃黏膜主细胞合成并分泌的胃蛋白酶原(pepsinogen)经胃酸激活而生成的;胃蛋白酶也能激活胃蛋白酶原生成胃蛋白酶。胃蛋白酶分解蛋白质生成蛋白胨以及少量多肽和氨基酸。
==胃蛋白酶以无活性的前体酶原形式(胃蛋白酶原)分泌,在胃酸(pH 1.5-2.0)作用下激活为有活性的胃蛋白酶。其最佳活性环境为pH 1.8-3.5,当pH>6.5时失活。属于天冬氨酸蛋白酶家族,具有特定空间结构。其催化位点主要针对疏水性氨基酸(如苯丙氨酸、酪氨酸、亮氨酸)形成的肽键,但因自身关键位点被包裹在三维结构内部,避免了自我分解。食物中的蛋白质在胃酸作用下变性,暴露出内部疏水区域,胃蛋白酶识别并切割特定肽键,将大分子蛋白质水解为小肽片段。例如,胰岛素B链可被胃蛋白酶在8个特定位置切割。==
胃蛋白酶在对蛋白或多肽进行剪切时,具有一定的氨基酸序列特异性。例如,它倾向于剪切氨基端或羧基端为芳香族氨基酸(如苯丙氨酸、色氨酸和酪氨酸)或亮氨酸的肽键;如果某一肽
键氨基端第三个氨基酸为碱性氨基酸(如赖氨酸、精氨酸和组氨酸)或者该肽键的氨基端为精氨酸时,则不能有效剪切此肽键。这种剪切特异性在pH为1.3时表现得更为明显,只倾向于剪切氨基端为苯丙氨酸或亮氨酸的肽键。胃蛋白酶发挥作用的最适宜pH为1.8~3.5。胃蛋白酶对乳中的酪蛋白有凝乳作用,这对婴儿较为重要,因为乳液凝成乳块后在胃中停留时间延长,有利于充分消化。

分泌素(Secretin)的调节通路
-
刺激因素:十二指肠内酸性环境(低pH的食糜/胰液)
-
作用过程:十二指肠黏膜中的S细胞分泌分泌素 → 进入血液 → 刺激胰腺导管细胞 → 分泌碳酸氢盐(HCO₃⁻)到十二指肠
-
生理意义:中和胃酸,保护十二指肠黏膜,为胰酶提供适宜碱性环境。
胆囊收缩素(CCK)的调节通路
-
刺激因素:十二指肠内的多肽(蛋白质分解产物)和脂质
-
作用过程:十二指肠黏膜中的I细胞分泌CCK → 进入血液 → 刺激胰腺腺泡细胞 → 分泌消化酶(如胰蛋白酶原、脂肪酶等)到十二指肠
-
生理意义:促进蛋白质和脂肪的消化,同时刺激胆囊收缩排出胆汁。
CCK诱导的胰酶激活过程(小肠内)
关键步骤
-
胰腺分泌的酶原(无活性):胰蛋白酶原(Trypsinogen);糜蛋白酶原(Chymotrypsinogen);前弹性蛋白酶(Proelastase);前羧肽酶A/B(Procarboxypeptidase A/B)
-
激活机制:
-
肠激酶(Enteropeptidase)(由小肠刷状缘分泌)将胰蛋白酶原转化为胰蛋白酶(Trypsin)。
-
胰蛋白酶进一步激活其他酶原:
-
糜蛋白酶原 → 糜蛋白酶(Chymotrypsin)
-
前弹性蛋白酶 → 弹性蛋白酶(Elastase)
-
前羧肽酶 → 羧肽酶(Carboxypeptidase)
-
-
-
最终作用:这些活性酶共同分解蛋白质为小肽和氨基酸。
(二)小肠内消化
小肠消化的蛋白质包括食物的外源性蛋白质和来自消化道本身的内源性蛋白质两类。内源性蛋白质主要是来自消化道每日脱落的上皮细胞中蛋白质以及每日渗透进入肠腔的一部分血浆蛋白。小肠内蛋白质的消化主要由胰腺分泌的蛋白酶所完成。胰腺细胞最初分泌出来的各种蛋白酶和肽酶是无活性的蛋白酶原,分泌到十二指肠后迅速被肠激酶激活成有活性的蛋白酶,如胰蛋白酶原激活成胰蛋白酶。胰蛋白酶的自身激活作用较弱,但它能迅速将胰液中其他酶原激活。
胰蛋白酶的消化作用很强,在整个消化吸收过程中,此酶在空肠和回肠中均保持很高的浓度。在进食后的很短时间内,十二指肠中就含有200~800pg胰蛋白酶,这些酶在10分钟内就足以把十二指肠内容物中50%的蛋白质转化为三氯醋酸可溶的物质。
胰腺分泌的蛋白酶可分为两类:
1.内肽酶
内肽酶可以水解蛋白质分子内部的肽键,包括胰蛋白酶、糜蛋白酶和弹性蛋白酶。其中,胰蛋白酶仅水解碱性支链氨基酸残基的羧基肽键,产生碱性氨基酸作为羧基末端的肽;糜蛋白酶主要水解芳香族氨基酸的羧基肽键,产生具有以芳香族氨基酸作为羧基末端的肽,有时也可作用于亮氨酸、谷氨酸、谷氨酰胺及蛋氨酸等残基的羧基肽键;弹性蛋白酶主要水解脂肪族氨基酸组成的肽键,如缬氨酸、亮氨酸、丙氨酸等,作用的特异性较差。
2.外肽酶
外肽酶可将肽链末端的氨基酸逐个水解,包括羧肽酶A、B和亮氨羧肽酶。羧肽酶A分解多肽链C末端的脂肪族或芳香族氨基酸残基,羧肽酶B则从C端切下精氨酸和赖氨酸的残基。
此外,胰液中还有其他酶如胶原酶、氨基肽酶、血管舒缓素等,胶原酶-和弹性蛋白酶主要参与消化结缔组织中的相应的纤维蛋白;血管舒缓素主要作用将血液中的激肽原分解为具有活性的激肽,激肽能扩张血管,增加血管的通透性,降低血压。
经过胃液和胰液中酶的消化后,蛋白质水解为游离氨基酸和较小的肽,肽类可被存在于肠黏膜纹状缘膜上的肽酶或胞质中的肽酶水解,但两者在水解肽类时因所含氨基酸残基不同而异,如含有脯氨酸、甘氨酸、谷氨酸和天门冬氨酸残基的肽类可完全被胞质内的肽酶所水解;含有精氨酸、赖氨酸、蛋氨酸、亮氨酸残基的肽类则在纹状缘处被水解。
二、蛋白质的吸收
(一)氨基酸和寡肽的吸收

(图5-9)**蛋白质消化产物在小肠上皮细胞中的吸收和转运机制
1. 左侧(肠腔侧):
- 蛋白质的逐步分解:- 大分子蛋白质 → 多肽(Peptide) → 二肽/三肽(Di/Tripeptide)和游离氨基酸(Amino acid)
- 吸收载体:- H⁺协同转运:二肽/三肽通过PepT1载体(肽转运蛋白)与H⁺共转运进入细胞(需H⁺浓度梯度驱动)。
- Na⁺协同转运:游离氨基酸通过 Na⁺-氨基酸共转运载体(如SGLT1类似系统)进入细胞。
2. 细胞内: - 二肽/三肽被胞内肽酶(如肽基肽酶)进一步水解为游离氨基酸。
3. 右侧(基底膜侧)**:
- 氨基酸转运至血液:
- 游离氨基酸通过 Na⁺-非依赖性载体(如LAT2)转运出细胞。
-Na⁺/K⁺-ATP酶泵维持细胞内低Na⁺、高K⁺环境,为肠腔侧的Na⁺协同转运提供驱动力。
- 最终氨基酸通过门静脉进入肝脏代谢。
关键生理机制
1. H⁺梯度驱动肽吸收:
- 肠腔侧的H⁺由 Na⁺/H⁺交换泵(NHE3)提供,依赖Na⁺梯度(间接消耗ATP)。
2. 能量来源:
- 基底膜的 Na⁺/K⁺-ATP酶直接消耗ATP,维持细胞内外离子梯度,是吸收过程的能量基础。
生理意义
- 高效吸收:以短肽形式吸收比游离氨基酸更快(占蛋白质吸收的70%以上)。
- 保护性设计:避免大量游离氨基酸在肠腔堆积造成渗透压失衡。 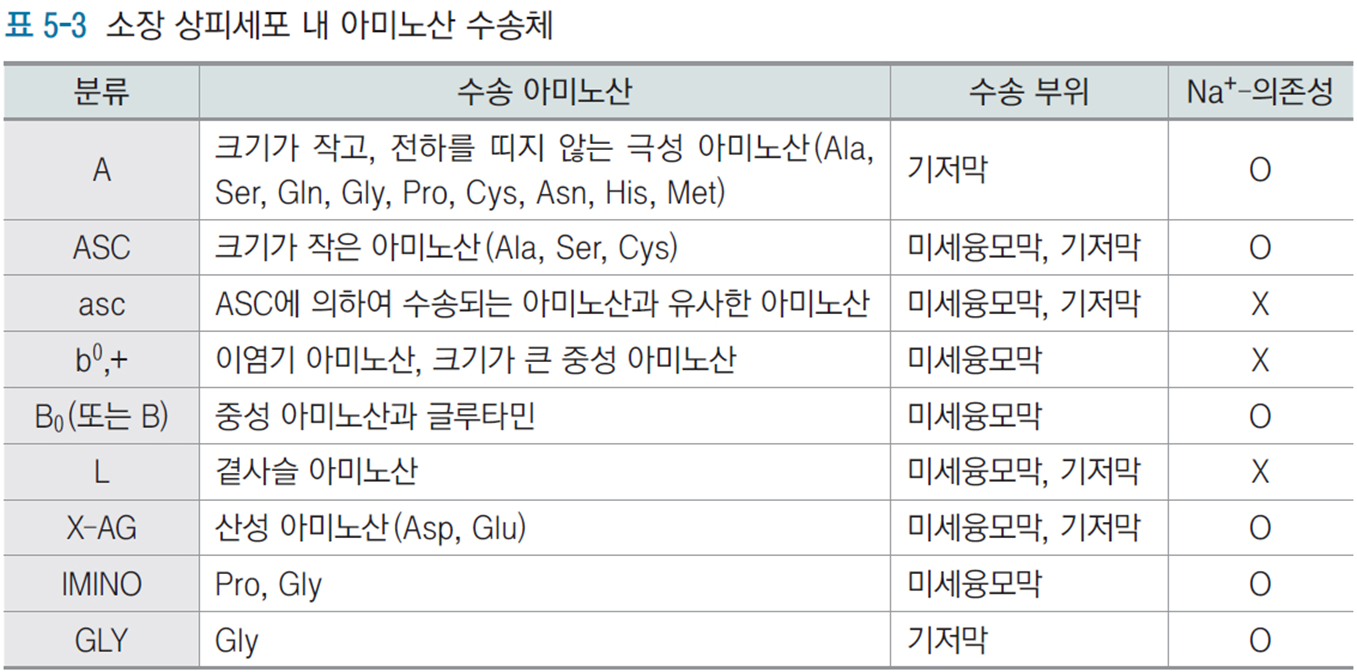
描述了不同氨基酸转运系统的特性:这些转运系统确保了氨基酸在肠道吸收和组织间的有效运输。
-
分类系统:
-
A系统:转运小而无电荷的极性氨基酸(Ala, Ser, Gln等),位于基底膜,Na+依赖性
-
ASC系统:转运小分子氨基酸(Ala, Ser, Cys),位于微绒毛膜和基底膜,Na+依赖性
-
b0,+系统:转运二碱基氨基酸和大中性氨基酸,位于微绒毛膜,非Na+依赖性
-
L系统:转运支链氨基酸,位于微绒毛膜和基底膜,非Na+依赖性
-
X-AG系统:转运酸性氨基酸(Asp, Glu),Na+依赖性
-
1.氨基酸的转运体
氨基酸转运体根据对Na + 的依赖性可分为Na + 依赖和Na + 不依赖的转运体。Na + 依赖的转运体利用质膜上以Na + 电化学梯度形式储存的自由能逆浓度梯度从胞外转运氨基酸底物入胞内。Na + 依赖的氨基酸转运体包括A型、ASC型、B 0 型、X AG- 型、B 0+ 型和β型等;Na + 不依赖的氨基酸转运体包括转运中性氨基酸的L型、转运小型中性氨基酸的asc型、选择性转运芳香族氨基酸的T型、选择性转运碱性氨基酸的y + 型、转运碱性和中性氨基酸的b 0+ 和y +L 型以及转运胱氨酸和谷氨酸的X c- 型等。
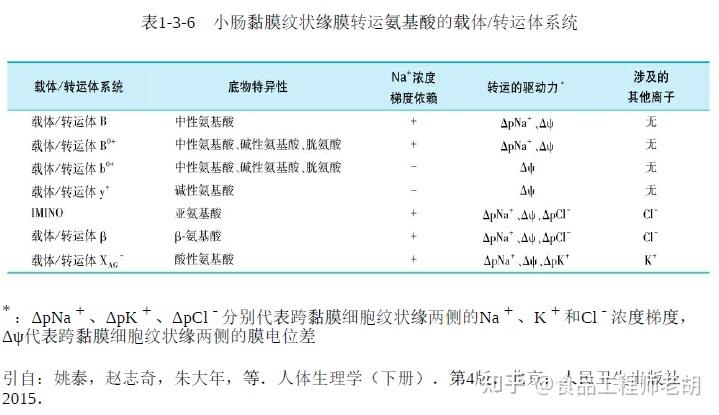
(1)纹状缘的氨基酸转运系统:
成年人微绒毛肠上皮细胞转运氨基酸的机制有主动转运、易化扩散以及单纯扩散,其中主动转运和易化扩散需要转运体介导。小肠黏膜上皮细胞膜上存在能转运中性氨基酸、碱性氨基酸、酸性氨基酸和亚氨基酸及甘氨酸的转运体。
目前已知4种转运中性氨基酸经过细胞顶端膜的主动转运机制:对很多中性氨基酸有广泛特异性的NBB系统、介导苯丙氨酸和甲硫氨酸吸收的PHE系统、介导亚氨酸吸收的IMINO系统以及介导β-氨基酸吸收的系统。
由于氨基酸的结构有较大差异,理化特性也不相同,因此它们通过细胞膜的转运需要更复杂的转运系统。下表列出了纹状缘与氨基酸转运有关的转运体。氨基酸的吸收是一种继发性主动转运过程,必须依赖钠泵并以ATP作为能量来源来维持细胞膜两侧的离子浓度差和电位差。
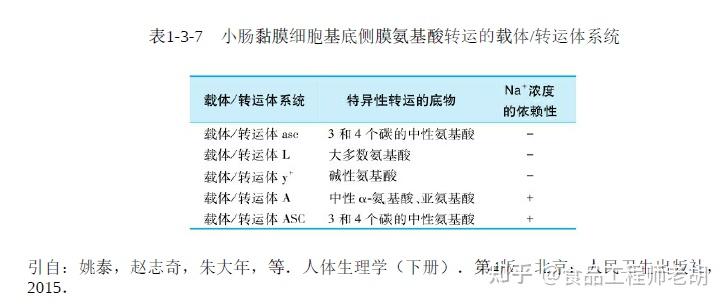
(2)细胞基底侧膜氨基酸载体/转运体系统:
目前已知细胞基底侧膜上有五种氨基酸载体/转运体系统,可分成Na +依赖和Na + 不依赖的两类。前者可能与两餐之间黏膜细胞由血液摄取氨基酸有关,后者与氨基酸由细胞内向血液转运有关。
2.寡肽载体/转运体及转运过程
(1)寡肽载体/转运体:
以二肽和三肽为主的寡肽可被小肠上皮细胞摄取,其载体/转运体主要有肽转运体1型(PepT-1)和肽转运体2型(PepT-2)。这两种肽转运体在组织中的分布不同,PepT-1主要是肠肽转运体,PepT-2主要是肾脏肽转运体。寡肽转运体识别和结合底物分子的亲和力以及底物通过膜被转运的容量和速度是寡肽转运体的重要生理特性。
一般情况下,对底物有较低亲和力的转运系统有较大的转运容量,有较高亲和力的转运系统则有较低的转运容量。PepT-1是低亲和力、高容量的肽转运体,PepT-2则为高亲和力、低容量的肽转运体;PepT-1能转运2~5肽,其中转运二肽的速度最快;不管寡肽分子结构、大小、电荷和极性,它们都能被PepT-1和PepT-2转运。因此大约有400种二肽和8000种三肽为转运体底物。
(2)寡肽转运的过程:
寡肽进入肠上皮细胞的过程主要是与其他正离子,特别是H + 的同向跨膜转运相耦联的。肠上皮细胞纹状缘膜表面比大多数肠道液酸性强,人体或实验动物微环境pH在5.4~6.2之间,而细胞内为7.0~7.2。当外部pH在3~10之间变化时,微环境pH能够保持稳定,这与纹状缘膜中的Na+ -H + 交换体的作用关。Na + -H + 交换体使Na + 从肠腔进入细胞,并且使H + 从细胞进入肠腔,同时肽采取易化扩散方式经由肽转运体与H + 耦联转运入细胞。Na + -H + 交换体产生并维持向内的质子浓度梯度,基底侧膜上的Na + ,K + -ATP酶则维持细胞内低钠水平。
3.氨基酸吸收的部位
经过消化后蛋白质被水解为可以吸收的氨基酸和2~3个氨基酸的短肽,主要在小肠吸收,但小肠不同部位的吸收能力有差别,近端小肠对氨基酸吸收能力较远端小肠弱,但对寡肽的吸收能力则较强,这与黏膜纹状缘寡肽酶在回肠内的活性比在空肠内高的特点相适应。结肠上皮细胞也拥有吸收氨基酸的能力,可能在新生儿和回肠切除患者的蛋白质吸收中起重要作用。
(二)完整蛋白质的吸收
在低等动物,吞噬是摄入大分子物质的基本方式。而在高等动物,只有在胚胎动物和新生动物仍保持这种原始机制。例如,母乳中的抗体可通过肠黏膜细胞的吞噬作用传递给婴儿。在牛进行的实验也发现,给新生小牛十二指肠灌注人初乳60~120分钟后在胸导管中可出现初乳蛋白。这种直接摄取蛋白的功能在出生后持续时间的长短因动物种属而异,一般为1~18天。
关于成年人或成年动物肠道对完整蛋白质的吸收已进行了许多研究。有人将胰岛素和胰蛋白酶抑制剂同时注入大鼠的隔离肠袢,发现可引起血糖降低,提示有一定量的完整胰岛素被吸收。用酶标法研究辣根过氧化物酶的吸收,也获得相同的结果。此外,人的血液中存在食物蛋白质抗体,提示食物蛋白质可进入血液而起抗原的作用。但一般认为,大分子蛋白质的吸收是极其微量的,无任何营养学意义,而肠内细菌的毒素、食物抗原等可能会进入血液而成为致病因子。
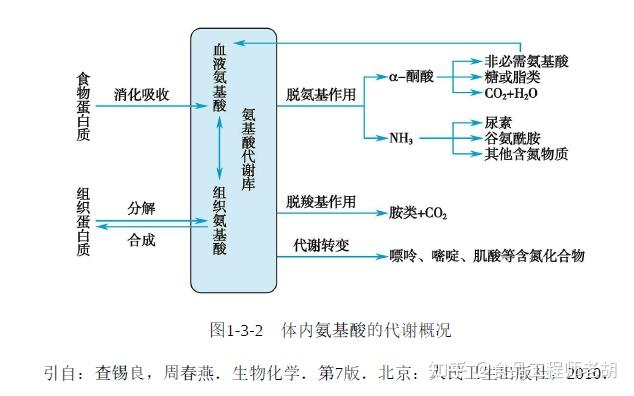
三、蛋白质的代谢

蛋白质在体内的整体代谢过程:
-
蛋白质摄入后在小肠消化吸收为氨基酸
-
氨基酸进入肝脏形成氨基酸池
-
代谢产物通过粪便(未吸收部分)和尿液(含氮废物)排出
(一)蛋白质的分解与合成
1.蛋白质的分解
体内蛋白质处于不断合成和分解的动态平衡中。成人体内的蛋白质每天有1%~2%分解,其中主要是肌肉蛋白。蛋白质分解产生的氨基酸中大约70%~80%又被重新利用合成新的蛋白质。不同蛋白质分解的速率不同,如人体血浆蛋白质半衰期约为10天,肝中大部分蛋白质半衰期为1~8天,而结缔组织中一些蛋白质半衰期可达180天以上。
2.蛋白质的合成
在蛋白质分解的同时也不断在体内合成,以补偿分解。体内蛋白质的分解与合成同时进行,在相对稳定状态时,总转换中的分解与合成约各占一半。蛋白质的生物合成是一个多种分子参与的复杂过程,其中包括以下几种重要的分子:
(1)mRNA:
mRNA (messenger RNA,信使RNA)是蛋白质合成的直接模板。遗传信息虽然存在于DNA分子中,但DNA并不直接指导蛋白质的生物合成。DNA通过转录生成mRNA后,mRNA就含有与DNA分子中某些功能片段相对应的碱基序列,以mRNA为模板合成蛋白质的多肽链时,这些
碱基序列信息就转化为多肽链中氨基酸的排列顺序。
(2)核糖体:
核糖体是由rRNA(ribosomal RNA,核蛋白体RNA)和蛋白质组成的复合体,参与蛋白质生物合成的各种成分最终都要在核糖体上将氨基酸合成多肽链,因此核糖体是蛋白质生物合成的场所。
(3)tRNA:
tRNA(transfer RNA,转运RNA)是氨基酸的运载工具及蛋白质合成的适配器,它有两个关键部位,一个是氨基酸结合部位,另一个是mRNA结合部位。分散存在于胞液中的氨基酸需要由tRNA搬运至核糖体上组装成多肽链,同时mRNA序列中密码子的排列顺序通过tRNA分子的反密码环配对,保证了从核酸到蛋白质信息传递的准确性。
(4)蛋白质合成需要的酶类和蛋白质因子:
参与蛋白质合成的重要酶有氨基酰-tRNA合成酶、转肽酶和转位酶。主要的蛋白质因子有起始因子、延长因子、终止因子。此外,蛋白质生物合成的能源物质ATP和GTP,以及无机离子Mg 2+ 和K + 等都是蛋白质合成所必需的。
总之,各种蛋白质合成的具体过程是相当复杂的,需要有数以百计的物质和细胞成分参与,但大体上可以分为三个阶段:
①氨基酸的活化过程,即各种氨基酸分别加载到各自的tRNA分子上,形成氨基酰-tRNA;
②肽链的生物合成过程,即将mRNA的碱基排列顺序转换成肽链中氨基酸的排列顺序,并通过肽键将氨基酸连接起来;
③肽链形成后的加工过程,即肽链合成后通过折叠形成天然蛋白质的三维构象,并对一级结构
和空间结构进行修饰等,才成为有生物学功能的天然蛋白质。
在这三个阶段中都会受到多种因素的调节,其中至少在两个水平上受到调节,一是转录水平的调节,控制合成mRNA的种类和数量;二是翻译水平的调节,控制合成蛋白质的种类和数量。转录和翻译过程都很复杂,特别是翻译过程,参与因子很多,不仅mRNA寿命会影响翻译,核糖体的结构与功能,tRNA含量及其能否及时转运必要的氨基酸,乃至氨基酸供应等均会影响翻译,从而影响蛋白质的生物合成。
(二)氨基酸的分解代谢

氨基酸分解的两条主要途径:
-
氨基基团代谢:
-
通过转氨基作用形成α-酮酸和谷氨酸
-
最终通过尿素循环生成尿素排出
-
-
碳骨架代谢:
-
可生成能量、CO₂
-
可转化为葡萄糖(糖异生)或酮体
-
也可合成脂肪酸
-
1.氨基酸的一般代谢
食物蛋白质经消化而被吸收的氨基酸(外源性氨基酸)与体内组织蛋白质分解产生的氨基酸(内源性氨基酸)混在一起,分布于体内,参与代谢,称为氨基酸代谢库。氨基酸代谢库通常以游离氨基酸总量计算。由于氨基酸不能自由通过细胞膜,所以在体内的分布也是不均匀的。例如,肌肉中的氨基酸占总代谢库的50%以上,肝脏约占10%,肾脏约占4%,血浆约占1%~6%。由于肝、肾的体积较小,实际上所含游离氨基酸的浓度很高,氨基酸的代谢很旺盛。消化吸收的大多数氨基酸,例如,丙氨酸、芳香族氨基酸(苯丙氨酸、酪氨酸、色氨酸)等主要在肝脏分解,但支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)的分解代谢主要在骨骼肌中进行。血浆氨基酸是体内各组织之间氨基酸转运的主要形式。
体内氨基酸的主要功能是合成蛋白质和多肽。此外,也可以转变成某些生理活性物质,如嘌呤、嘧啶、肾上腺素等。正常人尿中排出的氨基酸极少。各种氨基酸在结构上具有共同特点,所以存在一些共同的代谢途径;但不同的氨基酸由于结构的差异,也各有其特殊的代谢方式。
氨基酸的分解代谢主要是脱氨基作用及由此而产生的α-酮酸及氨的代谢,其中最主要的反应是脱氨基作用。脱氨基方式有:氧化脱氨基、转氨基、联合脱氨基和非氧化脱氨基等,其中以联合脱氨基最为重要。氨基酸脱氨基后生成的α-酮酸进一步代谢:①经氨基化生成非必需氨基
酸;②转变成碳水化合物及脂类;③氧化供给能量。
氨基酸经脱氨基作用产生的氨是体内氨的主要来源,其他来源还有肠道吸收的氨以及肾小管上皮细胞分泌的氨等。氨是有毒物质,在正常情况下体内产生的氨主要在肝脏合成尿素而解毒;只有少部分氨在肾脏以铵盐的形式由尿排出。正常成人尿素占尿排氮总量的80%~90%,可见肝脏在氨解毒中的重要作用。体内氨的来源和去路保持动态平衡,使血氨相对稳定,平均水平在47~65μmol/L。
转氨基反应(图5-12)
关键反应:
-
氨基酸 + α-酮戊二酸 ↔ 谷氨酸 + α-酮酸
-
由转氨酶(如ALT)催化,需要PLP(维生素B6)作为辅因子
-
例如丙氨酸通过转氨生成丙酮酸
脱氨基反应(图5-13)
主要方式:
-
谷氨酸脱氢酶途径:
-
谷氨酸 → α-酮戊二酸 + NH₄⁺
-
在线粒体中进行,NAD⁺/NADP⁺为辅因子
-
-
其他氨基酸特异脱氨酶:
-
如丝氨酸脱水酶、甘氨酸裂解系统等

-
氨基酸碳骨架如何进入能量代谢(图5-14)
这张图(图5-14)展示了 **氨基酸的碳骨架** 如何被身体利用,最终变成 **能量、葡萄糖或酮体**。我们可以把它想象成一个「代谢交通图」,所有氨基酸都要通过不同的「入口」进入 **柠檬酸循环(TCA循环,中间那个圈圈)**,然后被分配到不同的用途。
所有氨基酸分解后,它们的 **碳骨架**(去掉氨基的部分)会进入以下三种代谢途径:
| 类型 | 代表氨基酸 | 最终产物 | 生理意义 |
|---|---|---|---|
| 生糖氨基酸 (글루코스 생성 아미노산) | 丙氨酸、谷氨酸、天冬氨酸等 | 葡萄糖(通过糖异生) | 饥饿时维持血糖 |
| 生酮氨基酸 (캐톤체 생성 아미노산) | 亮氨酸、赖氨酸 | 酮体(乙酰乙酸、β-羟丁酸) | 长期禁食或糖尿病时的替代能源 |
| 生糖兼生酮氨基酸 | 苯丙氨酸、酪氨酸、异亮氨酸等 | 部分变糖,部分变酮体 | 灵活供能 |
2. 关键中间代谢物(图中的「路口」)**
氨基酸的碳骨架不会直接变成能量或糖,而是先变成 **几种关键的中间代谢物**,再进入 **TCA循环(中间那个圈圈)**。这些中间代谢物就像「公交站」,决定氨基酸最终去哪:
1. **丙酮酸(Pyruvate)**
- **来源氨基酸**:丙氨酸、甘氨酸、丝氨酸、半胱氨酸等
- **去向**:
- ➡️ **变葡萄糖**(通过糖异生)
- ➡️ **变乙酰CoA**(进TCA循环或生酮)
2. **草酰乙酸(Oxaloacetate)**
- **来源氨基酸**:天冬氨酸、天冬酰胺
- **去向**:
- ➡️ **直接进TCA循环**(供能)
- ➡️ **变葡萄糖**(糖异生)
3. **α-酮戊二酸(α-Ketoglutarate)**
- **来源氨基酸**:谷氨酸、谷氨酰胺、组氨酸、脯氨酸
- **去向**:
- ➡️ **进TCA循环**(能量生产)
4. **琥珀酰CoA(Succinyl-CoA)**
- **来源氨基酸**:甲硫氨酸、缬氨酸、异亮氨酸
- **去向**:
- ➡️ **进TCA循环**(能量生产)
5. **延胡索酸(Fumarate)**
- **来源氨基酸**:苯丙氨酸、酪氨酸
- **去向**:
- ➡️ **进TCA循环**(供能)
- ➡️ **部分变糖**
6. **乙酰CoA(Acetyl-CoA)**
- **来源氨基酸**:亮氨酸、赖氨酸
- **去向**:
- ➡️ **进TCA循环**(但无法回头变糖)
- ➡️ **变酮体**(如果TCA循环太忙,比如糖尿病时)
3. 整个代谢流程总结**
1. **氨基酸脱氨**(去掉氨基,变成碳骨架)。
2. **碳骨架进入中间代谢物**(丙酮酸、草酰乙酸、α-酮戊二酸等)。
3. **进入TCA循环**(中间那个圈圈):
- 如果从 **草酰乙酸、α-酮戊二酸** 等进入 → 可以「逃出」变糖(生糖作用)。
- 如果变成 **乙酰CoA** → 只能进TCA循环燃烧,或变酮体(无法回头变糖)。
4. **最终产物**:
- **葡萄糖**(维持血糖)
- **ATP(能量)**
- **酮体**(替代能源)
4. 现实意义**
✔️ **减肥/生酮饮食**:减少碳水时,身体会分解蛋白质(氨基酸)供能,部分变酮体。
✔️ **糖尿病**:胰岛素不足时,氨基酸代谢增强,可能产生过多酮体(酮症酸中毒)。
✔️ **肝病/肾病**:如果TCA循环出问题,氨基酸代谢会紊乱(如血氨升高)。
(1)氨基酸的脱羧基作用:
除了脱氨基作用,动物体内部分氨基酸也可以进行脱羧基作用生成相应的胺。生成的胺类含量虽然不高,但具有重要生理意义。例如,谷氨酸脱羧基生成的γ-氨基丁酸在脑组织中含量较多,是抑制性神经递质,对中枢神经有抑制作用;组氨酸脱羧基生成的组胺在体内分布广泛,在乳腺、肺、肝、肌肉及胃黏膜中含量较高,组胺是一种强烈的血管舒张剂,并能增加毛细血管的通透性;色氨酸脱羧基生成的5-羟色胺广泛分布体内各组织,除神经组织外,还存在于胃肠道、血小板及乳腺细胞中,脑中的5-羟色胺作为神经递质,具有抑制作用,在外周组织中的5-羟色胺有收缩血管的作用等。
(2)一碳单位的代谢:
某些氨基酸在分解代谢过程中可以产生含有一碳原子的基团,称一碳单位。体内重要的一碳单位有:甲基(—CH 3 )、甲烯基(—CH 2 )、甲炔基(CH=)、甲酰基(—CHO)、亚甲氨基(—CH=NH)等。
一碳单位不能游离存在,常与四氢叶酸结合而转运和参加代谢。一碳单位主要来源于丝氨酸、甘氨酸、组氨酸及色氨酸的代谢。一碳单位的主要生理功能是作为合成嘌呤及嘧啶的原料,故在核酸的生物合成中占有重地位。
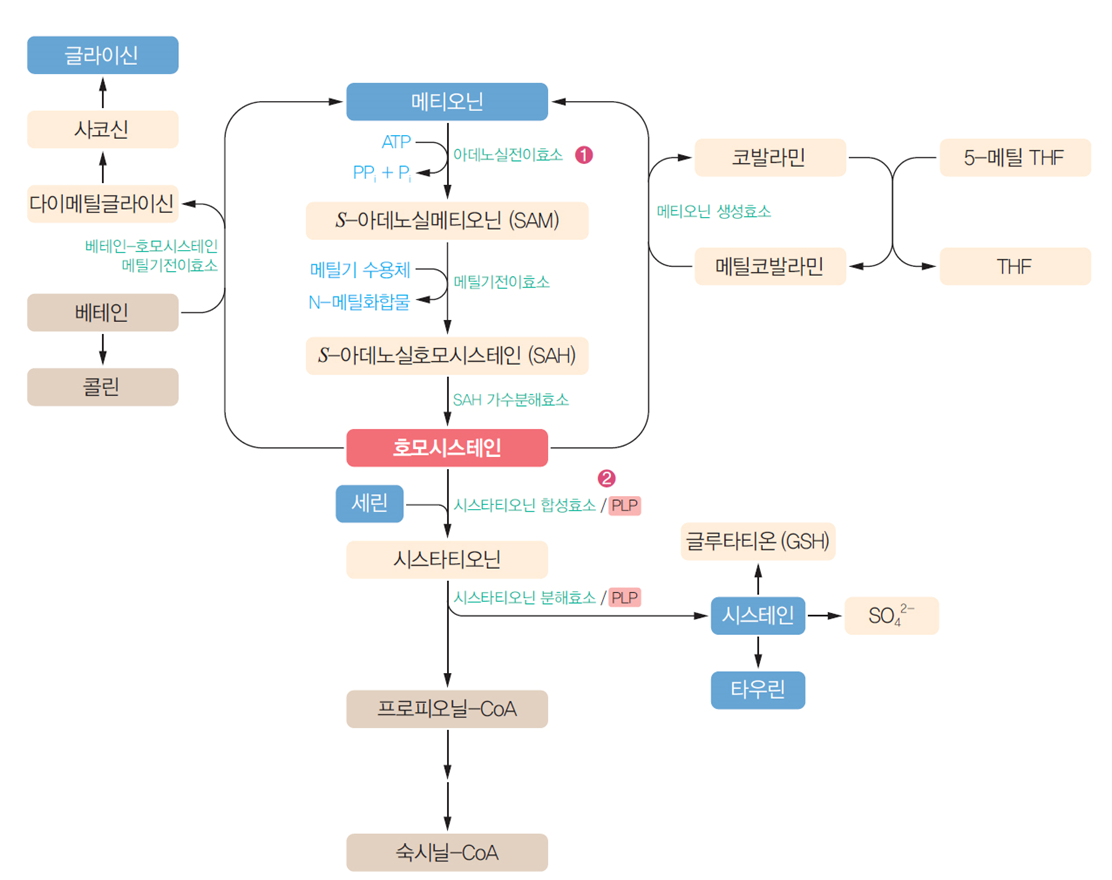
含硫氨基酸代谢
甲硫氨酸和半胱氨酸代谢:
-
甲硫氨酸循环:
-
甲硫氨酸 → SAM(主要甲基供体) → SAH → 同型半胱氨酸
-
同型半胱氨酸可再甲基化为甲硫氨酸(需维生素B12和叶酸)
-
或与丝氨酸合成胱硫醚,最终生成半胱氨酸
-
-
半胱氨酸代谢产物:
-
牛磺酸
-
谷胱甘肽(GSH)
-
硫酸盐
-
含硫氨基酸(蛋氨酸、半胱氨酸和胱氨酸)的代谢涉及甲基转移、抗氧化防御及气体信号分子生成等多个关键环节,其代谢过程可分为以下核心部分:
一、蛋氨酸循环与甲基供体生成**
1. **S-腺苷蛋氨酸(SAM)的合成**
蛋氨酸在腺苷转移酶催化下与ATP结合生成**SAM**,作为体内主要的活性甲基供体。SAM通过甲基转移酶将甲基转移至受体(如DNA、蛋白质、脂质),生成肾上腺素、肌酸等物质,参与表观遗传调控。
2. **同型半胱氨酸(Hcy)的转化**
SAM失去甲基后转化为S-腺苷同型半胱氨酸(SAH),再水解为Hcy。Hcy可通过两种途径代谢:
- **再甲基化**:依赖维生素B12和N5-甲基四氢叶酸(N5-CH3-FH4)重新生成蛋氨酸,维持甲基循环。
- **转硫途径**:通过胱硫醚β-合成酶(CBS)与丝氨酸结合生成胱硫醚,进一步裂解为半胱氨酸和α-酮丁酸。
二、半胱氨酸与胱氨酸代谢**
1. **相互转化与抗氧化功能**
半胱氨酸通过二硫键氧化形成胱氨酸,两者可逆转化维持细胞氧化还原平衡。半胱氨酸是**谷胱甘肽(GSH)**的前体,GSH作为主要抗氧化剂中和自由基,保护细胞免受氧化损伤。
2. **代谢终产物的生成**
- **牛磺酸**:半胱氨酸经脱羧、氧化生成,参与胆汁酸结合和神经调节。
- **硫化氢(H2S)**:由CBS和胱硫醚γ-裂解酶(CSE)催化生成,作为气体信号分子扩张血管、抗炎。
- **硫酸盐**:半胱氨酸氧化后生成硫酸根(SO4^2-),以PAPS形式参与解毒和结缔组织合成。
3. **二氧化硫(SO2)的产生**
半胱氨酸亚磺酸经天冬氨酸转氨酶作用生成亚磺酰丙酮酸,水解后释放SO2,调节血管张力与炎症反应。
*三、代谢调控与生理功能**
1. **甲状腺激素的调节**
甲状腺激素增强线粒体氧化代谢,提升胱硫醚裂解酶等酶活性,促进H2S和牛磺酸生成。
2. **跨器官协作**
- **肠道菌群**:部分菌群(如外阴拟杆菌)参与蛋氨酸代谢,影响宿主Hcy水平和甲基化状态。
- **心血管保护**:H2S和牛磺酸协同降低血压、抑制动脉粥样硬化,SO2通过调节内皮功能减轻心肌损伤。
3. **能量代谢整合**
蛋氨酸循环消耗ATP,而半胱氨酸代谢产物(如乙酰辅酶A)进入三羧酸循环供能,连接氨基酸与能量代谢。
*四、代谢异常与疾病关联**
1. **高同型半胱氨酸血症**
维生素B12或叶酸缺乏导致Hcy蓄积,损伤血管内皮,增加心脑血管疾病风险。典型疾病如**同型胱氨酸尿症**(CBS缺乏)引发血栓、晶体脱位。
2. **肿瘤代谢重编程**
肝癌等肿瘤中蛋氨酸依赖性增强,限制蛋氨酸摄入可抑制肿瘤生长。Hcy代谢异常与DNA甲基化紊乱促进癌变。
3. **氧化应激相关疾病**
半胱氨酸代谢障碍导致GSH减少,加剧帕金森病、糖尿病等疾病的氧化损伤。
*五、临床应用与检测**
1. **生物标志物**
- **血清Hcy**:>15 μmol/L提示心血管风险及维生素B12/叶酸缺乏。
- **尿硫测定**:评估含硫氨基酸分解代谢效率,用于营养干预监测。
2. **治疗策略**
- **营养干预**:补充维生素B6、B12和叶酸降低Hcy;牛磺酸或H2S前体(如NaHS)改善心血管功能。
- **靶向代谢酶**:抑制CBS或CSE活性调节H2S水平,治疗肺动脉高压。
总结
含硫氨基酸代谢通过甲基循环、转硫途径及气体信号分子生成,整合了表观遗传调控、抗氧化防御和能量供应等功能。其代谢网络异常与心血管病、肿瘤及遗传病密切相关,临床中需结合代谢标志物与靶向干预实现精准调控。
(3)含硫氨基酸的代谢:
体内的含硫氨基酸有蛋氨酸、半胱氨酸及胱氨酸。这三种氨基酸的代谢是相互联系的,蛋氨酸可以转变为半胱氨酸和胱氨酸,半胱氨酸和胱氨酸也可以相互转换,但半胱氨酸及胱氨酸不能转变为蛋氨酸。蛋氨酸分子中含有S-甲基,通过各种转甲基作用可以生成多种含甲基的重要生理活性物质,如肾上腺素、肌酸、肉碱等。半胱氨酸含有巯基(—SH),胱氨酸含有二硫键(—S—S—),二者可以相互转换。
蛋白质两个半胱氨酸残基之间形成的二硫键对维持蛋白质空间结构的稳定具有重要作用。体内许多重要的酶,例如琥珀酸脱氢酶、乳酸脱氢酶等的活性均与其分子中半胱氨酸残基上的巯基存在直接关系。

-
苯丙氨酸代谢(图5-17):
-
苯丙氨酸 →(苯丙氨酸羟化酶,需BH4)→ 酪氨酸
-
缺陷导致苯丙酮尿症(PKU)
-
酪氨酸可进一步代谢为:
-
黑色素(缺陷导致白化病)
-
多巴胺→去甲肾上腺素→肾上腺素
-
延胡索酸和乙酰乙酸
-
-

-
色氨酸代谢(图5-18):
-
可生成:
-
5-羟色胺(神经递质)和褪黑激素
-
烟酸(维生素B3前体)
-
乙酰CoA
-
-
芳香族氨基酸(苯丙氨酸、酪氨酸、色氨酸)的代谢过程涉及生物合成、分解代谢及跨器官协作,其核心路径与调节机制如下:
*一、生物合成途径**
1. **莽草酸途径(共同合成阶段)**
- **前体合成**:葡萄糖通过磷酸戊糖途径(OPP)生成赤藓糖-4-磷酸(E4P)和磷酸烯醇丙酮酸(PEP),两者缩合形成3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸(DAHP)。
- **关键酶**:DAHP合成酶(受苯丙氨酸、酪氨酸、色氨酸反馈抑制)催化限速步骤。
- **分支酸生成**:DAHP经多步反应转化为分支酸(CHA),成为三种氨基酸的共同前体。
2. **分化路径**
- **苯丙氨酸/酪氨酸分支**:分支酸通过变位酶(CM)生成预苯酸,再脱羧生成苯丙酮酸(苯丙氨酸前体)或氧化为对羟基苯丙酮酸(酪氨酸前体)。
- **色氨酸分支**:分支酸经邻氨基苯甲酸合成酶(AS)生成邻氨基苯甲酸,最终形成色氨酸。
- **优先顺序**:在微生物(如大肠杆菌)中,合成倾向为色氨酸 > 酪氨酸 > 苯丙氨酸。
二、分解代谢与功能**
1. **苯丙氨酸代谢**
- **转化为酪氨酸**:苯丙氨酸羟化酶(PAH)催化生成酪氨酸,需四氢生物蝶呤(BH4)辅因子。PAH缺陷导致**苯丙酮尿症**(PKU),苯丙氨酸蓄积转化为苯丙酮酸,损伤神经系统。
- **分解产物**:苯丙氨酸经转氨基生成苯丙酮酸,最终生成乙酰乙酸(生酮)。
2. **酪氨酸代谢**
- **儿茶酚胺合成**:酪氨酸羟化生成多巴,再转化为多巴胺、去甲肾上腺素、肾上腺素,调控神经传递和应激反应。
- **黑色素生成**:酪氨酸酶催化形成黑色素,酶缺陷导致**白化病**。
- **分解途径**:酪氨酸脱氨生成对羟基苯丙酮酸,最终分解为延胡索酸(生糖)和乙酰乙酸(生酮)。
3. **色氨酸代谢**
- **5-羟色胺(5-HT)**:色氨酸羟化生成5-羟色氨酸,脱羧形成5-HT,参与情绪和睡眠调节。
- **犬尿氨酸途径**:色氨酸经犬尿氨酸酶分解为烟酸(维生素B3前体)和丙氨酸。
- **吲哚衍生物**:肠道菌群代谢色氨酸生成吲哚类物质(如吲哚丙酸),调节免疫和代谢。
三、代谢调控机制**
1. **反馈抑制**
- **微生物调节**:大肠杆菌中DAHP合成酶存在三种同工酶(受不同氨基酸反馈抑制),黄色短杆菌则通过单一酶调控。
- **植物调控**:2024年研究发现**PGD2酶**连接OPP与莽草酸途径,增强碳通量流向芳香族氨基酸(Science China Life Sciences)。
2. **跨器官协作**
- **肠道菌群作用**:菌群代谢色氨酸生成吲哚衍生物,调控宿主免疫和能量代谢(如Nature Metabolism 2025年研究揭示菌群代谢物4HPAA抑制肥胖)。
- **肝脏与肌肉**:肝脏主导酪氨酸分解,骨骼肌通过转氨作用参与苯丙氨酸代谢。
3. **营养与激素调节**
- **必需氨基酸限制**:苯丙氨酸、色氨酸为必需氨基酸,需通过饮食摄入;酪氨酸可由苯丙氨酸转化。
- **甲状腺激素**:增强线粒体氧化能力,促进酪氨酸分解。
| 疾病 | 关键缺陷 | 临床表现 |
|---|---|---|
| 苯丙酮尿症(PKU) | PAH酶或BH4缺乏 | 智力障碍、癫痫、尿液苯丙酮酸升高 |
| 白化病 | 酪氨酸酶缺陷 | 皮肤/毛发色素缺失,畏光 |
| 同型胱氨酸尿症 | 胱硫醚合成酶缺陷(Hcy蓄积) | 血栓、骨骼异常、晶状体脱位 |
| AADC缺乏症 | 芳香族氨基酸脱羧酶缺陷 | 肌张力障碍、发育迟缓、自主神经异常 |
| 嗜铬细胞瘤 | 儿茶酚胺过量分泌 | 高血压、心悸、头痛 |
五、应用与研究方向**
1. **代谢工程**:通过基因编辑(如敲除反馈抑制酶、过表达限速酶)提高微生物生产芳香族氨基酸的效率(如大肠杆菌工程菌株产色氨酸效率提升40%)。
2. **疾病治疗**:
- **PKU管理**:低苯丙氨酸饮食、BH4替代疗法。
- **靶向干预**:抑制犬尿氨酸途径缓解抑郁症,调节吲哚代谢改善肠道炎症。
3. **营养与健康**:补充酪氨酸增强抗压能力,色氨酸调控睡眠-觉醒周期。
总结
芳香族氨基酸代谢整合了能量供应、神经递质合成、免疫调节等核心功能,其异常与遗传病、代谢综合征及肿瘤密切相关。研究聚焦于代谢网络调控、菌群互作及工程化应用,为疾病治疗和工业发酵提供新策略。
(4)芳香氨基酸的代谢:
芳香氨基酸包括苯丙氨酸、酪氨酸和色氨酸。苯丙氨酸和酪氨酸在结构上相似,在正常情况下苯丙氨酸的主要代谢途径是经苯丙氨酸羟化酶的作用生成酪氨酸;当苯丙氨酸羟化酶先天性缺乏时,苯丙氨酸不能正常转变成酪氨酸,体内的苯丙氨酸蓄积,并可经转氨基作用生成苯丙酮
酸,后者进一步转变成苯乙酸等衍生物,尿中出现大量苯丙酮酸等代谢产物,称为苯丙酮尿症(phenyl ketonuria,PKU)。
苯丙酮酸的堆积对中枢神经系统有毒性,故患儿的智力发育障碍。对此种患儿的治疗原则是早期发现,并适当控制膳食苯丙氨酸含量。酪氨酸经酪氨酸羟化酶的作用,生成多巴(3,4-二羟苯丙氨酸);再经多巴脱羧酶的作用生成多巴胺。多巴胺是脑中的一种神经递质,帕金森(Parkinson’s disease)患者,多巴胺生成减少。多巴胺在肾上腺髓质中可再被羟化,生成去甲肾上腺素,再经甲基化转变成肾上腺素。多巴胺、去甲肾上腺素、肾上腺素统称为儿茶酚胺。酪氨酸的另一条代谢途径是经酪氨酸酶合成黑色素,当人体缺乏酪氨酸酶时,黑色素合成障碍,皮肤、毛发等发白,称白化病(albinism)。酪氨酸还可经酪氨酸转移酶的作用生成对羟苯丙酮酸,再经尿黑酸等中间产物进一步变成延胡索酸和乙酰乙酸,二者分别参加糖和脂肪酸代谢。当体内尿黑酸酶先天性缺陷时,尿黑酸分解受阻,可出现尿黑酸尿症。色氨酸除经代谢转变成5-羟色胺外,还可代谢生成一碳单位和多种酸性中间代谢产物。分解可产生丙氨酸与乙酰辅酶A。此外,色氨酸分解还可以产生烟酸,但是合成量很少。

支链氨基酸代谢(图5-15)
支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)的特殊代谢:
-
首先由BCAT(支链氨基酸转氨酶)转氨
-
然后由BCKDH(支链α-酮酸脱氢酶复合体)氧化脱羧
-
最终产物:
-
亮氨酸 → 乙酰CoA + 乙酰乙酸(生酮)
-
异亮氨酸 → 乙酰CoA + 琥珀酰CoA
-
缬氨酸 → 琥珀酰CoA
-
支链氨基酸(BCAA)代谢是涉及亮氨酸、异亮氨酸和缬氨酸的复杂生化过程,其代谢路径具有器官特异性且受多重调控。以下从代谢步骤、关键酶调控、代谢产物去向及生理意义四方面解析:
### 一、代谢核心步骤
1. **转氨基作用(骨骼肌主导)**
支链氨基酸在支链氨基酸转氨酶(BCAT)催化下,将氨基转移至α-酮戊二酸,生成支链α-酮酸(BCKA)和谷氨酸。
- **BCAT分布**:BCAT1存在于胞质,BCAT2在线粒体,骨骼肌和肾脏中活性最高,肝脏几乎不表达。
- **意义**:此步骤将BCAA转化为可进入线粒体的BCKA,同时生成谷氨酸(参与氮代谢和神经递质合成)。
2. **氧化脱羧(线粒体限速步骤)**
BCKA在支链α-酮酸脱氢酶复合体(BCKDH)催化下脱羧生成支链酰基辅酶A(如异戊酰CoA、甲基巴豆酰CoA等)。
- **调控机制**:BCKDH活性由磷酸化(失活)和去磷酸化(激活)调节,PP2Cm蛋白磷酸酶和BCKDH激酶分别控制其活性。
- **关键点**:此步骤不可逆,是代谢通量的核心调控节点。
3. **终产物分解释放能量**
- **亮氨酸**:经β-氧化生成乙酰乙酸(生酮)和乙酰CoA,直接进入三羧酸循环。
- **异亮氨酸**:分解为乙酰CoA(生酮)和丙酰CoA(生糖),后者转化为琥珀酰CoA。
- **缬氨酸**:最终生成琥珀酰CoA(生糖),参与糖异生或三羧酸循环。
### 二、器官代谢差异
1. **骨骼肌**:BCAA代谢的主要场所,负责60%以上的分解代谢,尤其在运动中为肌肉提供能量。
2. **肝脏**:虽BCAT活性低,但通过调节BCKDH活性控制全身BCAA水平,并在应激时快速响应代谢变化。
3. **脂肪组织**:通过BCAA代谢产热调节体温,同时参与脂质代谢信号传导。
4. **肠道菌群**:部分菌种(如外阴拟杆菌)可促进BCAA分解,而另一些菌种(如科普里普雷沃菌)则驱动BCAA合成,影响宿主代谢稳态。
### 三、代谢产物与生理功能
1. **能量供给**:BCAA氧化产生的ATP占安静状态下肌肉能耗的14%,长时间运动中占比显著升高。
2. **信号调控**:
- **亮氨酸**:激活mTORC1通路,促进蛋白质合成并抑制自噬。
- **BCKA**:作为FGF21激活剂,增强脂肪氧化和胰岛素敏感性。
- **丙酰CoA**:通过丙酸-琥珀酸途径调节糖异生。
3. **氮代谢**:谷氨酸和谷氨酰胺作为氮载体,参与尿素循环和免疫细胞功能。
### 四、代谢异常与疾病关联
1. **枫糖尿病**:BCKDH基因突变导致BCAA及BCKA蓄积,引发神经毒性和代谢性酸中毒。
2. **胰岛素抵抗**:高BCAA水平通过抑制AMPK、激活mTOR-S6K1通路干扰胰岛素信号,与2型糖尿病密切相关。
3. **心血管疾病**:BCAA代谢产物(如3-羟基异戊酸)诱导内皮功能障碍,促进动脉粥样硬化。
4. **肿瘤进展**:癌细胞利用BCAA代谢重塑(如BCAT1过表达)支持增殖,并通过生成乙酰辅酶A影响表观遗传调控。
### 五、代谢调控的生理意义
1. **营养状态适应**:饥饿时BCAA分解增强,提供糖异生前体;高蛋白饮食下BCAA促进合成代谢。
2. **运动适应**:耐力运动中BCAA氧化占比显著增加,补充BCAA可延缓中枢疲劳(通过减少色氨酸入脑降低5-羟色胺生成)。
3. **跨器官协作**:肌肉分解BCAA产生的谷氨酰胺运输至肠道和免疫细胞,维持黏膜屏障和免疫功能。
(5)支链氨基酸的代谢:
支链氨基酸包括亮氨酸、异亮氨酸和缬氨酸,它们都是必需氨基酸,在体内的分解有相似的代谢过程,大致分为三个阶段:通过转氨基作用生成各自相应的α-酮酸;通过氧化脱羧生成相应的脂酰CoA;通过脂酸β-氧化过程,生成不同的中间产物参与三羧酸循环。支链氨基酸的分解代谢主要在骨骼肌中进行,而其他氨基酸多在肝脏代谢,这对外科手术、创伤应激等状态下肌肉蛋白质的合成与分解具有特殊重要作用。支链氨基酸可以作为合成肌肉蛋白质的原料;可被肌肉用作能源物质氧化供能;亮氨酸还可以刺激蛋白质合成,并抑制分解,在临床营养中具有重要意义。氨基酸除了作为蛋白质合成的基本原料外,还可以转变成其他多种含氮的生理活性物质,如嘌呤碱、嘧啶碱、甲状腺素、5-羟色氨等。

核心过程:色氨酸代谢通路
色氨酸(트립토판)是必需氨基酸,其代谢途径产生多种重要活性物质,图片中的许多物质属于该通路的产物或相关分子:
-
血清素(세로토닌):
-
色氨酸 → 5-羟色氨酸 → 血清素(调节情绪、睡眠的神经递质)。
-
-
褪黑激素(멜라토닌):
-
血清素可进一步转化为褪黑激素(调控昼夜节律)。
-
-
NAD+(辅酶):
-
色氨酸通过犬尿氨酸途径最终生成NAD+(参与能量代谢)。
-
其他关联代谢途径
-
神经递质合成:
-
GABA(由谷氨酸脱羧生成,抑制性神经递质)。
-
组胺(히스타민)(由组氨酸脱羧生成,参与免疫和过敏反应)。
-
-
氨基酸衍生分子:
-
牛磺酸(타우린)(由半胱氨酸代谢产生,调节胆汁酸和神经功能)。
-
谷胱甘肽(글루타티온)(由谷氨酸、半胱氨酸和甘氨酸合成,抗氧化剂)。
-
-
核苷酸前体:
-
嘌呤(퓨린)和嘧啶(피리미딘)(由甘氨酸、天冬氨酸等氨基酸参与合成)。
-
总结
这张图片展示的是色氨酸代谢及其下游产物的生化网络,同时涉及部分氨基酸的代谢分支(如神经递质、激素、辅酶的合成)。这些过程对维持神经系统功能、能量代谢和氧化平衡至关重要。可能是生物化学或生理学中关于氨基酸代谢与神经调节的教学内容。
如果需要更具体的某条通路细节(如色氨酸→血清素→褪黑激素),可以进一步说明!
1. **氨基酸**:
- 色氨酸(트립토판, Tryptophan)
- 谷氨酰胺(글루타민, Glutamine)
- 蛋氨酸(메티오닌, Methionine)
- 赖氨酸(라이신, Lysine)
- 苯丙氨酸(페닐알라닌, Phenylalanine)
- 丙氨酸(알라닌, Alanine)
- 苏氨酸(트레오닌, Threonine)
- 甘氨酸(글라이신, Glycine)
- 半胱氨酸(시스테인, Cysteine)
- 天冬氨酸(아스파트산, Aspartic acid)
2. **神经递质与激素**:
- 血清素(세로토닌, Serotonin)
- GABA(γ-氨基丁酸)
- 褪黑激素(멜라토닌, Melatonin)
3. **其他生物分子**:
- 组胺(히스타민, Histamine)
- 肌肽(카노신, Carnosine)
- NAD(烟酰胺腺嘌呤二核苷酸)
- 谷胱甘肽(글루타티온, Glutathione)
- 嘌呤(퓨린, Purine)
- 嘧啶(피리미딘, Pyrimidine)
- 卟啉(포르피린, Porphyrin)
- 鞘脂(스핑고지질, Sphingolipid)
- 牛磺酸(타우린, Taurine)
这些物质在生物体内参与多种代谢途径,如能量代谢、神经信号传递、蛋白质合成等。图片可能是用于生物化学或医学相关的学习或研究资料。

这张图片展示的是**谷胱甘肽(Glutathione)的氧化还原反应过程**,这是人体内最重要的抗氧化机制之一。以下是分步解释:
1. 谷胱甘肽是什么?
- **还原型谷胱甘肽(GSH)**:由三个氨基酸组成(γ-谷氨酸-半胱氨酸-甘氨酸),结构中的 **-SH(巯基)** 是它的活性部位,能直接清除自由基。
- **功能**:解毒、抗氧化、保护细胞免受氧化损伤。
2. 图片中的反应过程**
#### **(1)抗氧化作用(GSH → GSSG)**
还原型谷胱甘肽(GSH)遇到氧化剂(如过氧化氢,H₂O₂)时:
- 两个GSH分子通过 **-SH(巯基)** 结合,形成二硫键(-S-S-)。
- 同时将H₂O₂还原成无害的 **2 H₂O**(水)。
- 产物是 **氧化型谷胱甘肽(GSSG)**(图中 `γ-glu-cys-gly S-S γ-glu-cys-gly`)。
**化学式**:
**2 GSH + H₂O₂ → GSSG + 2 H₂O**
(2)还原再生(GSSG → GSH)**
身体会通过酶(如谷胱甘肽还原酶)和能量(NADPH),将GSSG重新还原成GSH,循环利用。
3. 为什么重要?**
- **对抗自由基**:GSH是人体内最强的抗氧化剂,能中和过氧化氢(H₂O₂)、脂质过氧化物等有害物质。
- **解毒**:帮助肝脏分解毒素(如酒精、重金属)。
- **免疫支持**:维持免疫细胞功能。
- **失衡的后果**:若GSSG堆积过多(氧化压力大),会导致细胞损伤、衰老或疾病(如炎症、阿尔茨海默病)。
总结**
这张图是**谷胱甘肽的抗氧化工作流程**:
**GSH(还原型)** 牺牲自己消灭自由基 → 变成 **GSSG(氧化型)** → 身体再把它还原回 **GSH**,周而复始。
类似“电池放电(抗氧化的GSH)→ 充电(再生的GSH)”的过程! 🔋

肉碱(Carnitine)合成
图片:카르니틴의 합성(图5-21)
-
过程:
-
从赖氨酸(3-하이드록시트라이메틸라이신)出发,经羟基化酶(需Fe²⁺/Fe³⁺和维生素C)生成三甲基赖氨酸。
-
进一步转化为4-부티로베타인,最终合成肉碱(카르니틴)。
-
-
功能:
肉碱帮助长链脂肪酸进入线粒体氧化供能(如运动时)。
肉碱(Carnitine)合成过程详解**
肉碱是一种关键的小分子化合物,主要功能是将**长链脂肪酸**从细胞质转运至线粒体基质中进行β-氧化(能量生成)。以下是其合成路径、调控及临床意义的系统解析:
1. 合成原料与组织分布**
- **主要原料**:
- **赖氨酸(Lysine)**(必需氨基酸,需从食物摄取)。
- **蛋氨酸(Methionine)**(提供甲基基团,需SAM参与)。
- **合成场所**:
- **肝脏**和**肾脏**是主要合成器官,肌肉等组织依赖血液运输获取肉碱。
2. 四步合成路径**
**(1)赖氨酸甲基化 → 三甲基赖氨酸(TML)**
- **反应**:
赖氨酸(ε-氨基) + **3×SAM**(甲基供体) → **三甲基赖氨酸(TML)**。
- **酶**:赖氨酸甲基转移酶(需维生素B₆)。
**(2)TML羟基化 → 3-羟基三甲基赖氨酸(HTML)**
- **反应**:
TML + **α-酮戊二酸** + **O₂** → HTML + **琥珀酸** + **CO₂**。
- **酶**:TML双加氧酶(需Fe²⁺和维生素C)。
**(3)HTML裂解 → 4-三甲基氨基丁醛(TMABA)**
- **反应**:
HTML → TMABA + **甘氨酸**。
- **酶**:HTML醛缩酶(需PLP,维生素B₆衍生物)。
**(4)TMABA氧化 → 肉碱(Carnitine)**
- **反应**:
TMABA + **NAD⁺** → 肉碱 + **NADH**。
- **酶**:TMABA脱氢酶(需FAD)。
3. 关键辅助因子与调控**
- **维生素依赖**:
- **维生素C**:维持TML羟基化酶中的Fe²⁺活性。
- **维生素B₆(PLP)**:参与HTML裂解反应。
- **叶酸/B₁₂**:支持SAM再生(甲基循环)。
- **调控因素**:
- **饮食**:赖氨酸和蛋氨酸不足时合成减少。
- **激素**:胰岛素促进肉碱吸收(肌肉组织)。
4. 肉碱的生理功能**
- **脂肪酸氧化**:
肉碱与长链脂肪酸结合形成**脂酰肉碱**,通过线粒体内膜上的**肉碱-脂酰转移酶系统(CAT-I/II)**转运。
- **能量代谢平衡**:
禁食或运动时,肉碱需求增加以动员脂肪供能。
5. 临床关联**
- **肉碱缺乏症**:
- **原发性**:遗传性合成酶缺陷(如TML羟化酶突变)。
- **继发性**:慢性肾病、肝硬化或长期TPN(全肠外营养)。
- **症状**:肌无力、低血糖、脂肪肝(β-氧化障碍)。
- **补充治疗**:
- **左旋肉碱(L-Carnitine)**用于遗传缺陷或透析患者。
- **误区澄清**:
健康人补充肉碱**不直接促进减肥**(足够内源性合成)。
合成路径图示**
```plaintext
赖氨酸 + 3SAM → 三甲基赖氨酸(TML)
↓(Fe²⁺/Vit C)
3-羟基三甲基赖氨酸(HTML)
↓(PLP)
4-三甲基氨基丁醛(TMABA)
↓(NAD⁺)
肉碱(Carnitine)
**记忆技巧**:
- **“赖氨酸穿三件甲基外套(SAM),经羟基化(Vit C)和拆解(B₆),最后氧化成肉碱”**。
- **“肉碱是脂肪酸的‘地铁票’,送它们进线粒体燃烧”** 🚇🔥。
如需具体酶的结构或疾病案例细节,可进一步扩展!

肌酸(Creatine)代谢
图片:크레아틴 대사(图5-22)
-
合成路径:
-
甘氨酸 + 精氨酸 → 胍基乙酸(구아니다노아세트산) → 在肝脏中甲基化(需SAM)生成肌酸(크레아틴)。
-
肌酸在肌肉中磷酸化为磷酸肌酸(크레아틴인산),作为能量储备(快速补充ATP)。
-
-
排泄:
肌酸代谢终产物为肌酐(크레아티닌),通过尿液排出。

氮排泄与尿素循环
图片:질소 배설(图5-23) & 요소회로(图5-24)
-
尿素循环:
-
氨(NH₃) + CO₂ → 氨基甲酰磷酸 → 与鸟氨酸结合生成瓜氨酸 → 最终合成尿素(요소)。
-
关键中间体:精氨酸(아르기닌)裂解为尿素 + 鸟氨酸(循环利用)。
-
-
氮排泄形式:
-
尿素(占大部分)、氨、尿酸、肌酐等(表格中列出每日排泄量)。
-
氮排泄与尿素循环(Nitrogen Excretion & Urea Cycle)详解**
氮排泄是机体清除有毒氨(NH₃)的核心过程,而**尿素循环**是这一过程的核心代谢通路。以下是分步解析:
1. 氮的来源与毒性**
- **来源**:
- 氨基酸脱氨基(尤其是肌肉和肠道)。
- 肠道细菌分解蛋白质产生的氨。
- **毒性**:
- 血氨(NH₃)浓度 > 50 μM 即会损伤中枢神经系统(如肝性脑病)。
2. 尿素循环(Urea Cycle)五步反应**
**场所**:线粒体(步骤1-2) + 细胞质(步骤3-5)
**关键酶与中间体**:
| **步骤** | **反应** | **酶** | **能量消耗** |
|----------|--------------------------------------------------------------------------|-------------------------|--------------------|
| **1** | NH₃ + CO₂ + 2ATP → **氨基甲酰磷酸** | 氨基甲酰磷酸合成酶Ⅰ(CPSⅠ) | 2 ATP → 2 ADP |
| **2** | 氨基甲酰磷酸 + **鸟氨酸** → **瓜氨酸** | 鸟氨酸氨甲酰转移酶(OTC) | - |
| **3** | 瓜氨酸 + **天冬氨酸** + ATP → **精氨琥珀酸** | 精氨琥珀酸合成酶(ASS) | 1 ATP → AMP + PPi |
| **4** | 精氨琥珀酸 → **精氨酸** + **延胡索酸**(进入TCA循环) | 精氨琥珀酸裂解酶(ASL) | - |
| **5** | 精氨酸 → **尿素** + **鸟氨酸**(循环利用) | 精氨酸酶(ARG) | - |
**净反应**:
**2NH₃ + CO₂ + 3ATP + H₂O → 尿素 + 2ADP + AMP + 2Pi + PPi**
3. 氮排泄的三种形式**
1. **尿素(主要形式)**:
- 肝脏合成,通过血液运输至肾脏排出(占排泄氮的80-90%)。
- **每日排泄量**:10-15 g氮(如图表所示)。
2. **氨(少量)**:
- 肾脏直接排氨(NH₄⁺),尤其在酸中毒时增强。
3. **尿酸/肌酐**:
- 嘌呤代谢产物(尿酸)和肌酸代谢产物(肌酐)。
4. 尿素循环与其他代谢的关联**
- **与TCA循环联动**:
- 延胡索酸(步骤4产物)→ 苹果酸 → 草酰乙酸 → 天冬氨酸(补充循环原料)。
- **与葡萄糖-丙氨酸循环**:
- 肌肉通过丙氨酸将氨基氮转运至肝脏,进入尿素循环。
*5. 调节与临床意义**
- **关键调节点**:
- **CPSⅠ**:受N-乙酰谷氨酸(NAG)激活(高蛋白饮食或Arg升高时增强)。
- **疾病关联**:
- **尿素循环障碍**(如OTC缺乏):血氨升高 → 呕吐、昏迷(需低蛋白饮食+苯甲酸钠排氨)。
- **肝衰竭**:尿素合成减少 → 血氨堆积(肝性脑病)。
总结图示**
```plaintext
[线粒体]
NH₃ + CO₂ + 2ATP → 氨基甲酰磷酸 → 瓜氨酸
[细胞质]
瓜氨酸 + 天冬氨酸 → 精氨琥珀酸 → 精氨酸 → 尿素 + 鸟氨酸(循环)
↓
延胡索酸 → TCA循环
**记忆技巧**:
- **“氨甲酰磷酸开篇,精氨酸收尾,鸟氨酸是快递员”**。
- **“尿素循环耗3ATP,2个在开头,1个在中间”**。
如果需要酶的结构细节或遗传性代谢病案例,可进一步展开!

非必需氨基酸合成
图片:비필수 아미노산의 합성(图5-25)
-
合成来源:
-
丙酮酸 → 丙氨酸
-
α-酮戊二酸 → 谷氨酸 → 谷氨酰胺、脯氨酸
-
草酰乙酸 → 天冬氨酸 → 天冬酰胺
-
-
特点:
这些氨基酸可由糖代谢中间体转化,无需从食物直接摄取。
### **非必需氨基酸(Non-Essential Amino Acids)的合成过程**
非必需氨基酸是指人体可以通过自身代谢途径合成的氨基酸,无需完全依赖食物摄入。它们的合成主要依赖于**糖代谢中间体**(如丙酮酸、α-酮戊二酸、草酰乙酸)和其他氨基酸的转化。以下是11种非必需氨基酸的合成路径分类说明:
1. 合成来源分类**
#### **(1) 来自糖代谢中间体**
| **氨基酸** | **合成前体** | **关键反应** |
|------------------|---------------------------|-----------------------------------------------------------------------------|
| **丙氨酸** | 丙酮酸(糖酵解产物) | 丙酮酸 + 谷氨酸 → 丙氨酸 + α-酮戊二酸(ALT酶催化,需维生素B₆)。 |
| **谷氨酸** | α-酮戊二酸(TCA循环中间体)| α-酮戊二酸 + NH₄⁺ → 谷氨酸(谷氨酸脱氢酶GDH催化)。 |
| **天冬氨酸** | 草酰乙酸(TCA循环中间体) | 草酰乙酸 + 谷氨酸 → 天冬氨酸 + α-酮戊二酸(AST酶催化)。 |
| **天冬酰胺** | 天冬氨酸 | 天冬氨酸 + 谷氨酰胺 + ATP → 天冬酰胺 + 谷氨酸(天冬酰胺合成酶催化)。 |
(2) 由其他氨基酸衍生**
| **氨基酸** | **合成前体** | **关键反应** |
|------------------|---------------------------|-----------------------------------------------------------------------------|
| **谷氨酰胺** | 谷氨酸 | 谷氨酸 + NH₄⁺ + ATP → 谷氨酰胺(谷氨酰胺合成酶催化)。 |
| **脯氨酸** | 谷氨酸 | 谷氨酸 → 谷氨酸-γ-半醛 → 脯氨酸(需NADPH和ATP)。 |
| **丝氨酸** | 3-磷酸甘油酸(糖酵解中间体)| 3-磷酸甘油酸 → 3-磷酸羟基丙酮酸 → 磷酸丝氨酸 → 丝氨酸(需NAD⁺和PLP)。 |
| **甘氨酸** | 丝氨酸 | 丝氨酸 + 四氢叶酸(THF) → 甘氨酸 + N⁵,N¹⁰-亚甲基-THF(丝氨酸羟甲基转移酶催化)。 |
(3) 特殊合成路径**
| **氨基酸** | **合成前体** | **关键反应** |
|------------------|---------------------------|-----------------------------------------------------------------------------|
| **半胱氨酸** | 蛋氨酸(必需氨基酸) + 丝氨酸 | 蛋氨酸提供硫原子,与丝氨酸结合生成半胱氨酸(需SAM和维生素B₆)。 |
| **酪氨酸** | 苯丙氨酸(必需氨基酸) | 苯丙氨酸 → 酪氨酸(苯丙氨酸羟化酶催化,需四氢生物蝶呤BH₄)。 |
| **精氨酸** | 尿素循环中间体(瓜氨酸) | 瓜氨酸 + 天冬氨酸 → 精氨琥珀酸 → 精氨酸(在肾脏中完成)。 |
2. 关键代谢通路**
#### **(1) 糖异生与氨基酸合成联动**
- **丙酮酸** → 丙氨酸(通过转氨基)。
- **草酰乙酸** → 天冬氨酸 → 天冬酰胺。
- **α-酮戊二酸** → 谷氨酸 → 谷氨酰胺/脯氨酸。
#### **(2) 一碳单位代谢**
- **丝氨酸** → 甘氨酸过程中释放一碳单位(用于嘌呤/胸苷酸合成)。
#### **(3) 硫代谢**
- **蛋氨酸**作为硫供体,参与半胱氨酸合成(需维生素B₆和叶酸)。
3. 调节与临床意义**
- **营养状态影响**:
- 长期蛋白质缺乏时,非必需氨基酸合成可能不足(如胶原蛋白需要的脯氨酸和甘氨酸)。
- **疾病关联**:
- **高氨血症**:谷氨酰胺合成障碍导致NH₃堆积。
- **PKU(苯丙酮尿症)**:苯丙氨酸无法转化为酪氨酸,需饮食控制。
总结图示**
```plaintext
[糖代谢中间体]
丙酮酸 → 丙氨酸
α-酮戊二酸 → 谷氨酸 → 谷氨酰胺/脯氨酸
草酰乙酸 → 天冬氨酸 → 天冬酰胺
[其他氨基酸衍生]
丝氨酸 → 甘氨酸
苯丙氨酸 → 酪氨酸
蛋氨酸 + 丝氨酸 → 半胱氨酸
```
**记忆技巧**:
- **“糖变丙,酮戊变谷,草酰变天冬”**(糖代谢前体对应氨基酸)。
- **“谷氨酰胺是氨的搬运工,半胱氨酸需要蛋氨酸送硫”**。
如果需要某个具体氨基酸的酶或反应细节,可进一步说明!

葡萄糖-丙氨酸循环
图片:글루코스-알라닌 회로(图5-27)
-
过程:
-
肌肉中:丙酮酸 + 谷氨酸 → 丙氨酸,释放到血液。
-
肝脏中:丙氨酸转氨基重新生成丙酮酸(用于糖异生)和谷氨酸。
-
-
意义:
将肌肉中的氨基氮转运到肝脏处理,避免氨中毒。
### **葡萄糖-丙氨酸循环(Glucose-Alanine Cycle)详解**
#### **1. 循环的核心作用**
- **生理意义**:
在空腹或运动时,肌肉通过分解蛋白质产生氨基氮(NH₃),但NH₃直接释放到血液中会中毒。
**葡萄糖-丙氨酸循环**将肌肉中的氨基氮以**无毒形式(丙氨酸)**转运到肝脏处理,同时为肝脏提供糖异生原料(丙酮酸)。
2. 循环步骤**
**(1) 肌肉中的反应**
- **原料**:
- 肌肉分解蛋白质 → 生成**氨基酸**(尤其是支链氨基酸,如亮氨酸)。
- 糖酵解 → 生成**丙酮酸**。
- **关键反应**:
```
丙酮酸 + 谷氨酸 → 丙氨酸 + α-酮戊二酸
(由丙氨酸转氨酶ALT催化,需维生素B₆)
```
- **结果**:氨基氮被“打包”成**丙氨酸**,释放到血液中。
**(2) 血液运输**
- 丙氨酸通过血液从肌肉转运至肝脏。
**(3) 肝脏中的反应**
- **丙氨酸脱氨基**:
```
丙氨酸 + α-酮戊二酸 → 丙酮酸 + 谷氨酸
(同样由ALT催化)
```
- **丙酮酸**:通过糖异生转化为**葡萄糖**(释放回血液供肌肉使用)。
- **NH₃**:进入尿素循环合成尿素排出。
3. 循环的意义**
- **排毒**:避免肌肉直接释放有毒的氨(NH₃)。
- **节能**:回收氨基氮和碳骨架,减少能量消耗。
- **能量平衡**:空腹或运动时维持血糖稳定。
循环图示**
```plaintext
[肌肉]
蛋白质分解 → 氨基酸 → NH₃ + 丙酮酸 → 丙氨酸
↑
糖酵解 ← 葡萄糖
[血液]
丙氨酸转运至肝脏
[肝脏]
丙氨酸 → 丙酮酸 → 糖异生 → 葡萄糖
↓
尿素循环 → 尿素(排出)
4. 临床关联**
- **肝功能障碍**:尿素循环受损时,丙氨酸堆积 → 高氨血症。
- **运动生理**:长时间运动后血丙氨酸水平升高,反映肌肉分解代谢增强。
**记忆技巧**:
“肌肉扔垃圾(NH₃),丙氨酸是快递员,肝脏是处理站!” 🚚

这张图片展示的是 **精氨酸(아르기닌, Arginine)在小肠和肾脏中的合成过程**,属于**尿素循环**和**氨基酸代谢**的一部分。以下是分步解析:
1. 核心过程:精氨酸的合成路径**
精氨酸是一种**条件必需氨基酸**(成人可合成,但婴幼儿需额外补充),其合成涉及以下关键步骤:
1. **起始物质**:
- **鸟氨酸(오르니틴, Ornithine)**(来自尿素循环或谷氨酸代谢)。
- **氨基甲酰磷酸(카바모일인산, Carbamoyl phosphate)**(由NH₃ + CO₂生成,需ATP)。
2. **反应链**:
- 鸟氨酸 + 氨基甲酰磷酸 → **瓜氨酸(시트룰린, Citrulline)**(在小肠中合成)。
- 瓜氨酸通过血液转运至肾脏,与**天冬氨酸(아스파트산, Aspartate)**结合 → **精氨琥珀酸(아르기니노숙신산, Argininosuccinate)**。
- 精氨琥珀酸裂解 → **精氨酸(아르기닌)** + **延胡索酸(푸마르산, Fumarate)**(进入TCA循环)。
2. 关键点说明**
- **组织分工**:
- **小肠**:合成瓜氨酸(需谷氨酰胺和脯氨酸代谢中间体)。
- **肾脏**:将瓜氨酸转化为精氨酸(最终释放到血液中供全身使用)。
- **与尿素循环的关系**:
精氨酸可进一步水解为**尿素** + **鸟氨酸**,完成尿素循环(排毒作用)。
3. 为什么重要?**
- **功能**:
- 精氨酸是合成**一氧化氮(NO)**的前体(扩张血管,调节血压)。
- 参与**蛋白质合成**和**肌酸代谢**(见其他图片中的肌酸合成)。
- **临床意义**:
- 精氨酸合成障碍可能导致高氨血症或生长发育迟缓。
图示总结**
```plaintext
[小肠]
谷氨酰胺/脯氨酸 → 瓜氨酸(시트룰린) → (血液转运) → [肾脏]
瓜氨酸 + 天冬氨酸 → 精氨琥珀酸 → 精氨酸(아르기닌)
```
**注**:图中部分名称是韩文拼写错误(如"이르기닌"应为"아르기닌")。
如果需要更详细的酶或调控机制,可以进一步说明!

脑内氨基酸代谢
图片:뇌에서의 아미노산 대사(图5-29)
-
神经递质合成:
-
色氨酸 → 血清素(세로토닌)
-
酪氨酸 → 多巴胺 → 去甲肾上腺素
-
谷氨酸 → GABA(抑制性递质)
-
-
能量供应:
谷氨酰胺(글루타민)和α-酮戊二酸参与三羧酸循环供能。
### **脑内氨基酸代谢过程详解**
脑内的氨基酸代谢主要涉及 **神经递质合成** 和 **能量供应**,以下是关键路径和功能:
1. 神经递质合成**
**(1) 兴奋性递质:谷氨酸(Glutamate)**
- **来源**:
- 由葡萄糖代谢产生的 **α-酮戊二酸**(TCA循环中间体)经转氨基生成。
- 谷氨酰胺(Glutamine)在星形胶质细胞中水解为谷氨酸。
- **功能**:
- 大脑最主要的兴奋性递质,参与学习、记忆。
- **代谢去向**:
- 转化为 **GABA**(抑制性递质)或重新合成谷氨酰胺(循环利用)。
**(2) 抑制性递质:GABA(γ-氨基丁酸)**
- **合成**:
- 谷氨酸 → **谷氨酸脱羧酶(GAD)**(需维生素B₆)→ GABA。
- **功能**:
- 抗焦虑、镇静(如安眠药靶向GABA受体)。
**(3) 单胺类递质**
- **血清素(5-HT)**:
- **色氨酸** → 5-羟色氨酸 → **血清素**(调节情绪、睡眠)。
- **多巴胺/去甲肾上腺素**:
- **酪氨酸** → 多巴 → **多巴胺** → 去甲肾上腺素(调控奖赏、应激)。
2. 能量供应**
- **谷氨酰胺-谷氨酸循环**:
- 神经元释放的谷氨酸被胶质细胞摄取 → 转化为谷氨酰胺 → 运回神经元重新利用。
- **支链氨基酸(BCAAs)**:
- 亮氨酸、异亮氨酸、缬氨酸可进入脑内氧化供能(尤其在饥饿时)。
3. 关键调节与临床意义**
- **血脑屏障选择性**:
- 中性氨基酸(如色氨酸、酪氨酸)需通过特定转运体进入脑内,竞争性吸收(高蛋白饮食可能影响血清素合成)。
- **代谢异常相关疾病**:
- **苯丙酮尿症(PKU)**:酪氨酸代谢障碍 → 智力障碍。
- **肝性脑病**:氨中毒干扰谷氨酸/GABA平衡 → 意识模糊。
总结图示**
```plaintext
葡萄糖 → α-酮戊二酸 → 谷氨酸
↓
GABA(抑制)
|
色氨酸 → 5-HT(情绪)
酪氨酸 → 多巴胺 → 去甲肾上腺素(警觉)
谷氨酰胺 ⇄ 谷氨酸(能量循环)
```
**学习提示**:
- 关联记忆:**谷氨酸(兴奋)→ GABA(抑制)** 是脑内最重要的“阴阳平衡”。
- 临床联系:抗抑郁药(如SSRIs)靶向血清素代谢,镇静药(如苯二氮䓬类)增强GABA作用。
如果需要某个具体路径的酶或分子机制,可进一步展开!


























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








