RPPA联合空间蛋白组MultiOmyx
深度剖析胃癌基质微环境
随着肿瘤的治疗向着精准化、个体化的发展,多维度、多组学的空间联合研究逐渐成为研究肿瘤微环境的重要手段,非因生物也一直致力于通过RPPA蛋白组学和空间组学的结合,利用其定量能力、重复性、大样本分析比对能力上的优势,助力癌症转化医学研究和个体化临床诊疗。
本篇解读的题为“Stromal-Based Signatures for the Classification of Gastric Cancer”的文章,其研究团队即是通过空间组和蛋白组技术连用,对胃癌基质表型和分子分型之间的相关性进行了分析(图1)。

图1注:2016年发表于《Cancer Research》(DOI:10.1158/0008-5472)
研究背景
胃癌是全球癌症致死率第二高的疾病,在亚洲发病率最高。转移性胃癌的治疗包括化疗、Her2 和VEGFR2 单克隆抗体的靶向治疗,但是患者中Her2过表达比例普遍只有15%到20%。因此,大多数患者主要依赖化疗和抗血管生成两种治疗手段。
从bulk样本入手的基因组分析已经满足不了复杂的肿瘤生物学与肿瘤微环境机理研究,该研究通过RPPA蛋白组学和MultiOmyx多重免疫荧光技术的联合使用,实现了对组织样本的高维度分析,同时让研究人员更深入的探索肿瘤微环境中不同靶标之间的空间关系。
技术亮点
研究者利用RPPA功能蛋白组技术和MultiOmyx多重免疫荧光等技术,发现了基质特异性RNA和基于多重免疫组化方法得到的蛋白表达标志物,它们代表了胃癌中基质激活的不同阶段,用来区分哪些患者在接受抗血管生成和癌症免疫治疗后预后更理想。
研究思路
从表达谱入手,利用模型与生物信息学分析观察到了基于表达谱的免疫细胞浸润的动态模式,并预测免疫细胞可能对于新兴的基质疗法很重要。随后通过多重免疫荧光扩展,分析了20种血管和免疫细胞相关的标志物,发现了免疫细胞及基质微环境中的表型变化,并结合这两个维度,将胃癌分为四种基质类型:包括血管未成熟/非炎症型(VINI)、炎症型(I),血管成熟/炎症型(VMI)和血管成熟型(VM)。最后结合RPPA蛋白组技术对基质表型和基于多重免疫荧光方法得到的蛋白表达标志物进行了蛋白组分析与交叉验证,进一步与临床表征相结合,得到与生存相关的联系。
文章解读
研究人员首先通过17例胃癌患者人源异种移植模型(PDX)的测试,发现他们大多对于抗VEGFR2(DC101)药物的反应是不同的(图2A),并观察到基质类型与药效有一定的相关性。图2B的例子代表了两类极端情况:上图显示了一个类药效显著的肿瘤基质类型,有大量的大血管,很少缺氧蛋白表达(通过Glut1表达测量) 。下图显示一个无药物响应的肿瘤基质类型,只有小口径血管和显著缺氧蛋白表达。因此推测用基质表型来区分胃癌对基质靶向治疗的敏感性,具有巨大的潜在价值。

图2
团队接着利用腺病毒载体表达VEGF-A(Ad-VEGF-A164)的小鼠模型进行差异表达基因的生物信息学分析,揭示了肿瘤基质不同阶段的特征。通过一系列筛选,将肿瘤基质的差异基因缩小为108个(如图3A),这些基因根据其功能分为特征1(免疫细胞激活)、特征2(血管生成)、特征3(组织重塑)三种基质类型。
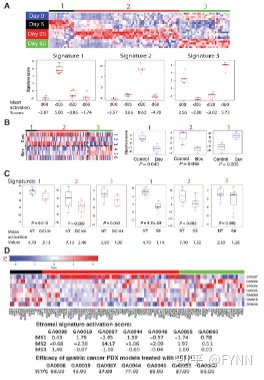
图3
作者将此108个差异基因应用于公共数据库可查的,Avastin(抗VEGF-A)治疗H1975 NSCLC异种移植模型动物的基因阵列数据集(图3B)。对照组样本显著富集特征1和2的基因,而特征3基因并没有被充分显示。与对照组相比,经Avastin处理的样本,特征1和2基因显著减少,同时特征3基因被富集到。作者还在Ad-VEGFA小鼠模型中利用Avastin(抗VEGFA抗体)进行验证,观察到了相似的结果(图3C)。这些数据显示靶向VEGF与靶向VEGFR2存在生物学差异。虽然在7个PDX模型中,特征2基因最高表达的一组确实药效最佳,但是其高表达是否可以预测DC101的疗效,仍需进一步验证(图3D)。
接着研究人员使用GE的MultiOmyx多重免疫荧光技术,集中研究了四个基因,其峰值表达在血管形成早期(CD34),中期(AQP1)、后期(vWF)及各个时间点之间变化。发现特定阶段的血管标志物可以区分病理性血管亚型。根据血管形成阶段将胃癌基质分为Lauren's“弥散型”和“肠型”。CD31染色作为显示各个时间点所有血管结构和内参使用;CD34主要染色早期和中期血管(见第5天和第20天),后期染色很淡(第60天)。AQP1不呈现早期血管染色,但中期表达较高。vWF表达主要在中后期血管中(图4A和B)。在血管生成中形成的最早的血管类型是MV和GMP,它们仅高表达CD34。随着血管成熟为VM,它们开始表达AQP1。随着附属组织的成熟,VM和毛细血管也开始表达vWF,并且CD34表达降低。最成熟的血管形式:AVM(包括进食动脉和引流静脉)仅表达vWF,无CD34或AQP1表达(图4B)。
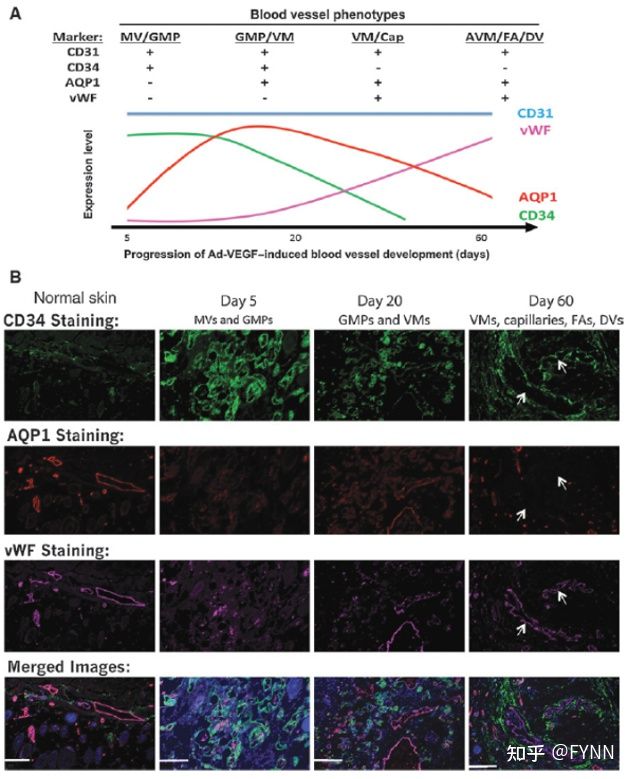
图4
接着团队利用胃组织微阵列(TMA)进行多重组织成像分析,并对CD31、CD34、vWF和AQP1四种能够定义血管面积的靶标进行染色,得到五种血管集群的表型:两种血管早期表型[CD34+/ AQP- / vWF] 和 [CD34+/ AQP1+/ vWF-]和三种血管后期表型[CD34+/ AQP1+/ vWF+]、[CD34-AQP1+/vWF+] 和 [CD34-, AQP1- / vWF+]。对于免疫细胞检测,分别染色CD3 (T细胞)和CD163(M2巨噬细胞)。根据早期和晚期血管百分比的阈值(覆盖面积>55%“晚期”,<55%“早期”)、M2巨噬细胞面积百分比(使用28%的临界值)和T细胞面积百分比(使用3.4%的临界值)从胃癌TMA样本中得出四种表型。
团队最后利用TCGA的RPPA蛋白组学数据,发现VM型与VMI型有相似的蛋白表达趋势;I型与VINI型有相似的蛋白表达趋势(图5A)。通过对ACRG数据集整合,将胃癌分为有血管生成和无血管生成两类,获得了区分度更稳定的生存曲线(图5B),数据还原为四种基质分型的类型,获得类似生存曲线(图5C)。因此,胃肿瘤的基质状态具有预后意义。

图5
技术介绍
非因生物拥有国内唯一的RPPA蛋白组学技术,可实现大规模样本(1000个以上)的几百种靶点平行分析;作为一种高通量靶向蛋白组学分析技术, RPPA具有其它高通量蛋白组学所无可比拟的超高灵敏度,可在10-15毫克组织中(半个米粒大小)或者60-80微克总蛋白中分析多达500种以上低丰度蛋白,包括大量细胞信号蛋白、免疫通路蛋白、修饰蛋白(磷酸化,乙酰基化,甲基化)等。
MultiOmyx是一种超重免疫荧光成像技术,可以在单个组织切片上同时研究多达60个蛋白,通过特殊的荧光擦除技术、背景自荧光矫正,并结合从高内涵成像技术转化而来的高精度连续成像技术对组织样本进行高精度扫描,同时结合HALO人工智能图像识别,对样本区域进行组织分类、定量和密度距离计算等其它基于单细胞研究的分析。





















 857
857











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








