胃癌(Gastric Cancer GC)作为全球死亡率第三的癌种,目前主流的联合化疗疗法副作用严重,疗效不理想。因此深入挖掘胃癌免疫调控机制,并寻找更优的治疗策略显得尤为重要。而迄今为止用于胃癌临床样本分析的技术手段对肿瘤微环境的深入剖析还存在诸多限制。
非因DSP空间多组学技术是针对肿瘤免疫和肿瘤微环境高精度、多维度分析的新一代空间组学技术,可以在单张切片上(FFPE或鲜冻)通过兴趣点选择(ROI),分析每个微环境微小区域内的多达100重蛋白组或18,000重全转录组的原位表达谱。
为了深入研究胃癌微环境的免疫机制,2021年6月新加坡国立大学癌症研究所Wei Peng Yong团队联合美国亚利桑那大学Yana Zavros团队,以DSP空间组学技术作为探索性工具,对胃癌TMA组织样本中多达40种免疫相关蛋白靶标进行检测分析,来揭示调控胃癌细胞内PD-L1表达的分子机制,并在 《Cancer Letters》杂志上(IF=8.679)发表了题为"Hedgehog transcriptional effector GLI mediates mTOR-Induced PD-L1 expression in gastric cancer organoids" 的文章(图1)。

图1
研究亮点
研究团队运用DSP技术,使用正常和胃癌患者胃组织TMAs芯片,从空间层面将胃癌患者的组织划分为上皮(肿瘤)、间质和免疫,通过免疫细胞相关蛋白的表达分析,对调控PD-L1表达的分子机制展开研究。研究团队建立了自体肿瘤/免疫细胞共培养系统,为研究PD-L1/PD-1阻断与免疫抑制细胞MDSCs的抑制作用提供了新的方法。该研究展现了组学分析、尤其是DSP空间蛋白组学数据在胃癌分子机制研究中的导向作用。
研究思路
研究团队从空间蛋白组入手,利用DSP技术分析正常组织和胃癌患者具有代表性的区域,寻找肿瘤组织内差异表达的免疫蛋白,发现MDSCs浸润被抑制,从而展开对PMN-MDSCs在胃癌TME调控PD-L1表达和CTL功能的研究。随后通过患者源性器官(PDO)/免疫细胞共培养物的建立,研究PMN-MDSC破坏检查点抑制对胃癌生存的影响。通过不同条件处理、检测形态、CTL增殖、细胞活性的变化,验证相关蛋白的表达,发现mTOR信号通路通过降低PD-L1的表达来提高胃癌免疫治疗的应答。
研究结果
1. PD-L1和PMN-MDSCs在胃癌TME中表达并抑制CTL增殖和效能
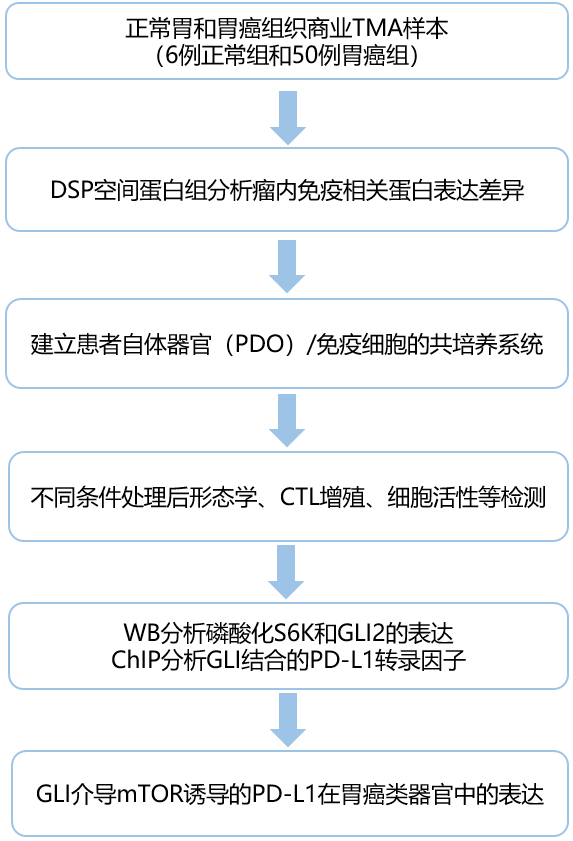
研究团队分别选用胃癌患者(n=50例)和正常胃(n=6例)的FFPE组织(TMA)样本,对40种特异性免疫相关蛋白进行DSP分析。通过形态学指导,将组织划分为上皮(肿瘤)、非免疫细胞间质和免疫细胞,在正常胃组织(图2A)和肿瘤微环境(图2B)中选取了6-12个感兴趣区域(ROI)。nCounter计数结果显示,与正常胃对照相比,胃癌患者组织中免疫抑制蛋白表达显著升高(图2C),同时患者组织的肿瘤(PanCK阳性)区域内PD-L1显著增加(图2D,E,F)。
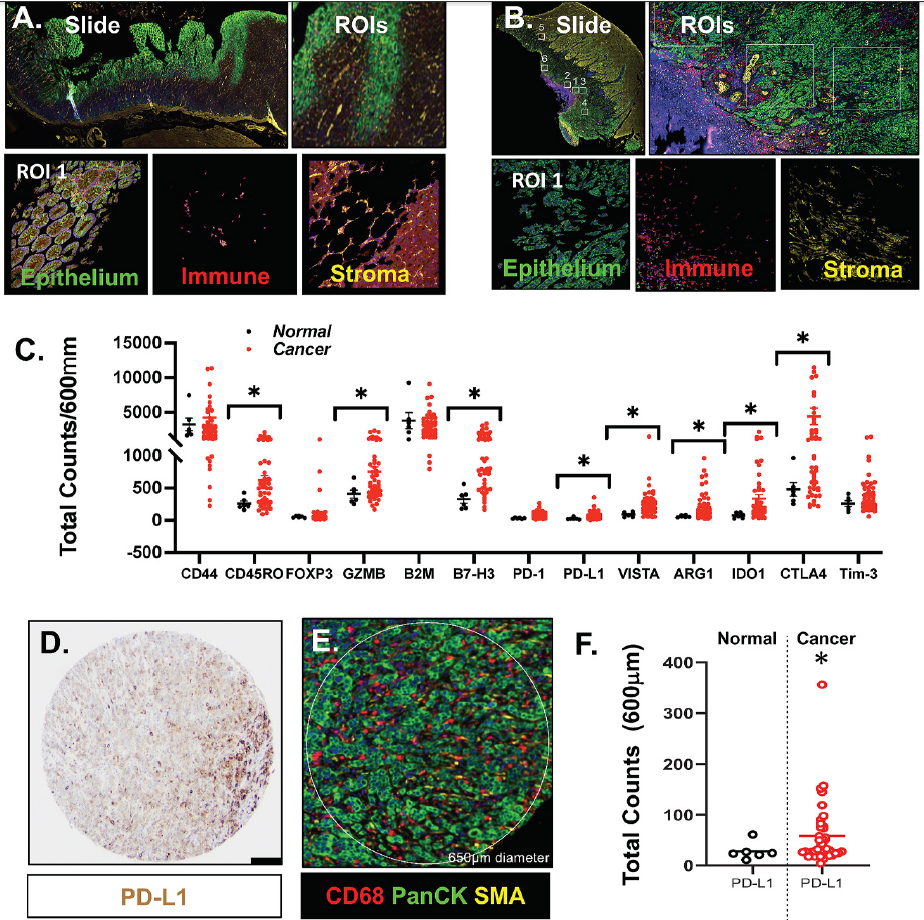
图2
2. PMN-MDCSs破坏了源性类器官/免疫细胞共培养检查点抑制的效果
为了研究PMN-MDSCs是否能消除检查点抑制对胃癌生存的影响,研究团队开发了一种胃癌类器官/CTL/MDSC共培养系统(图3)。
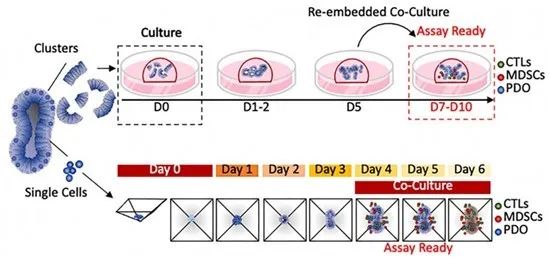
图3
研究团队对各实验组设置不同的药物处理,同时监测各组的类器官活力、CD8阳性细胞表达以及CTL增殖情况。结果显示,与未处理的对照(条件1)相比,用 nivolumab 处理(条件2)的自体类器官/ CTLs 共培养物表现出显著的类器官死亡。然而当PMN-MDSCs 添加到共培养物中时,这种反应被抑制(条件4)(图4)。
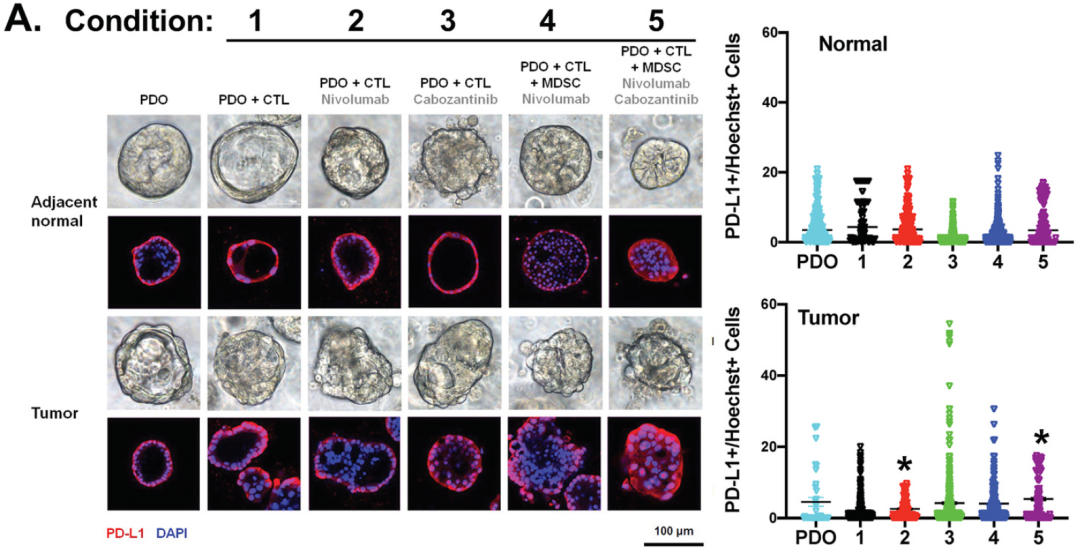
图4
同时研究团队使用 PD-L1 阳性的 MSI-H: IM95 胃癌细胞系衍生的类器官与 HLA (人类淋巴细胞抗原)匹配的 CTLs 和 MDSCs 免疫细胞作为阳性对照,建立共培养体系,作为表达 PD-L1 的 PDO 实验。在不存在 MDSCs 的情况下,使用 nivolumab 处理会促进 CTLs 增殖和类器官死亡,当 MDSCs 添加到共培养环境中(条件4),这些作用被消除。用 nivolumab 与 cabozantinib 联合处理含有 MDSCs 的共培养物时,诱导 CTLs 再次增殖,从而导致类器官死亡(条件5)(图5A,C,E)。
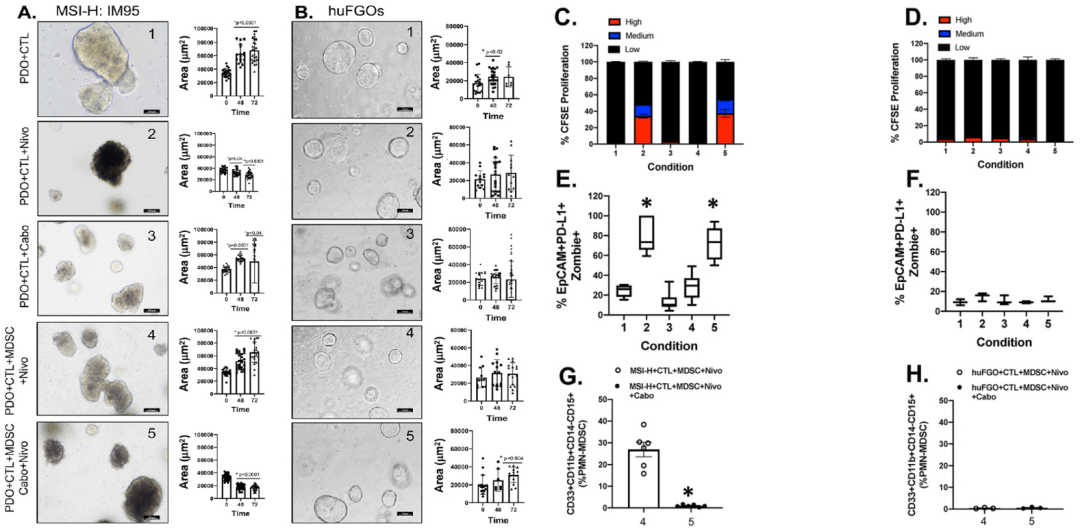
图5
在使用正常胃的类器官(huFGO)与患者匹配的自体 CTLs 和 MDSCs 免疫细胞进行共培养时,条件1-5 均未有反应(图5B)。在 MSI-H 和 huFGO 衍生类器官/ CTLs / MDSCs 共培养物中PMN-MDSCs显著降低(条件4 和5)(图5G-H)。
上述数据表明,在高表达 PD-L1 且对 nivolumab 治疗有反应的胃癌细胞系中,共培养物中 PMN-MDSCs 的存在抑制了 CTL 效应子功能,从而减少了癌细胞的死亡。
3. 雷帕霉素(rapamycin)使胃癌类器官对 CTL 诱导的细胞死亡敏感并阻断 GLI 对 PD-L1 的转录调控
在条件1(图6A)、条件2(图6B)和 条件3(图6C)中,类器官面积(用于衡量生长指标)在 72 小时内持续增加。nivolumab(条件4;图6D)或 rapamycin(条件5;图6E)单独处理时,类器官生长停止或减少。在条件6(图6F)和7(图6G)中,向共培养物中添加 MDSCs 可阻断nivolumab 和 rapamycin 联合处理的类器官死亡。然而,cabozantinib 和nivolumab(条件8;图6H)或 cabozantinib 和rapamycin(条件9;图6I)两种联合处理导致类器官面积显著减少。共培养条件表现出类器官面积减少作为细胞死亡增加的指示,与 PD-L1 表达的减少相关(图6D,E,H,I)。
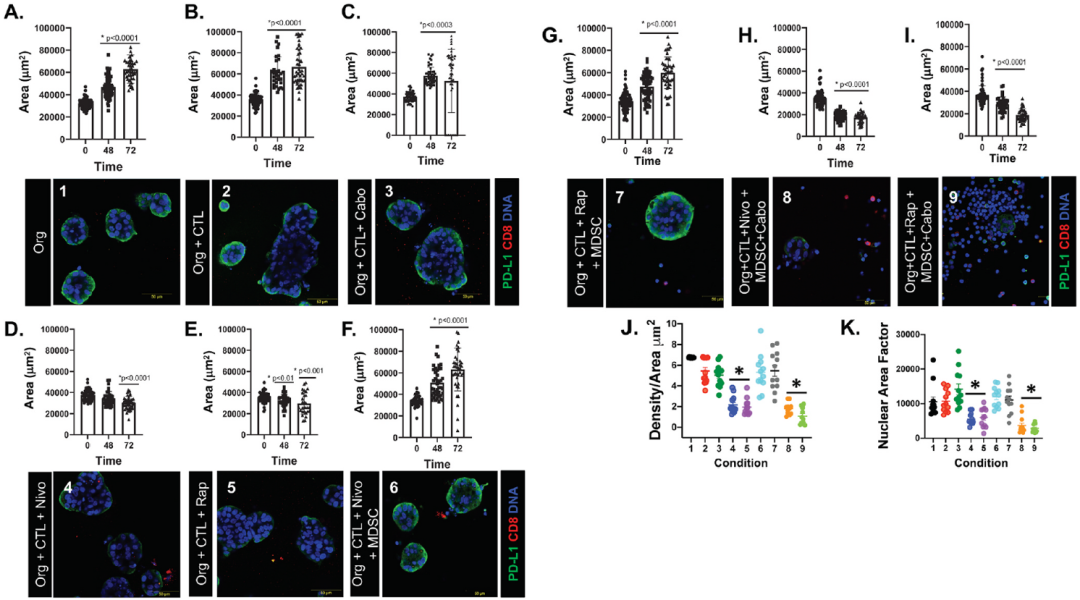
图6
在 rapamycin 处理的共培养条件下,观察到磷酸化S6K1 的显著下降(图7A),且与 GLI2 表达的显著降低相关(图7B)。ChIP分析显示rapamycin 或 GANT61(GLI 抑制剂)处理可阻断GLI1 和 GLI2 对 PD-L1的转录调控(图7C)。而GLI1 和 GLI2 对 PD-L1 的转录调控在用 vismodegib(特异性 hedgehog(Hh)抑制剂)处理的培养物中并未受到抑制(图7C)。
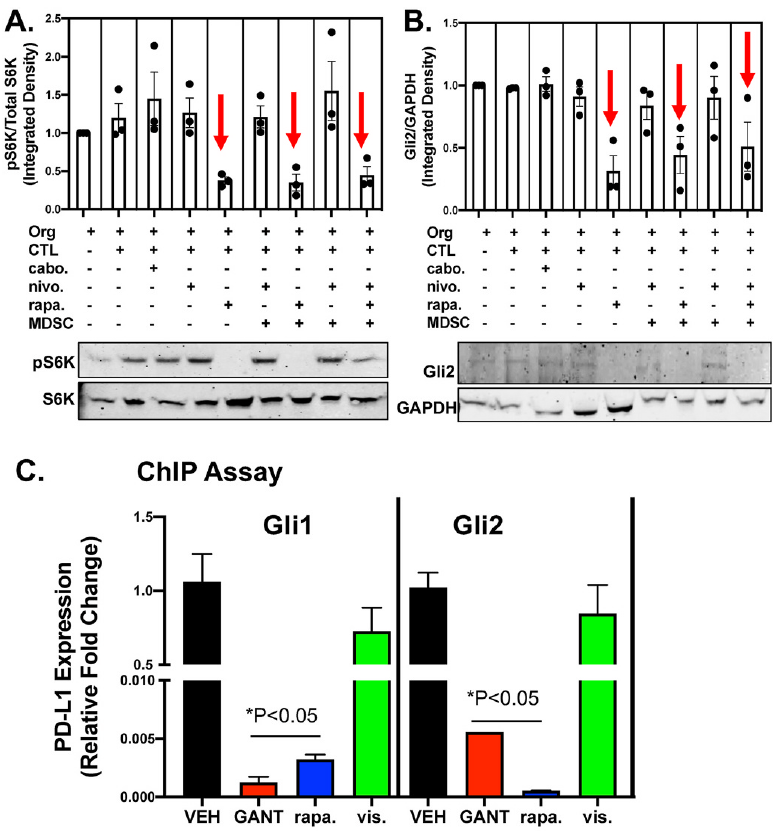
图7
总的来说,以上数据表明 mTOR 信号通路介导了 GLI 诱导的PD-L1在胃癌类器官中的表达。
文章总结
研究团队借助DSP空间组学技术,以多维蛋白组数据为切入点,深入研究调控胃癌细胞PD-L1表达的分子机制,为肿瘤研究提供了新的借鉴。同时,这项研究建立的胃癌器官/免疫细胞共培养系统中MDSCs介导的耐药治疗,进一步支持了临床验证,有助于胃癌患者未来的治疗。
非因生物率先引入DSP技术的空间多组学平台,搭建了国内第一个空间多组学实验室,目前已为近百个项目提供优质的空间多组学服务,包括DSP空间蛋白组、DSP-CTA癌症空间转录组以及DSP-WTA空间全转录组分析服务。拥有大量的项目开发经验、专业的技术支持和强大的生信分析团队,确保一流的技术服务能力和水平,为您的科研道路保驾护航。





















 857
857











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








