生物医学光学第六章作业
概述光镊的功能;
归纳总结光镊和光剪的共同特点;
简介光剪的基本原理;
概述激光压力弹射的优点。
光镊
光具有能量和动量,经典光学主要是以电磁辐射本身为研究对象,而近代光学的发展则是以光与物质相互作用为重要的研究内容。20世纪60年代激光的发明,为人们研究光与物质相互作用提供了一种崭新的光源,其中高简并度的激光束使得光镊技术得以问世。光镊技术是光的力学效应的典型实例,它直观充分的展现了光具有动量这一基本属性。光镊技术的发明不仅丰富和推进了光学领域的发展,也为光学与其他多学科的交叉融合架起了一座桥梁,彰显出了它独特而不可替代的作用。[1]
基本原理
光的动量和辐射压力
光具有能量和动量。当光波(无论是吸收还是散射)与物质相互作用时,它会将动量传递给物质。这一传递动量的效应可以产生力,被称为辐射压或光压。每当光子被物体反射或者吸收时,它们会将其动量的一部分转移给这些物体,推动物体移动。
聚焦激光束和光梯度力
在光镊中,一个重要的组成部分是高度聚焦的激光束。一般使用如Nd:YAG这样的激光器产生的激光,其波长适度调整以避免对生物样本造成过多的热损害。
-
生成光陷阱:通过显微镜的物镜,将激光束聚焦为一个极小的点。在这个焦点处,激光的光强达到最高,向外逐渐降低。
-
光梯度力:这种聚焦产生了一个空间光强梯度。当一个介电(非导电)粒子如细胞或塑料微球进入这个梯度区域,它将受到一种称为光梯度力的影响。此力将粒子拉向光强更高的区域,即激光聚焦点的中心。
-
稳定陷阱:在梯度最高的中心点,粒子体验到一个力的平衡点——任何偏离这一点的移动都会导致其受到指向中心的力,从而实现了粒子在三维空间内的稳定捕获。
散射力和吸收力
除了光梯度力之外,光镊中还存在其他两种力:
- 散射力:这是直接作用在粒子上由光子传递动量产生的力。当光子被粒子散射时,会向粒子传递动量,推动粒子沿光束传播方向移动。
- 吸收力:如果粒子吸收了一部分光能,会同样受到动量的传递,这也会推动粒子沿光束方向。
然而,在设计光镊时,系统通常尽量减少散射力和吸收力的影响,因为这些力会使得粒子沿着光轴移动,从而减少捕获的稳定性。
结构与设备
光镊装置一般包括以下几个部分:
- 激光源:提供所需波长的高强度、高稳定性激光。
- 空间滤波器和聚焦光学系统:确保激光光束的准直和焦点尺寸,通常使用物镜进行高倍聚焦。
- 样本舱:一般为显微镜载台,装载待操作的细胞或粒子。
- 控制系统:计算机或手动设备用于精确控制激光的位置和移动。
生物应用(功能)
光镊与细胞生物学
光镊发明初期,Ashkin等[2]首次用这个新的工具尝试操纵细胞和病毒等各种生物样品,并且成功地演绎了光镊捕捉、拖动、损伤细胞和深入到细胞内部操控细胞的功能。Ashkin预言“将细胞器从它们正常位置移去的能力,打开了精细研究细胞功能的大门”。Liang等[3]联合光镊和光刀对细胞和细胞器进行手术,感慨细胞工具箱里又多了一把镊子,用起来更方便了。光镊操控细胞和细胞器的手段是多种多样的,包括悬浮、移动、分选、融合等,还可以定量的测量细胞的力学性质以及细胞间的相互作用。
图1是早期将光镊操控单细胞功能和脉冲激光对细胞局部烧蚀的有机结合的一例。水稻中期分裂相细胞的染色体长度约2μm,线度小于1μm。由于尺寸较小,用细胞流式仪不易分离。先用脉冲激光刀破碎细胞,使染色体释放于胞外,然后用光镊俘获的方法,捕获一条目标染色体并将其拖离染色体群,实现单条染色体的分离。
对光镊提取的单条染色体可进行多聚酶链式反应扩增、电泳实验、杂交实验、DNA序列测量和同源性比较生物学实验,证明了光学微操作技术分选的是来自于水稻1号染色体[4-5]。生物学家认为,光镊-光刀方法适用于对任何一种植物和动物细胞中染色体的分选,是直接从活体细胞内提取,未进行任何处理的最原始的染色体俘获与分离方法,为转染色体动物活体移植提供新技术,开辟新的途径。

光镊与单分子生物学
光镊技术的亚纳米线的空间分辨率和飞牛顿级的力分辨率正好满足了体外研究单个生物大分子的条件,如研究生物单分子水平的微小作用力及运动步幅,测量天然或变异的单分子的速度、力、位移、周期和其他的物理量来解译生命运动的规律。光镊能够实时跟踪生物分子运动,获取单分子静态和动态的力学性质,已被越来越多地用于研究生化或者生物物理的精细过程,为定量研究生命规律和改造生命活动提供了一种不可或缺的研究工具。
光镊是通过微米“手柄”小球对大分子进行间接操控和测量。目前测量的方法已发展有多种,如单光镊、双光镊、光镊与微针结合等,都有很好的应用。还有光镊与光致旋转、光镊与磁镊,以及光镊与全内反射荧光技术结合等,形成独特的技术和方法,有效地解决了相应的科学问题。
研究驱动蛋白的动力学特性
驱动蛋白是一种生物体内用于产生机械力的酶,它能通过水解三磷酸腺苷(ATP)获得能量而沿着微管运动。
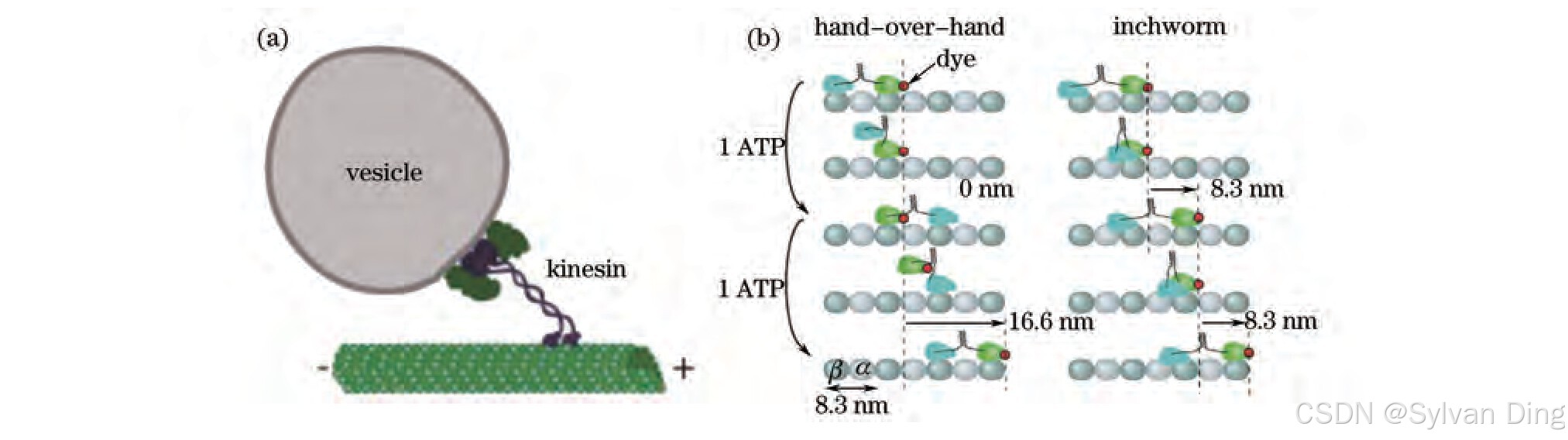
光镊研究驱动蛋白运动的实验方法如图2(a)所示,将微管固定在玻片的表面,将驱动蛋白预敷在200 nm的硅基小球上,然后用光镊将小球放置到微管上。在驱动蛋白的带动下,小球会沿着微管进行运动。图2(b)为驱动蛋白运动的实验分解图,在尺蠖模型(inchworm mechanism)中,驱动蛋白脚上的染料分子以16.6,0,16.6 nm的长度移动,如图2(b)左所示。染料分子以一致的8 nm长度,如图2(b)右所示。Paul Selvin利用荧光分子标记马达的一头跟踪马达头的运动。荧光曲线显示单个马达头以16 nm的步长前进。实验结果再次证明了驱动蛋白的运动方式为移交手模型[6]。
研究血管性假血友病因子蛋白
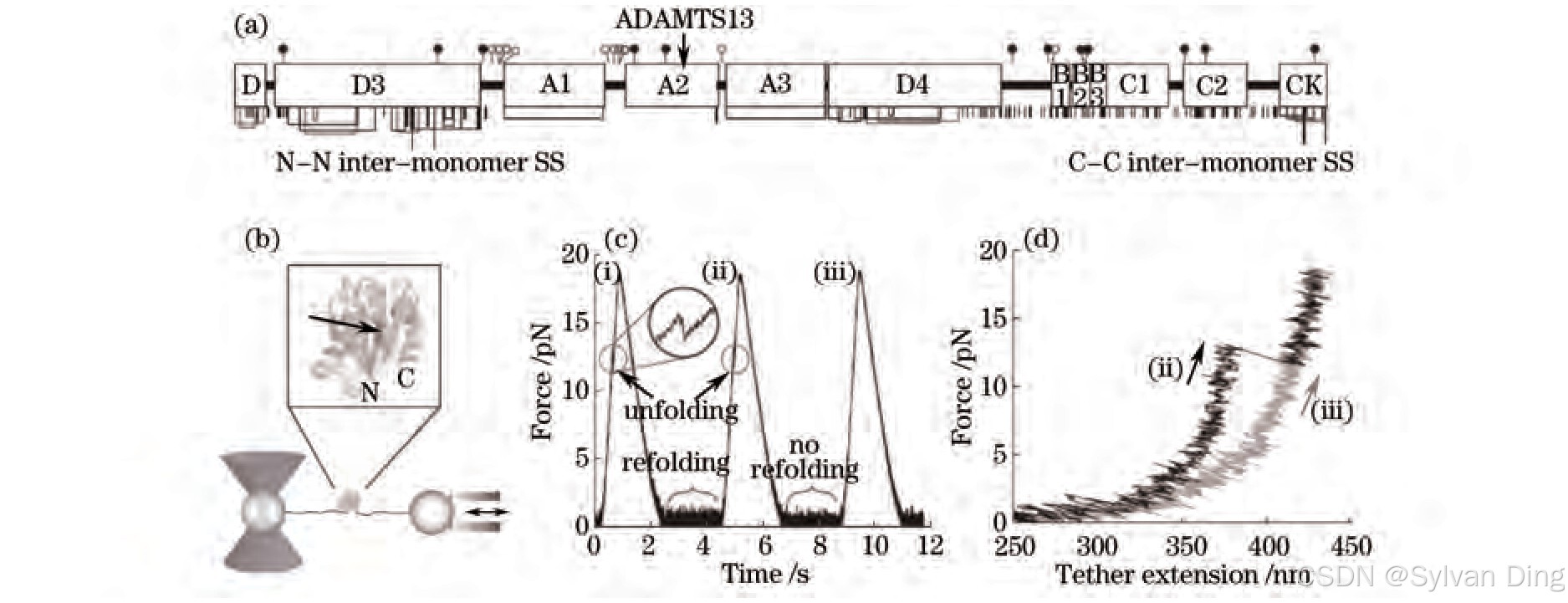
凝血是一个重要的生理过程,凝血过少会引起流血致死,而凝血活动过多则导致血栓形成,凝血能力与血管性假血友病因子(vWF)蛋白的长短有关。2009年,Zhang等[7]利用光镊和微针相结合,研究了vWF蛋白的去折叠和折叠过程,成功操纵了单个蛋白分子并实时观测其细微的结构变化。研究发现,该蛋白A2结构域对拉力敏感,在约10 pN的力作用下A2会失去其三维结构而去折叠,展开后的A2则会被ADAMTS13蛋白酶剪切导致vWF长度减少,如图3所示。
研究核糖体运动规律
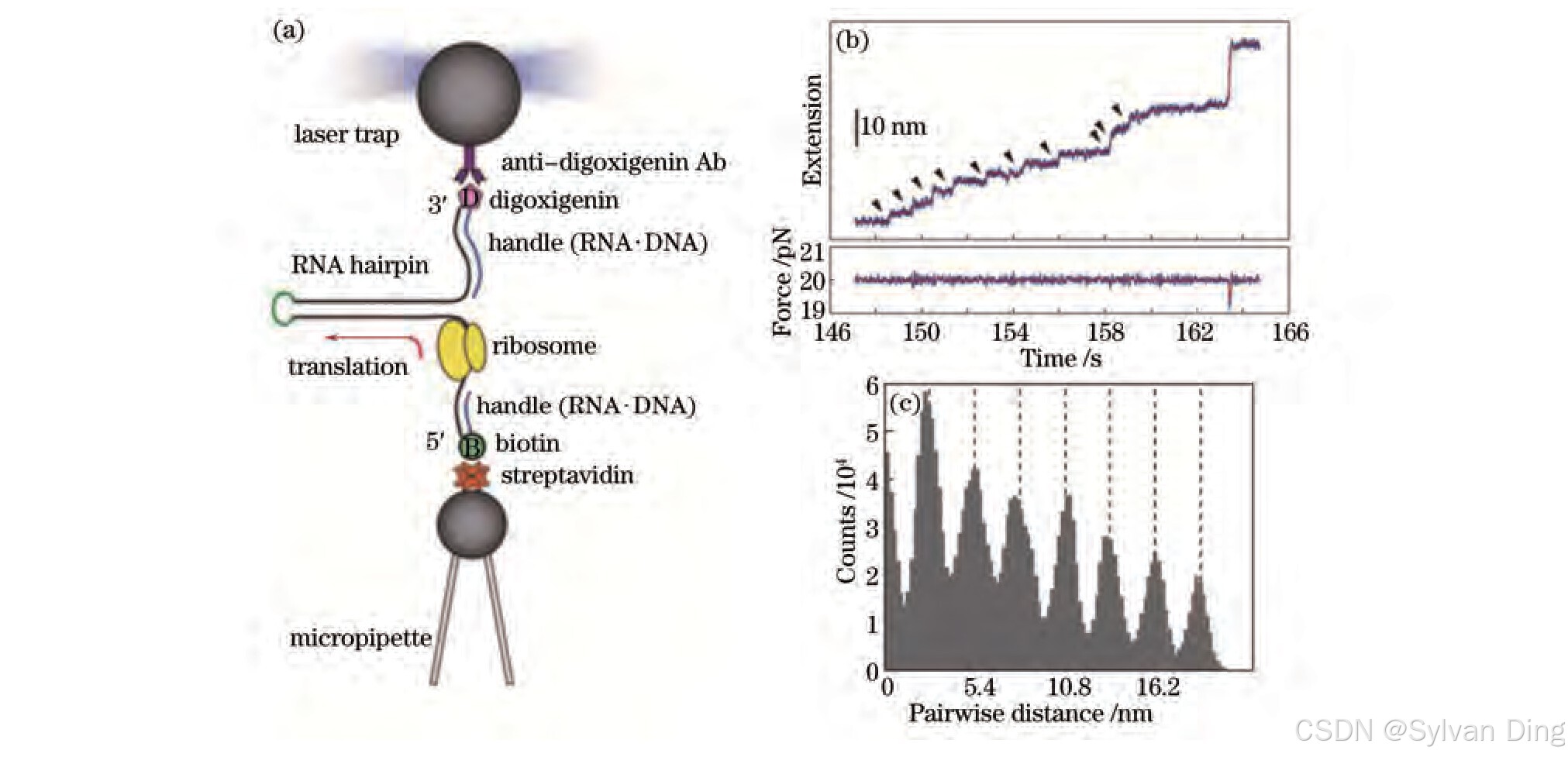
核糖体是细胞内蛋白质合成的场所,它通过读取信使核糖核酸cRNA核苷酸序列所包含的遗传信息,并使之转化为蛋白质中氨基酸的序列信息以合成蛋白质。因此,核糖体在生物的生命活动中具有非常重要的生理作用。2008年Wen等[8]研究了核糖体在翻译过程中的动力学特性,即其沿着信使RNA运动的精细动力学过程,并首次证明了核糖体在易位运动中存在3个亚步,如图4所示。
光镊与物理学
光镊在物理学领域应用,可以证实以前无法通过实验验证的物理规律,增进人们对于已有的物理现象和规律的认识,还能为物理的其他学科领域提供新的研究方法和实验技术,例如在光的力学效应验证和力的精确测量、声学显微、布朗运动、纳米技术、量子力学等应用,表明光镊正日益成为促进物理学进展的重要工具。
1907年,爱因斯坦认为能量均分定理适用于布朗微粒,但是因为单个微粒的瞬时速度变化太快,所以这个预言难以从实验上直接证明。2010年,Science杂志报道,采用光镊技术在真空中测量了微粒的瞬时速度,首次从实验上成功地验证了布朗微粒符合能量均分定理[9]。
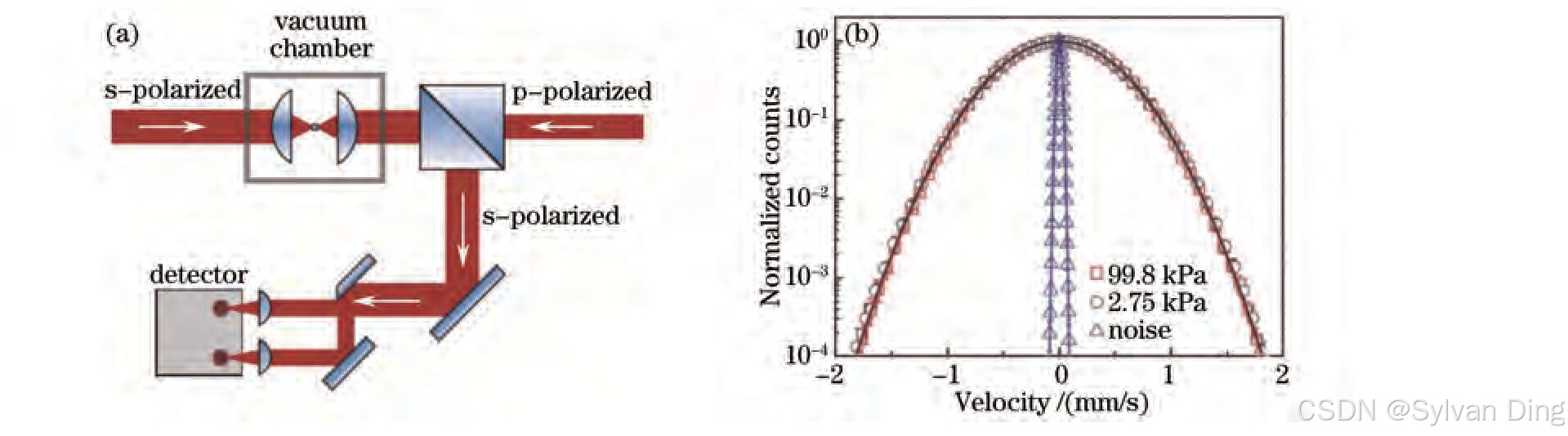
光镊测量布朗粒子的瞬时速度的方法,如图5(a)所示。利用两束正交偏振相向传播的光束形成的光阱将3μm小球悬浮在空中。采用快速的位置探测器,严格均等分开的两束探测光强信号的差别获取小球位置信息。系统测量的是x方向位移随时间的变化,得到小球的速度分布曲线如图5(b)所示。其中实线是麦克斯韦-玻尔兹曼速度分布曲线,三角信号是噪声,测量得到单个微粒的布朗运动的瞬时速度约等于0.422 mm/s,实验误差为0.021 mm/s。与能量均分定理的预期值(kBT/m=0.429 mm/s)很接近,从而直接证明了布朗运动的麦克斯韦-玻尔兹曼速度分布和能量均分定理。
该研究第一次实验揭示了布朗粒子在真空中运动的全过程。对布朗运动的精细研究使人们对布朗运动有了新的认识,也为这个古老的物理学分支注入了新的活力。Pusey等[10]评论布朗运动的研究已经开始进入到冲击区域,这也必将推动其在其他科学领域的应用。
光剪
光剪,或称光学剪辑技术,是一种在细胞生物学和微纳米领域中使用光来切割物质的技术。与光镊相似,光剪也利用激光,但主要用于切割或修改生物组织、单个细胞内组分及其他微小结构。光剪不但对生物医学研究产生了重大影响,特别是在遗传工程、细胞手术、药物传递系统以及生物组织工程等领域。
基本原理
光剪包含两个基本原理:光热效应和光化学效应。
光热效应
在光剪中,光热效应指的是激光能量被目标物质吸收并转化为热能,这一过程导致局部温度迅速升高,从而使材料蒸发或热分解。这一机制主要用于切割固体材料,如组织或各种高分子材料。详细步骤如下:
-
激光选择与吸收:选择合适波长的激光,使得目标材料能够有效吸收激光能量。不同的物质对不同波长的光吸收能力不同,如生物组织和细胞一般对近红外光有较高的吸收率。
-
热传导与限制:当激光聚焦到微小区域时,能量密集导致的温升仅限于极小的局部区域。这种精确的热驱动过程使得周围区域不会受到损伤或过度加热。
-
材料相变:在短时间内,局部温度升高到足以使材料发生相变,通常是蒸发或分解,从而实现切割或形成断裂。
光化学效应
光化学效应则是指通过光激发化学反应,而不直接利用热能来改变材料的结构。在生物医学中,这种方法尤其重要,因为它允许在不引起热损伤的情况下进行分子层面的操作。以下是其基本过程:
-
光激发:激光照射到含有光敏感分子的目标区域。这些光敏感分子在吸收光能后进入激发状态。
-
生成活性物种:激发状态的分子可能会产生自由基或其他活性化学中间体,这些形态极为活跃,能以极快的速度与邻近的分子发生反应。
-
化学键断裂:活性物种可以直接与DNA、蛋白质等生物大分子反应,导致化学键断裂或形成新的化学键。在基因编辑中,这可以导致目标DNA序列特定位置的切割。
设备配置
激光源
光剪装置的核心是其激光源。选择激光源时需考虑多个因素,包括激光的波长、功率、相干性以及脉冲持续时间。针对不同的应用,可能会使用不同类型的激光器:
- 连续波激光器(CW Laser):用于需要稳定输出的应用,如某些类型的光热切割。
- 脉冲激光器:提供高峰值功率,适用于需要短暂高能量的应用,如光切断DNA。常用的脉冲激光器有Nd:YAG、Ti:sapphire和飞秒激光器。
选择激光的波长通常取决于目标材料的吸收特性,以确保能量能被有效地吸收并转化为所需的作用(热能或化学反应)。
聚焦系统
聚焦系统通常包括多种光学元件,如透镜和光学过滤器,用于将激光光束聚焦到极细的点上。在此系统中,以下部件至关重要:
- 物镜:高品质的显微镜物镜用于聚焦激光到微米或亚微米尺度的小区域。物镜的数值孔径(NA)越高,聚焦能力越强,从而提供更小的焦点,实现更精确的切割。
- 光束扩展器(Beam Expander):用于调整激光束的直径,以适应不同的焦距和聚焦需求。
- 扫描器:将激光束快速准确地移动到目标位置。常见的扫描设备包括振镜和电动舞台。
控制系统
精确的激光控制是光剪操作的关键。这通常由一个集成的计算机系统进行管理,用于精确调控激光的定位、运动、输出功率和脉冲参数。软件接口允许操作者详细设定参数,并实时调整以优化手术过程。
显微系统
光剪设备通常与高级显微系统整合,以监控和引导切割过程。包括:
- 显微镜:通常使用倒置荧光显微镜,可以提供高分辨率的图像,帮助用户准确定位切割点。
- 成像系统:包括高灵敏度的摄像头和成像软件,用于捕获并分析操作前后的细胞或组织状态。
生物应用
激光剪的应用主要有三个方面:剪切、打孔和刺激。
用激光剪对显微镜下所见微粒如高尔基体、线粒体、核仁、染色体、纺锤体等实施切割或切除,有助于深入理解细胞结构和功能的关系。激光剪切术在妇产科已应用于临床,作为一种助育术。用激光剪削薄受精卵(人工实验室中受精)透明区的表面,可使该受精卵较易着床。与常规受精卵表面削薄术相比,激光剪不会给受精卵带来毒性化学物,因而避免了胚胎受损。利用这一激光助育术已使妇女怀孕率大为提高。
激光剪打孔主要是对细胞膜或细胞壁。激光剪打出的微孔,周边齐整、内壁光滑,且可在短时间内自行封闭。将外源遗传物质通过微孔导入细胞,外源导入的基因可在被打孔的细胞里得到表达。亦可将毛细管插入微孔,收集该细胞的内容物,分析其化学成分,以便在单细胞水平上准确判定与癌的发生相关的蛋白质,搞清该蛋白质浓度与癌的相互关系等。
激光剪的刺激作用是通过调节激光输出功率来达成的。其最大特点是激光剪对被照物并未实施物理切除,只是改变了被照物的某些化学和物理性质。如用激光剪照射分裂中的细胞染色体的某一部位,相差显微镜下可看到被照处有一不到1μm的亮区(折射率发生变化所致),该被照处虽未切除,但活性丧失。若用激光剪照射经光敏剂处理的单个细胞,则不仅可研究哪类细胞对光最敏感,又可研究细胞中哪一部分最易损伤,这无疑对阐明光动力学治疗肿瘤的机制极有帮助。
根据激光剪的主要应用,一把优良的激光剪必须符合两个基本要求:一是其照射靶点要十分精确;二是对靶点周围环境的损伤要小。目前的激光、精密加工以及光学色差校正技术,已能提供焦斑直径比激光波长还小的激光剪。如波长532nmNd:YAG激光剪,光斑直径仅为0.499μm,因此激光剪的精确性满足要求。
光镊和光剪的共同特点
共同特点总结
- 激光聚焦:无论是光镊还是光剪,都依赖于通过高质量的光学系统(通常是显微镜的物镜)来聚焦激光。这种聚焦允许以微米乃至纳米级别的精确度操纵光束。
- 激光束的属性调节:两者都需要对激光波长、功率、脉冲持续时间和聚焦特性进行精细控制以适应不同的应用需求。例如,光镊需要长波长的连续波激光避免对生物样品造成热损伤,而光剪可能采用脉冲激光以实现高能量输出,以便快速有效地切割生物组织。
- 显微系统:光镊和光剪通常都集成在显微镜系统中,以利用显微镜强大的成像和精确定位功能。这允许操作者观察样本,实时调整激光参数,并精确控制激光与样品的相互作用。
- 高分辨率和精确控制:两种技术都依赖高分辨率的光学映射技术,允许操作者观察和操纵细胞结构或单个分子。这种精度的实现在很大程度上得益于高质量光学元件(如物镜和空间过滤器)的应用。
光镊和光剪的联合使用
激光剪与激光镊联合使用,可使原来的实验操作变得更为简捷。比如用激光剪打孔导入外源基因时,在激光镊的帮助下,可将外源基因直接送入细胞膜上的孔中。也有用激光剪在牛卵细胞上打孔,用激光镊“挟”住精子直接送入孔中,提高动物的繁殖。再如用激光剪将粘附于载玻片上的中国仓鼠细胞染色体切成片段,然后用光镊来收集这些片段,其效率比用常规微玻璃针来收集要高得多。还有用激光镊将两个细胞紧紧靠在一起,再用激光剪切开相邻部分的细胞膜,两个细胞便轻而易举地融合为一个杂交细胞。
激光剪与激光镊联合使用,还使原本无法完成的实验变为切实可行。用激光剪切割细胞分裂中期的染色体,然后用激光镊阻止这些切下来的染色体片段朝中心体迁移,这样就能无创研究纺锤体的牵张力。还有在激光镊展直DNA链的实验中,用激光剪把两个塑料微球加热固定在载玻片上,就可以在高精度显微镜下观察检查DNA分子,最终就有可能探明酶是如何沿着DNA链运动的,搞清基因表达和DNA链修复等问题。[11]
激光压力弹射
激光压力弹射(Laser Pressure Catapulting, LPC)是一种先进的微操作技术,用于从组织切片或细胞培养中选择性地分离单个细胞或特定细胞区域。此技术起初主要应用于分子生物学,特别是用于对固定样品进行基因和蛋白质分析。[12-13]
基本原理
激光压力弹射工作原理基于利用激光脉冲直接对样品施加足够的光压力,从而使目标区域的物质从基底弹射出来。具体操作时,通常使用紫外或近红外激光通过精确聚焦,在样品附近快速沉积能量,产生一个小气泡,气泡的膨胀迅速将细胞或组织片段推离基底。
设备和方法
激光压力弹射系统通常包括:
- 激光源:现今多使用紫外激光(如氮气激光),因其能量高,更容易被生物材料吸收。
- 显微镜:用于精确定位激光和观察样品。
- 样品载台:载台上附有一层薄膜,样品放置于此膜上,以便于物质弹射后的收集。
- 计算机控制系统:用来设置激光参数和控制激光精确瞄准的位置。
应用领域
- 单细胞遗传分析:从复杂的组织中准确选取单一细胞进行基因表达分析。
- 蛋白质组学研究:分离特定细胞,进行后续的蛋白质提取和分析。
- 组织工程:获取特定类型的细胞或细胞簇,用于组织修复或疾病模型的建立。
关键优势
- 极高的选择性和精确性:LPC能够精确选择目标细胞或组织区域,这一点对于研究复杂组织或进行精确的分子分析尤其重要。此技术可以在微观水平上操作,具体到单个细胞乃至细胞内部结构,这对于研究疾病相关细胞的特定行为或基因表达模式十分关键。
- 非接触性质:LPC是一种非接触式操作技术,不需要物理工具如针头或电极直接触及样品,这减少了样品污染的风险,同时也降低了对细胞的物理损伤。这一点在处理高度敏感或容易被污染的样品时尤为重要。
- 无需化学标记:不同于某些需要前处理或化学标记的样本分离技术,LPC可以直接在未经任何化学处理的生物样本上工作。这种无需前处理的能力使得从生物样本中获得的结果更加真实和靠谱,不受化学标记可能引入的偏差影响。
- 样品的生物安全性:由于LPC操作时激光的热效应通常非常局限,它能保证周围未被选中的细胞或组织保持其原始状态而不受影响。这一点对于避免损害临近细胞或破坏样本结构至关重要,也使得整个样品的生物安全性和适用性得到提升。
- 快速和高效:LPC提供了快速直接的样本处理方法。与传统的显微手术或机械分离等方法相比,LPC可以在几秒钟内完成目标区域的选择和分离,显著提高了样本处理的效率和吞吐量。
- 多样的应用范围:LPC技术不仅限于单一类型的样本或分析,它可以用于处理固态组织、细胞培养、甚至是硬化的生物组织样本。此外,LPC适用于分子生物学、细胞学、组织工程和临床诊断等多个领域,展现出极高的适用性和灵活性。通过激光选择和转移的样本可以用于基因测序、蛋白质组学分析以及其他生物化学和分子生物学研究。
参考文献:
[1] 李银妹,龚雷,李迪,等.光镊技术的研究现况[J].中国激光,2015,42(1):9-28.
[2] A Ashkin,J M Dziedzic,T Yamane.Optical trapping and manipulation of single cells using infrared-laser beams[J].Nature,1987,330(6150):769-771.
[3] H Liang,M W Berns.Astral and spindle forces in Pt K2 cells during anaphase B:a laser microbeam study[J].J Cell Science,1993,104(4):1207-1216.
[4] H W Wang,X H Liu,Y M Li,et al…Isolation of a single rice chromosome by optical micromanipulation[J].J Opt a-Pure Appl Opt,2004,6(1):89-93.
[5] S Henon,G Lenormand,A Richert,et al…A new determination of the shear modulus of the human erythrocyte membrane using optical tweezers[J].Biophy J,1999,76(2):1145-1151.
[6] A Yildiz,M Tomishige,R D Vale,et al…Kinesin walks hand-over-hand[J].Science,2004,303(5658):676-678.
[7] X Zhang,K Halvorsen,C Z Zhang,et al…Mechanoenzymatic cleavage of the ultralarge vascular protein von Willebrand factor[J].Science,2009,324(5932):1330-1334.
[8] J D Wen,L Lancaster,C Hodges,et al…Following translation by single ribosomes one codon at a time[J].Nature,2008,452(7187):598-603.
[9] T Li,S Kheifets,D Medellin,et al…Measurement of the instantaneous velocity of a Brownian particle[J].Science,2010,328(5986):1673-1675.
[10] P N Pusey.Brownian motion goes ballistic[J].Science,2011,332(6031):802-803.
[11] 益保康,程关锠,郑道声.激光剪和激光镊在细胞生物学中的应用[J].应用激光,1998,(6):283-285.
[12] Schüitze K,Lahr G.Identification of expressed genes by laser-mediated manipulation of single cells[J].Nature biotechnology,1998,16(8):737-742.
[13] Emmert-Buck M R,Bonner R F,Smith P D,et al.Laser capture microdissection[J].Science, 1996,274(5289):998-1001.
❕ 部分内容由GPT生成,大多数内容复制于上述中文参考文献[1]和[11].

























 2563
2563

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








