引言
蛋白质设计是生物技术、生物医学、生物材料设计和生物修复等领域的重要基石。近日,一篇重要论文,提出了MProt-DPO框架,实现了蛋白质设计工作流的重大突破,在五个超级计算机系统上均达到了超过1 ExaFLOPS的持续混合精度性能,最高持续性能达到4.11 ExaFLOPS,峰值性能达到5.57 ExaFLOPS。
研究背景与挑战
蛋白质工程面临着巨大的挑战。以一个包含300个氨基酸的普通蛋白质为例,其可能的序列组合数高达20300(约2.037×10353),这使得通过实验手段来全面表征蛋白质的适应性景观几乎不可能。虽然高通量实验策略、深度突变扫描和定向进化等技术取得了进展,但蛋白质工程方法仍然面临着诸多限制。
MProt-DPO创新架构
1. 多模态输入设计

论文中的图1展示了一个样本蛋白质序列在多模态模型中的表示方式。该框架创新性地结合了:
-
蛋白质序列数据
-
基于物理化学性质的自然语言描述
-
实验观察结果
-
分子动力学模拟数据
2. DPO优化机制
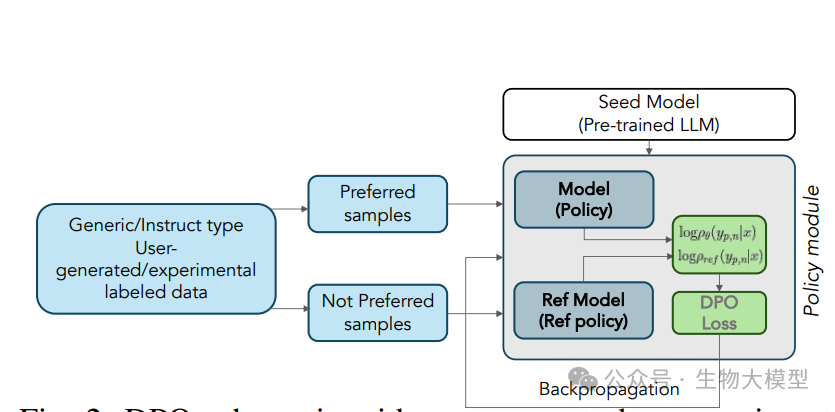
论文中的图2展示了DPO(Direct Preference Optimization)示意图。DPO优化过程可以表示为:
其中:
-
是正在微调的模型实例
-
是参考模型副本
-
p和n分别表示"首选"和"非首选"训练集部分
-
β是控制偏好对齐程度的参数
3. 工作流程创新
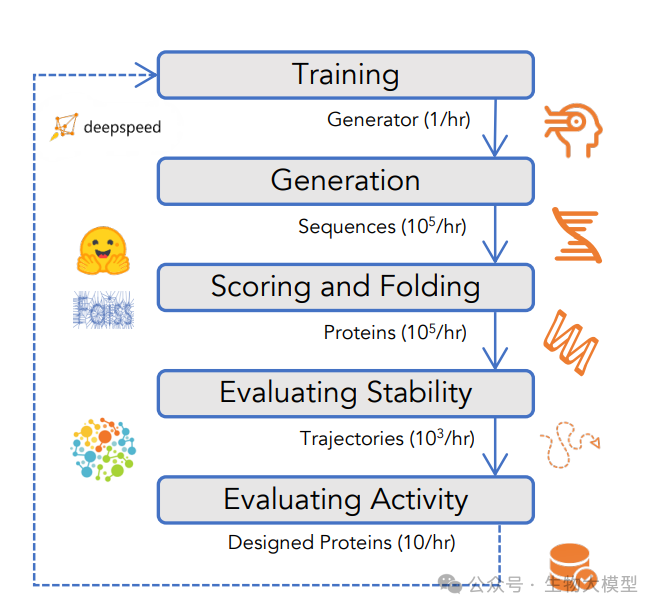
论文中的图5展示了蛋白质设计应用的完整工作流程,包括五个主要步骤:
-
训练过程
-
序列生成
-
评分和折叠
-
稳定性评估
-
活性评估
实验验证与突破性成果
1. 适应性调优效果
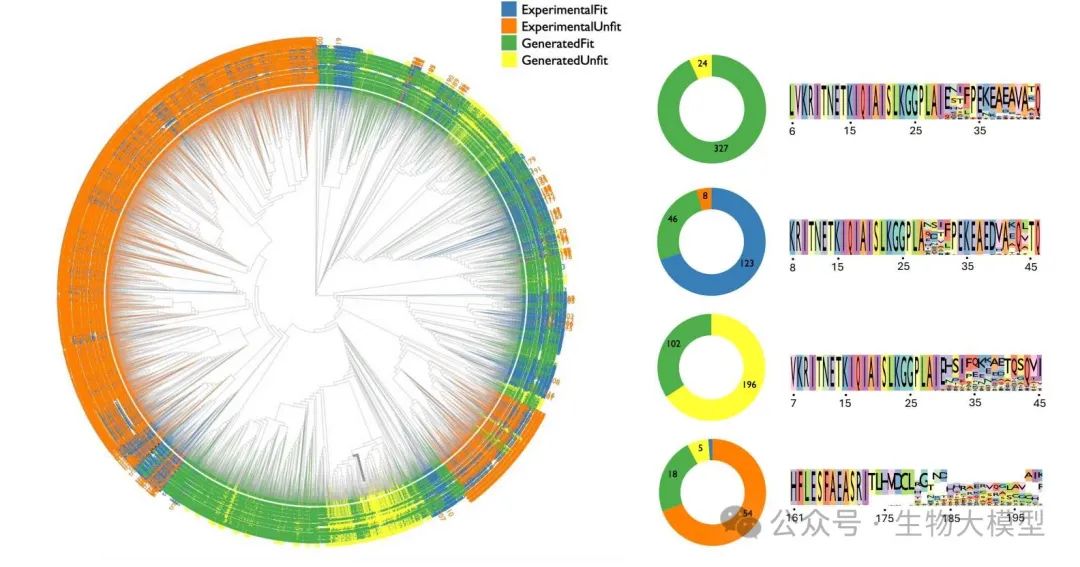
论文中的图3展示了酵母序列的系统发育树可视化结果。通过DPO训练:
-
生成的适应序列比例达到87%
-
相比训练数据集中66%的适应序列比例有显著提升
-
系统发育树分析显示了突变位点的保守性和优先性
2. 催化活性优化
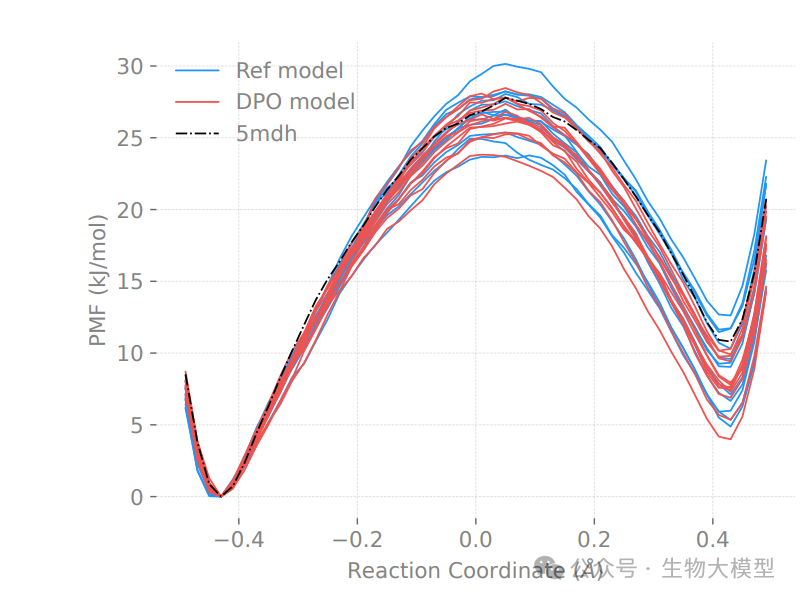
论文中的图4展示了苹果酸脱氢酶的EVB模拟结果:
-
反应势垒高度平均降低约1 kJ/mol
-
产物稳定性提升约2 kJ/mol
-
证实了DPO反馈机制的有效性
3. 计算性能突破
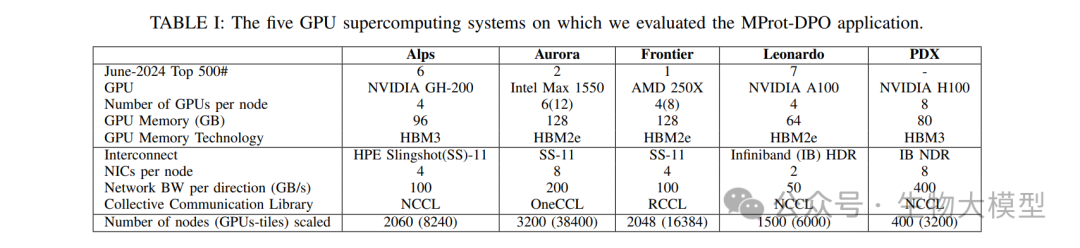
论文表I展示了在五个GPU超级计算系统上的评估结果:
-
Alps系统:2.92 ExaFLOPS持续性能
-
Aurora系统:4.11 ExaFLOPS持续性能(最高)
-
Frontier系统:1.06 ExaFLOPS持续性能
-
Leonardo系统:性能优化显著
-
PDX系统:1.29 ExaFLOPS持续性能

表III展示了每个系统的峰值和持续性能:
-
Aurora系统达到了5.57 ExaFLOPS的最高峰值性能
-
持续/峰值比率从0.73到0.93不等
-
模型FLOPS利用率(MFU)最高达到48.4%
重要影响与应用前景
- 蛋白质适应性景观理解
-
能够识别影响蛋白质适应性的关键突变位点
-
为定向进化实验提供指导
-
有助于理解补偿性突变的机制
- 蛋白质工程应用
-
支持通过自然语言提示进行新功能设计
-
整合多模态信息指导设计过程
-
提供可验证的设计约束条件
- 生物医药领域应用
-
支持生物治疗药物开发
-
辅助疫苗和抗体设计
-
为基因治疗提供新思路
结论
MProt-DPO框架代表了蛋白质设计领域的重要突破,不仅实现了前所未有的计算性能,更重要的是展示了多模态AI模型在生物工程中的巨大潜力。这项研究为未来的蛋白质设计、药物开发和生物技术进步开辟了新的道路。

Q&A环节:深入解析MProt-DPO十大关键问题
Q1: MProt-DPO框架中的DPO优化机制具体是如何工作的?为什么能够有效提升蛋白质设计的效果?
DPO(Direct Preference Optimization)是一个创新的优化机制,其工作原理可以分为以下几个关键点:
-
核心公式:
-
工作机制:
-
使用一个模型实例和其参考副本
-
通过"首选"和"非首选"样本进行训练
-
β参数控制偏好对齐的强度
-
通过简单的二元交叉熵目标进行优化
- 效果提升原因:
-
直接基于偏好数据调整策略
-
避免了传统强化学习方法的复杂性
-
能够有效整合实验反馈和模拟数据
Q2: 论文中提到的多模态输入是如何组织和处理的?这种设计有什么优势?
多模态输入的处理涉及以下几个层面:
- 数据模态:
-
蛋白质序列数据(20种氨基酸词汇)
-
自然语言描述(物理化学性质)
-
实验观察结果
-
分子动力学模拟数据
- 数据处理:
-
使用Llama2分词器进行处理
-
词汇表大小为32,256
-
使用特殊标记和标识序列
-
通过Biopython进行物理化学性质计算
- 优势:
-
提供了更丰富的上下文信息
-
能够整合多源数据进行决策
-
提高了模型的泛化能力
Q3: MProt-DPO在不同超级计算机系统上的性能差异是什么?造成这些差异的原因是什么?
系统性能差异表现:
- Aurora系统:
-
持续性能:4.11 ExaFLOPS
-
峰值性能:5.57 ExaFLOPS
-
持续/峰值比:0.73
- Alps系统:
-
持续性能:2.92 ExaFLOPS
-
持续/峰值比:0.92
-
MFU:41.7%
- 差异原因分析:
-
GPU架构差异
-
互连网络性能差异
-
通信库性能(如OneCCL vs NCCL)
-
系统规模和配置差异
Q4: 论文中提到的工作流程是如何实现动态任务调度的?这种设计有什么优势?
工作流程的动态任务调度包含以下要素:
- 五个主要代理:
-
Trainer:提交DPO训练任务
-
Generator:生成新序列
-
Score Storer:收集评分结果
-
MD Submitter:提交分子动力学计算
-
MD Storer:存储模拟结果
- 实现机制:
-
使用Colmena框架进行任务协调
-
Parsl实现不同规模并行性的融合
-
动态资源分配和任务优先级调整
- 优势:
-
提高计算资源利用率
-
实现任务的异步执行
-
支持灵活的工作流程调整
Q5: MProt-DPO如何评估生成蛋白质序列的质量?有哪些具体的评估指标?
评估体系包含多个层面:
- 序列层面:
-
ESM2预测器评估(准确率93.6%)
-
氨基酸组成分析
-
序列保守性分析
- 结构层面:
-
ESMFold预测3D结构
-
分子动力学模拟稳定性
-
EVB计算催化活性
- 功能层面:
-
DMS分数评估
-
反应势垒高度
-
产物稳定性
Q6: 论文中提到的蛋白质设计面临的计算复杂性挑战具体是什么?MProt-DPO如何应对?
计算复杂性挑战:
- 序列空间:
-
300个氨基酸的蛋白质有20^300种可能组合
-
传统实验方法无法穷尽探索
-
需要智能采样策略
- MProt-DPO的应对策略:
-
使用多模态信息减少搜索空间
-
DPO优化引导探索方向
-
集成实验反馈进行优化
- 计算效率提升:
-
分布式训练架构
-
动态任务调度
-
混合精度计算
Q7: 该研究在分子动力学模拟方面有什么创新?如何与AI模型集成?
分子动力学创新点:
- 模拟方法:
-
EVB方法评估催化活性
-
Umbrella Sampling采样中间态
-
WHAM方法计算势能面
- AI集成机制:
-
模拟结果作为DPO训练的反馈
-
动态调整序列生成策略
-
实时评估结构稳定性
- 效果验证:
-
反应势垒降低
-
产物稳定性提升
-
催化效率改善
Q8: MProt-DPO框架在处理大规模数据时的内存优化策略是什么?
内存优化策略:
- ZeRO优化:
-
ZeRO-1:优化器状态分片
-
ZeRO-2:优化器和梯度分片
-
ZeRO-3:参数分片
- 混合精度训练:
-
Aurora系统使用bf16
-
其他系统使用fp16
-
降低内存占用,提高计算效率
- 数据加载优化:
-
每个GPU使用两个数据加载工作器
-
动态批处理大小调整
-
I/O效率优化
Q9: 研究中提到的系统发育树分析揭示了什么重要信息?这对蛋白质设计有什么指导意义?
系统发育树分析揭示:
- 序列分布:
-
实验适应序列与非适应序列的聚类
-
生成序列的分布模式
-
突变位点的进化关系
- 突变特征:
-
关键功能位点的识别
-
补偿性突变的模式
-
适应性相关的共进化特征
- 指导意义:
-
优化突变位点选择
-
提高设计成功率
-
理解进化约束
Q10: MProt-DPO对未来生物医药领域会产生什么具体影响?有什么实际应用前景?
影响和应用前景:
- 药物开发:
-
加速抗体设计
-
优化疫苗研发
-
提高治疗靶向性
- 生物技术:
-
改进工业酶设计
-
开发新型生物材料
-
优化生物修复方案
- 方法论创新:
-
多模态设计范式
-
实验-计算协同优化
-
智能设计工作流
如何学习AI大模型 ?
“最先掌握AI的人,将会比较晚掌握AI的人有竞争优势”。
这句话,放在计算机、互联网、移动互联网的开局时期,都是一样的道理。
我在一线互联网企业工作十余年里,指导过不少同行后辈。帮助很多人得到了学习和成长。
我意识到有很多经验和知识值得分享给大家,故此将并将重要的AI大模型资料包括AI大模型入门学习思维导图、精品AI大模型学习书籍手册、视频教程、实战学习等录播视频免费分享出来。【保证100%免费】🆓
CSDN粉丝独家福利
这份完整版的 AI 大模型学习资料已经上传CSDN,朋友们如果需要可以扫描下方二维码&点击下方CSDN官方认证链接免费领取 【保证100%免费】

读者福利: 👉👉CSDN大礼包:《最新AI大模型学习资源包》免费分享 👈👈
对于0基础小白入门:
如果你是零基础小白,想快速入门大模型是可以考虑的。
一方面是学习时间相对较短,学习内容更全面更集中。
二方面是可以根据这些资料规划好学习计划和方向。
👉1.大模型入门学习思维导图👈
要学习一门新的技术,作为新手一定要先学习成长路线图,方向不对,努力白费。
对于从来没有接触过AI大模型的同学,我们帮你准备了详细的学习成长路线图&学习规划。可以说是最科学最系统的学习路线,大家跟着这个大的方向学习准没问题。(全套教程文末领取哈)

👉2.AGI大模型配套视频👈
很多朋友都不喜欢晦涩的文字,我也为大家准备了视频教程,每个章节都是当前板块的精华浓缩。


👉3.大模型实际应用报告合集👈
这套包含640份报告的合集,涵盖了AI大模型的理论研究、技术实现、行业应用等多个方面。无论您是科研人员、工程师,还是对AI大模型感兴趣的爱好者,这套报告合集都将为您提供宝贵的信息和启示。(全套教程文末领取哈)

👉4.大模型落地应用案例PPT👈
光学理论是没用的,要学会跟着一起做,要动手实操,才能将自己的所学运用到实际当中去,这时候可以搞点实战案例来学习。(全套教程文末领取哈)

👉5.大模型经典学习电子书👈
随着人工智能技术的飞速发展,AI大模型已经成为了当今科技领域的一大热点。这些大型预训练模型,如GPT-3、BERT、XLNet等,以其强大的语言理解和生成能力,正在改变我们对人工智能的认识。 那以下这些PDF籍就是非常不错的学习资源。(全套教程文末领取哈)

👉6.大模型面试题&答案👈
截至目前大模型已经超过200个,在大模型纵横的时代,不仅大模型技术越来越卷,就连大模型相关的岗位和面试也开始越来越卷了。为了让大家更容易上车大模型算法赛道,我总结了大模型常考的面试题。(全套教程文末领取哈)

👉学会后的收获:👈
• 基于大模型全栈工程实现(前端、后端、产品经理、设计、数据分析等),通过这门课可获得不同能力;
• 能够利用大模型解决相关实际项目需求: 大数据时代,越来越多的企业和机构需要处理海量数据,利用大模型技术可以更好地处理这些数据,提高数据分析和决策的准确性。因此,掌握大模型应用开发技能,可以让程序员更好地应对实际项目需求;
• 基于大模型和企业数据AI应用开发,实现大模型理论、掌握GPU算力、硬件、LangChain开发框架和项目实战技能, 学会Fine-tuning垂直训练大模型(数据准备、数据蒸馏、大模型部署)一站式掌握;
• 能够完成时下热门大模型垂直领域模型训练能力,提高程序员的编码能力: 大模型应用开发需要掌握机器学习算法、深度学习
CSDN粉丝独家福利
这份完整版的 AI 大模型学习资料已经上传CSDN,朋友们如果需要可以扫描下方二维码&点击下方CSDN官方认证链接免费领取 【保证100%免费】

读者福利: 👉👉CSDN大礼包:《最新AI大模型学习资源包》免费分享 👈👈
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








