脑小血管疾病是一组病理学状况,其中脑血管的改变导致中风和神经认知变化。最近,一种由紧邻脑血管的血管周围间隙组成的神经毒性废物清除系统,被称为脑淋巴系统,已被确定为脑稳态的关键参与者。鉴于脑小血管疾病和脑淋巴系统共享解剖结构,本文旨在在脑淋巴系统的背景下重新审视脑小血管疾病,并突出脑小血管疾病生理学的新方面。本文发表在Journal of Stroke and Cerebrovascular Diseases杂志。
材料与方法
本文重点关注那些研究脑小血管疾病各个方面的研究以及那些描述脑淋巴系统的工作。我们使用以下关键词在PubMed中搜索相关文献:glymphatics(脑淋巴系统)、cerebral small vessel disease(脑小血管疾病)、arterial pulsatility(动脉脉动性)、hypertension(高血压)、blood-brain barrier(血脑屏障)、endothelial dysfunction(内皮功能障碍)、stroke(中风)、diabetes(糖尿病)。
结果
脑小血管疾病与脑淋巴功能障碍在解剖上相连,并且两者之间共享显著的风险因素。这些风险因素包括:高血压、2型糖尿病、老龄、睡眠质量差、肥胖和神经炎症。已有明确证据表明,脑小血管疾病阻碍了脑淋巴系统的有效功能。
结论
这些共同的风险因素以及脑淀粉样血管病发病机制模型暗示,脑淋巴功能障碍可能独立地促进脑小血管疾病的发病。然而,现有证据支持一种级联功能障碍模型,即同时发生的小血管病和脑淋巴损伤阻碍了脑淋巴介导的恢复,并促进了亚临床疾病向临床疾病的进展。
关键词:
脑淋巴系统、脑小血管疾病、血管周围间隙、脑脊液、中风、痴呆
引言
脑淋巴系统是一个由血管周围间隙(PVSs)组成的连续网络,这些间隙也被称为Virchow-Robin间隙,伴随大脑血管存在,并促进脑脊液(CSF)从大脑穿透动脉向脑实质的对流流动。传统上,人们认为脑脊液的主要生理功能是通过为这些组织提供浮力来保护大脑免受外部力量的影响。然而,最近关于脑淋巴系统的发现挑战了这一观点。新的证据表明,脑淋巴系统在中枢神经系统(CNS)液体稳态、脑废物清除以及维持正常认知中发挥着重要作用。通过这种定向的液体流动,脑淋巴系统介导了间质液(ISF)、间质溶质、神经毒性废物和“脏”CSF从大脑静脉周围的PVSs流向蛛网膜下腔(SAS)的流出,后者则作为废物汇集区。这些解剖路径在大脑血管分区上表现出结构差异。在软脑膜内,PVSs由充满液体的空间组成。然而,随着血管进入和离开大脑,其PVSs被血管壁细胞(如平滑肌细胞和周皮细胞)、成纤维细胞以及在外膜侧的星形胶质细胞末端所围绕。尽管这些不同的细胞类型可能对脑废物清除有贡献,但大量令人信服的研究已经确立,星形胶质细胞末端是正常脑淋巴流动的主要介导者。在其末端,星形胶质细胞表达极化的Aquaporin-4(AQP4)蛋白的正交阵列,通过尚未发现的机制介导脑脊液从PVS流向脑实质的流动。
脑小血管疾病(CSVD)是一类异质性疾病,其特征是大脑小血管(静脉、微动脉、小穿通动脉、穿透动脉和毛细血管)的内皮功能障碍,最终导致白质和灰质的损伤。CSVD患病率很高,随着美国人口老龄化,其患病率只会增加,超过50岁的人群中有5%受影响,超过90岁的人群中100%受影响。尽管CSVD的亚临床期可以持续数十年,但CSVD是进行性的,可能导致腔隙性缺血性中风、脑内出血、认知衰退以及由白质疾病引起的平衡功能障碍。这些疾病可以通过CT或MRI可见的神经影像学标志物进行识别,如扩展/增大的血管周围间隙(EPVSs)、白质高信号(WMHs)、脑微出血(CMBs)和腔隙性梗死。传统上,人们认为CSVD中存在的大脑损伤是脑低灌注和缺氧的结果。然而,最近的证据表明,CSVD引起的神经元损伤是由缺氧以外的机制介导的。这促使我们探讨CSVD与脑淋巴系统之间的潜在联系。我们首先回顾了描述脑淋巴系统的解剖和生理的文献。在详细阐述脑淋巴系统功能后,我们接着介绍了在人类和小鼠中的研究工作,以说明已确定的CSVD风险因素和导致CSVD进展的因素如何与脑淋巴功能障碍相一致。最后,我们讨论了CSVD本身如何反过来可能导致脑淋巴功能受损,以及与CSVD相关的大脑损伤如何因脑淋巴废物清除不足而加速,尽管其在初始损伤中的作用尚待确定。
脑淋巴系统的解剖与生理
脑脊液的成分与产生
与人体内其他液体隔室相比,脑脊液(CSF)的成分相对独特。与血浆相比,CSF的葡萄糖浓度较低,蛋白质含量稀少。尽管血浆大约92%是水,CSF则是99%的水。这使得CSF成为CNS环境中有害的亲水性物质的有效溶剂,如可溶性的淀粉样β寡聚体和Tau蛋白形式。此外,K+离子的浓度约为3 mM,这一浓度低于血液中的浓度,对于脑中对钾敏感的兴奋性细胞至关重要。这些特性被严格调控,即使在持续的生理压力如全身高钾血症下也能保持。
CSF的物理化学特性与其产生密切相关。根据已建立的CSF合成模型,脉络丛是CSF的主要来源,CSF在主动分泌后,通过脑室系统流向蛛网膜下腔(SAS),最终通过蛛网膜颗粒被清除到硬脑膜静脉窦的血液中。在分子水平上,CSF的形成和分泌主要由膜转运机制驱动,这些机制将液体转运与溶质转移耦合起来。脉络丛上皮细胞(CPECs)通过在脉络丛上皮细胞顶膜上定位的Na+/K+-ATP酶,与顶膜和基底膜上的其他离子通道和转运蛋白协同作用,创造出一个渗透梯度,使脑室腔内相对于CPEC细胞质富集Na+、Cl−和HCO3−离子。这个跨上皮梯度驱动自由水分子通过水通道蛋白从间质液流向脑室系统。
脑脊液通过动脉旁间隙的流动
在进入脑实质之前,“新”的CSF从SAS沿着大脑软脑膜动脉的PVSs流动(见图1A,B)。人类和小鼠的成像研究均表明,CSF不仅通过颅骨的基底池流动,还沿着Willis环和主要脑动脉的PVSs与血液同向流动。随着动脉树进入新皮层,位于大脑表面的软脑膜动脉继续作为穿透动脉进入脑实质,并将大脑表面的软脑膜血管与脑实质微血管连接起来(见图1C)。二十世纪中叶和后期,进行了许多开创性研究,展示了CSF向穿透动脉PVS(血管周围间隙)的流动。尽管这些工作最初提出了PVSs可能是CSF与CNS之间液体和废物交换的潜在场所的想法,但它们并未显示出CSF流入大脑的证据。然而,最近使用体内双光子显微镜使研究人员能够通过跟踪注射到小鼠脑池中的荧光溶质的流动,观察它们进入穿透动脉的PVSs并扩散到脑实质中,从而可视化脑淋巴系统。
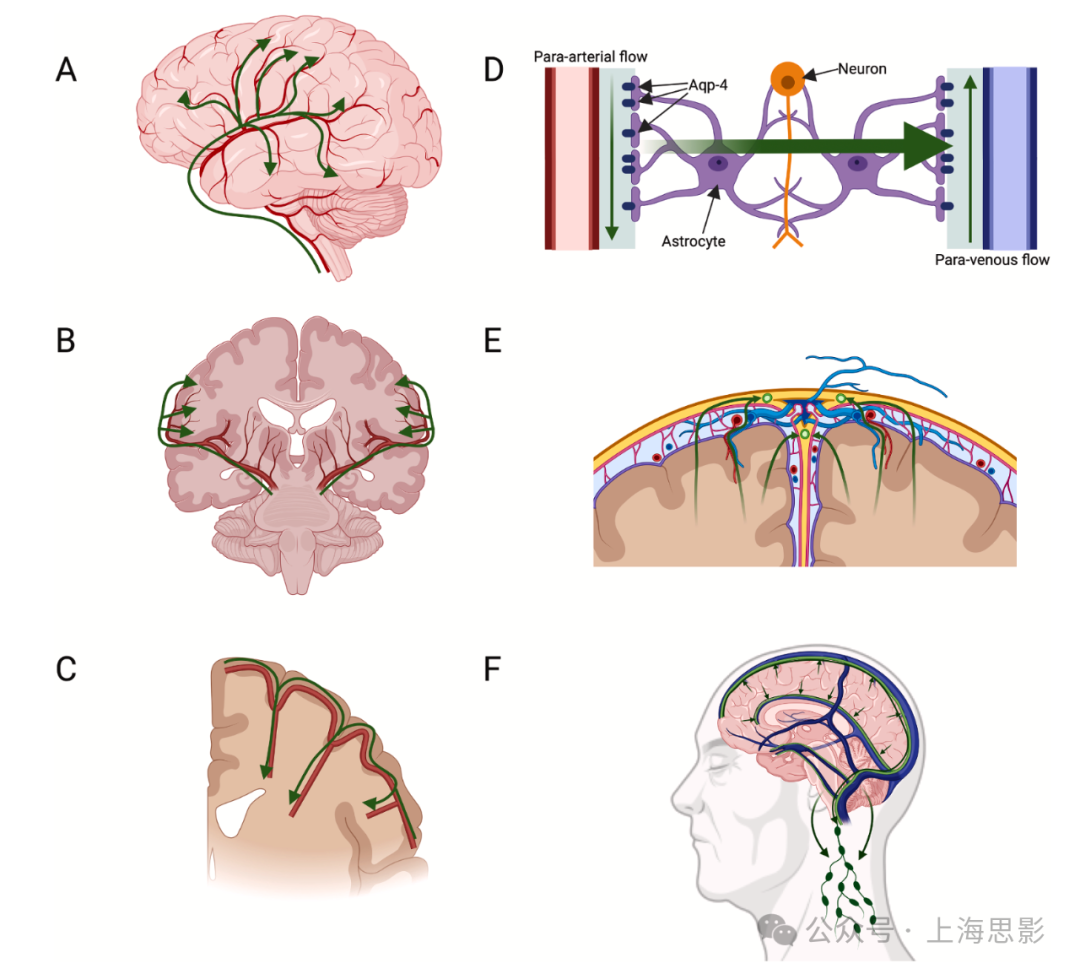
图1. 脑淋巴系统的解剖结构
(A) 脉络丛产生的脑脊液(CSF)通过脑室系统排出到蛛网膜下腔,然后进入大脑实质。
(B) CSF通过动脉旁间隙沿大脑的主要动脉流动,然后沿穿透动脉深入大脑。
(C) CSF在进入脑实质微血管系统后,沿着血液的流向流动。
(D) 在脑实质内,来自动脉旁间隙的CSF通过星形胶质细胞足过程上的Aquaporin-4(AQP4)通道流入细胞外基质(ECM),使CSF能够流动并收集代谢废物,然后通过静脉旁间隙排出。
(E) 废物CSF通过脑膜淋巴管作为静脉旁排出的延续部分流动。
(F) 脑膜淋巴管位于硬脑膜窦旁边,通过示踪研究显示它们向局部淋巴结排出。流动方向由绿色箭头表示。
随着血管将血液输送到大脑,它们按照心动周期设定的节奏脉动。每一次心跳,脉冲压力会产生一个压力波,沿着身体的动脉系统传播。在颅腔内,这个波从颈内动脉开始,经过主要脑动脉,再通过其皮层分支。有强有力的证据表明,心跳周期及随后动脉脉动性是动脉周围间隙中对流性CSF流动的主要驱动力。体内小鼠速度计数据显示,CSF流速与动脉壁脉动速度相平行,而非侵入性MRI和体内示踪研究则表明,CSF流动的周期性与心脏周期(而非呼吸周期)相一致。
重要的是,动脉脉动性传递到穿透动脉对于正常的脑淋巴功能是必要的。当穿透动脉的脉动性减弱时,进入脑实质的CSF量也会减少。颈内动脉结扎会减少穿透动脉的脉动性,已被证明会阻碍脑淋巴的流入。相反,在人类和小鼠中使用肾上腺素能激动剂多巴酚丁胺不仅增加了穿透动脉的脉动性,还同时将进入大脑的CSF流动增加了多达65%。
星形胶质细胞末端和AQP4极化
从穿透动脉的PVS到大脑实质的液体运动使得新的CSF与大脑的间质液(ISF)混合(见图1D)。这反过来又允许细胞废物(如淀粉样β、tau蛋白和乳酸)从间质空间中清除。尽管关于CSF从PVS进入大脑的机制还有许多未解之谜,但证据表明,星形胶质细胞通过水通道蛋白AQP4介导了这种流入。星形胶质细胞的突起终止于并包裹大脑血管的壁。这些突起的末端板,称为星形胶质细胞或血管末端,是已知在星形胶质细胞胞体和突触旁突起上表达水平高出许多倍的AQP4。这种局部的AQP4分布对于正常的脑淋巴功能至关重要,脑淋巴流入(脑干到皮层)的发展与AQP4向血管末端的极化相关。此外,AQP4缺失的小鼠显示出严重减少的脑淋巴流入,废物清除减少约70-80%,这表明大脑间质液的停滞。这一观察结果进一步通过使用胶质特异性启动子的条件性敲除AQP4的小鼠得到了支持,这些小鼠在高渗透压应激后表现出大约31%的脑水摄取减少。
静脉旁CSF流出与废物清除
根据脑淋巴假说,混合了“脏”CSF和ISF的液体在通过大脑实质后,沿着大脑主要静脉的PVS(血管周围间隙)流向蛛网膜下腔(SAS)(见图1E)。这一通路最初通过将荧光CSF示踪剂注射到小鼠的脑池中可视化;注射后一小时,示踪剂在内侧内部脑静脉和腹侧-侧边缘静脉的PVS中高度集中。这一数据进一步得到了通过双光子激光扫描显微镜在小鼠静脉PVS中观察到脂溶性溶质流出以及接受激光间质热疗的患者中发现的静脉旁钆清除的支持。最后,SAS(蛛网膜下腔)本身作为一个废物汇集区,允许CSF中的溶质排出到周边免疫系统。
脑淋巴-脑膜淋巴连接
在提出脑淋巴假说后不久,两个独立的研究小组重新发现了位于小鼠硬脑膜静脉窦旁的淋巴管,具有从大脑清除溶质的能力。这些淋巴管被称为脑膜淋巴管(mLVs),后来通过免疫组织化学和对比增强MRI在人体和非人灵长类动物中观察到。像脑淋巴系统一样,mLVs(脑膜淋巴管)被认为参与CSF的排出以及淀粉样β和tau蛋白的清除。尽管mLVs摄取CSF的确切机制尚不清楚,但排出可能涉及位于静脉窦附近的硬脑膜,即静脉周围硬脑膜。最近的人类和小鼠研究表明,静脉周围硬脑膜是CSF溶质和CNS抗原流出的部位。此外,静脉注射对比剂显示,mLVs(脑膜淋巴管)可以排出硬脑膜间质液,表明mLVs通过静脉周围硬脑膜监视排出废物、清除溶质并影响CNS的免疫。鉴于其位置和功能,脑膜淋巴管很可能作为CSF清除的一个循环,与蛛网膜颗粒和硬脑膜静脉窦提供的通路并行。
有观点认为,mLVs(脑膜淋巴管)和脑淋巴系统是相连的,脑膜淋巴管位于脑淋巴清除的下游。这一观点得到了小鼠功能性实验的支持,这些实验显示两个系统将溶质运输到共同的目的地。示踪研究表明,脑膜淋巴管连接并向深颈淋巴结(dcLNs)排出淋巴。通过破坏mLVs(无论是通过药理性切除还是通过抑制VEGF-C/D信号传导)都阻止了溶质向dcLNs的排出。脑淋巴系统也向dcLNs(深颈淋巴结)排出,如通过向小鼠脑内注射放射性碘标记的白蛋白和PEG-IRDye,以及通过抑制脑淋巴系统,乳酸从小鼠大脑排出到dcLNs的能力受损。重要的是,这两个排出路径在人类中也存在相似性。通过MRI在患者中可视化脑淋巴运输到dcLNs(深颈淋巴结),以及mLV(脑膜淋巴管)排出回路的解剖在人体和小鼠之间保持一致。
有趣的是,脑淋巴功能和CSF通过mLVs的流动都与昼夜节律相关。小鼠脑淋巴流入在白天(小鼠通常在此时睡眠)比在夜间大约增加了53%。这一现象在分子水平上通过AQP4向星形胶质细胞末端的极化得到反映,后者在白天也增加。同样,向深颈淋巴结的淋巴流动似乎也受到昼夜节律的控制。然而,这一节律与脑淋巴流入的节律相反,淋巴流动在夜间达到高峰,白天达到最低。
CSF通过这两个系统的流动也可以通过麻醉调节。脑淋巴系统对不同麻醉剂的敏感性已被充分表征。穿入脑实质的清除实验表明,与使用戊巴比妥的老鼠相比,使用酮吗啡(K/X)的老鼠溶质的流出速度慢了100倍。此外,在包括K/X、阿维特林、戊巴比妥、α-氯苯唑、异氟烷和异氟烷-右美托咪定在内的不同麻醉方案的比较研究中,K/X被证明诱导了最高量的脑淋巴流入。这可能是因为K/X诱导了脑内δ波的最高频率,后者被认为促进脑淋巴流动。脑膜淋巴流动在K/X下也显著增加。有趣的是,检查清醒和接受K/X处理的小鼠中的CSF排出显示,接受K/X的小鼠向其dcLNs的总体流动更大。值得注意的是,与脑淋巴流动类似,当使用K/X代替异氟烷时,向静脉周围硬脑膜的流出也显著增加。
综上所述,这些结果表明,脑淋巴系统和脑膜淋巴管代表了一个连接的废物清除路径,在某些情况下,这两个系统的流动是相关的,而在其他情况下则不统一。由于原因尚未被理解,找到这些变化背后的生物学原因可能有助于阐明CNS稳态的基本原则。此外,理解这些变化可能具有临床意义。例如,通过光栓塞(PT)诱导脑缺血(CSVD诱导的中风模型)和通过中脑动脉闭塞(MCAO)模拟重大中风的小鼠都表现出脑水肿、脑淋巴功能障碍和AQP4极化的丧失。然而,最近的一项研究表明,PT小鼠在损伤后表现出显著的淋巴管新生和强大的mLV网络。这表明mLV(脑膜淋巴管)具有重塑和增加其从CNS摄取能力以保护或修复大脑的能力。这种行为在光栓塞斑马鱼模型中得到表征,该模型显示mLV可以进入大脑排出水肿,并作为“通道”帮助脑血管重新血管化脑实质。矛盾的是,MCAO小鼠的mLV在很大程度上未发生改变,尽管受到影响的脑实质体积显著较大,且推测存在更多水肿。 因此,理解驱动这两种不同表现的机制可能有助于澄清大血管闭塞性中风和由CSVD引起的中风之间的细微差别,并有助于为这两种疾病创建治疗选项。
脑小血管疾病与脑淋巴功能障碍的共有风险因素
高血压
高血压是脑小血管疾病(CSVD)发展和进展的风险因素(图2A)。第一阶段和第二阶段高血压均与深部脑微出血以及导致大脑深部实质产生小腔隙性梗死的穿透动脉阻塞相关。此外,高血压还与白质高信号(WMHs)相关,WMHs是通过某些MRI扫描可见的病理性白质变化,代表CSVD。脑血管损伤可能早在生命中期就开始。在一项对中年个体(平均年龄39.2岁,标准差8.4岁)进行的横断面研究中,涵盖了多种高血压类别,研究发现,收缩压(SBP)增加与白质完整性降低线性相关——这是血管性脑损伤的一个迹象。
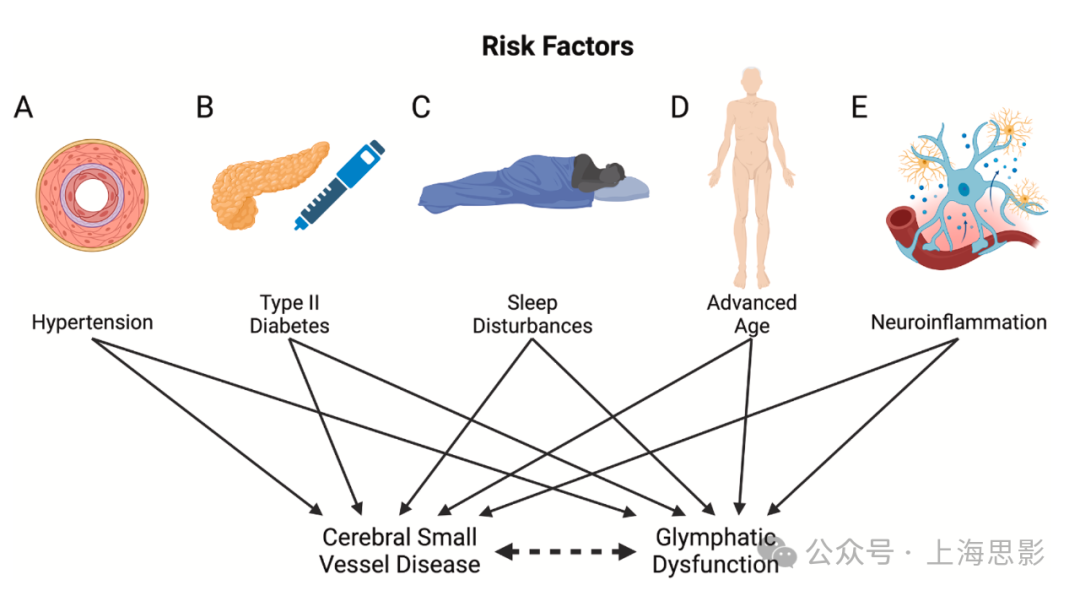
图2. 脑小血管疾病与脑淋巴功能障碍的共有风险因素
(A) 高血压是已知的脑小血管疾病(CVSD)风险因素,且与脑微出血、腔隙性梗死和白质高信号相关。体内动物研究和患者数据表明,高血压通过减少脑淋巴流入与脑淋巴功能障碍相关联。
(B) 2型糖尿病(T2D)中的血管重塑是CVSD发展的一个重要原因。T2D模型中的动脉僵硬与动物模型中的脑淋巴功能障碍相关联,突显了血管周围间隙中水扩散性的降低。
(C) 睡眠受损的患者已被观察到有增加的白质高信号和脑微出血及CSVD的迹象。鼠类研究表明,睡眠剥夺的小鼠存在脑淋巴流入受损和载脂蛋白E(ApoE)同种型清除受阻,连接了睡眠剥夺与脑淋巴功能障碍。
(D) 老年患者常见动脉脉动性下降、血管重塑和CSVD(脑小血管疾病)。老年小鼠中Aquaporin-4(AQP4)极化的丧失已被证明抑制了淀粉样β的清除。此外,与年龄相关的中枢神经系统免疫变化被认为会导致额外的脑淋巴功能障碍和CVSD。
(E) CVSD已被关联到系统性炎症和反应性星形胶质增生。此外,星形胶质增生的小鼠模型已被证明具有破坏性的AQP4极化和受损的脑淋巴流动。
高血压
体内动物研究和人类患者数据均表明,高血压与脑淋巴功能障碍相关。啮齿动物的数据表明,高血压可能通过改变动脉壁动力学来损害脑淋巴流动。在一项高血压小鼠模型中,高血压减少了远端动脉的脉动性,因此减少了脑淋巴流入。自发性高血压大鼠(SHR),一种动脉重塑已被充分记录的啮齿动物模型,表现出减少的脑淋巴流入但正常的AQP4极化。这些发现得到了最近使用沿血管周围间隙扩散张量成像(DTI-ALPS)——一种用于成像人类脑淋巴功能的新型非侵入性成像方法——的研究的证实,DTI-ALPS显示,老年高血压患者的脑淋巴流动减少。
脑小血管疾病与脑淋巴功能障碍的共有风险因素
2型糖尿病
2型糖尿病(T2D)被认为是脑小血管疾病(CSVD)发展的一个重要风险因素(图2B)。尽管因果机制尚未完全确立,血管重塑是糖尿病的一个显著特征。在小鼠中,研究表明糖尿病通过细胞外基质(ECM)重塑诱导主要血管的僵硬化。人类患有T2D时也存在动脉僵硬化,并且相关的ECM重塑机制被认为与动脉壁特性的改变有关。类似地,啮齿动物和人类的研究均表明T2D与脑淋巴功能障碍相关。在一种2型糖尿病大鼠模型中,脑淋巴流出减少了三分之二。最近,一组T2DM患者接受了DTI-ALPS成像,结果显示其血管周围间隙中的水扩散性降低——这可能反映了脑淋巴功能障碍。尽管尚未在患有T2DM的小鼠或人类中收集动脉壁动力学的数据,但动脉脉动性的改变可能像高血压一样介导脑淋巴功能障碍。
睡眠障碍
正常睡眠模式的失调在多种情况下与脑小血管疾病(CSVD)的发生和进展相关(图2C)。睡眠-觉醒周期破碎的患者患有更高的白质高信号(WMHs)和脑微出血的发生率。 与对照组相比,诊断为阻塞性睡眠呼吸暂停(OSA)的患者更可能出现WMHs、无症状性脑梗死和扩大的血管周围间隙(EPVSs),这是CSVD的另一个标志。尽管EPVSs的发病机制尚不清楚,但最近有研究提出动脉僵硬化和异常蛋白聚集可能是潜在原因。此外,在老年人中,睡眠质量被发现调节了CSVD与虚弱之间的关系。
一些最具影响力和被广泛引用的研究集中在脑淋巴生理学如何被睡眠调节上。一项开创性研究表明,睡眠对于脑淋巴系统有效清除大脑间质溶质和淀粉样β是必要的,当小鼠清醒时,脑淋巴系统被显著抑制。通过实时四甲基铵扩散和双光子显微镜的使用,该研究组展示了在睡眠状态下,脑实质间质空间约比清醒状态大60%,且间质体积的增加与大脑内δ波的高频率相关。使用耦合的脑电图(EEG)、血氧依赖性扩散(BOLD)和CSF流动测量在人类患者中也有类似观察。与小鼠一样,睡眠和慢δ波与脑淋巴流入相关。 有趣的是,EEG读数表明,慢δ波先于脑淋巴流入和血容量的减少。这表明在慢波睡眠期间,脑淋巴流动是通过脑实质中血液的外流促进的,而CSF流入脑实质以维持恒定压力。
鉴于睡眠在脑淋巴功能中的重要性,睡眠不足会损害脑淋巴流动也就不足为奇了。睡眠剥夺后,小鼠在皮层中保留了乳酸,表明脑淋巴清除失败。这些发现得到了研究显示,睡眠剥夺后小鼠的ApoE同种型的流入和清除均受损的研究的支持。证据表明,睡眠质量差或睡眠分布扰乱也会干扰人类的脑淋巴清除。睡眠障碍在阿尔茨海默病患者中很常见,且睡眠剥夺已被证明会增加大脑中淀粉样β的积累,即使只是一夜之间。
高龄
衰老是脑小血管疾病(CSVD)及其进展的最重要的风险因素之一(图2D)。 小鼠研究已记录到动脉动力学的改变和与年龄相关的脑淋巴系统功能下降,表明平行的疾病机制可能在其中发挥作用。与年轻(2、3个月)的老鼠相比,老龄小鼠的动脉脉动性降低了27%。此外,老龄小鼠表现出AQP4极化的丧失、脑脊液(CSF)流入受阻以及脑实质内淀粉样β清除减少40%。最近的人类研究也表明,CSVD、动脉脉动性改变和血管重塑之间存在关联。
重要的是,与年龄相关的脑淋巴功能障碍可能由大脑或脑膜组成部分的结构变化介导。最近研究表明,脑膜最内层的软脑膜架构可以影响脑淋巴功能。在年轻小鼠中,动脉旁间隙的软脑膜结构各异,CSF流入在主要位于大脑腹侧部分的结构子集处最为显著。然而,在软脑膜被剥离的老龄小鼠中,这类软脑膜结构的动脉旁间隙比例减少。 此外,新的研究已在猪中描述了脑淋巴系统。与人类类似,猪是具有皱褶脑的动物。因此,这些动物中的脑淋巴流动模式更可能与人类的脑脊液动态相关。示踪实验显示,脑沟促进了CSF的流入。由于研究表明,随着年龄增长,脑沟会扩大并改变其结构,这些变化可能潜在地介导了老年人脑淋巴流动的减少。
最后,与年龄相关的中枢神经系统免疫环境变化已被认为与脑淋巴流动受损相关。脑实质边界巨噬细胞(PBMs)的一个亚群与大脑动脉紧密相关,这些细胞能够通过调节动脉运动来调控脑脊液流动。尽管PBMs的数量在整个年龄段内保持稳定,但介导CSF流动的PBMs亚群在老龄小鼠中减少。令人惊讶的是,在进行脑池内注射巨噬细胞集落刺激因子(M-CSF,一种PBMs表达的Csf1r受体的配体,促进生长)后,动物的脑淋巴流动得到了恢复。 研究还表明,老年小鼠中另一种细胞亚群,即脑膜Ccr7+ T细胞的数量减少。行为测试和脑淋巴流入评估显示,与同龄对照组相比,CCR7-/-小鼠在新位置识别和空间记忆测试中表现更差,并且脑淋巴流入减少,表明与年龄相关的Ccr7+ T细胞丧失导致认知衰退和脑淋巴功能障碍。有趣的是,在阿尔茨海默病小鼠模型中敲除Ccr7导致与正常Ccr7信号传导的阿尔茨海默病(AD)小鼠相比,淀粉样β负担增加——进一步表明Ccr7在脑淋巴流出中的作用。
神经炎症
证据表明,持续的系统性炎症状态可以影响中枢神经系统(CNS)并诱导与脑小血管疾病(CSVD)相关的疾病过程(图2E)。微胶质细胞是监视CNS的免疫细胞,它们不仅与神经毒性代谢产物的清除和控制有关,还与CSVD的各种特征相关。例如,在一项人类研究中,微胶质细胞激活区域显示出血脑屏障破裂,这是CSVD的一个标志。CSVD还与反应性星形胶质增生相关,这是一种被认为表明细胞压力的神经炎症形式,与星形胶质细胞的形态变化相关,如大小增加和分支减少。在研究白质高信号(WMHs)的病理生理学时,研究人员注意到这些病变标志着星形胶质增生。
研究人员利用小鼠模型研究星形胶质增生,发现这些变化抑制了星形胶质细胞的脑淋巴功能;反应性星形胶质增生破坏了AQP4极化,随后减少了脑淋巴流动。与此一致,星形胶质增生在闭颅外伤性脑损伤和蛛网膜下腔出血的小鼠模型中也有出现,这两种病理状态都伴有脑淋巴功能受损。研究人员还发现,通过使用抗疤痕剂奥洛莫辛(olomoucine)抑制星形胶质增生,改善了出血后脑积水小鼠模型的脑淋巴功能。
脑小血管疾病作为脑淋巴功能障碍的中介
由于脑淋巴假说相对较新,研究人员仍在评估脑淋巴功能在多种疾病状态中的作用。有趣的是,众多的脑小血管疾病(CSVD)动物模型显示出脑淋巴功能障碍的迹象,而CSVD的病理生理改变了人类大脑中脑淋巴系统解剖结构的部分。我们将在下文深入回顾这些证据,旨在说明CSVD如何可能引发脑淋巴功能障碍,进而导致中枢神经系统(CNS)损伤和神经元功能障碍。
脑微梗死
脑微梗死是显微镜下观察到的、界限清晰且局灶性的大脑病变,其特征是细胞死亡、坏死,可能伴有空洞形成。这些病变在组织学上与缺血性梗死相似,但不同于宏观的大脑梗死,它们通常在MRI上不可见。因此,关于脑微梗死的大部分知识来自尸检研究。尽管微梗死的病理原因尚未完全了解,但它们已被与小血管病变如脑淀粉样血管病(CAA)相关联,并在阿尔茨海默病和血管性痴呆患者中常见,并与与年龄相关的认知衰退相关(图3A)。
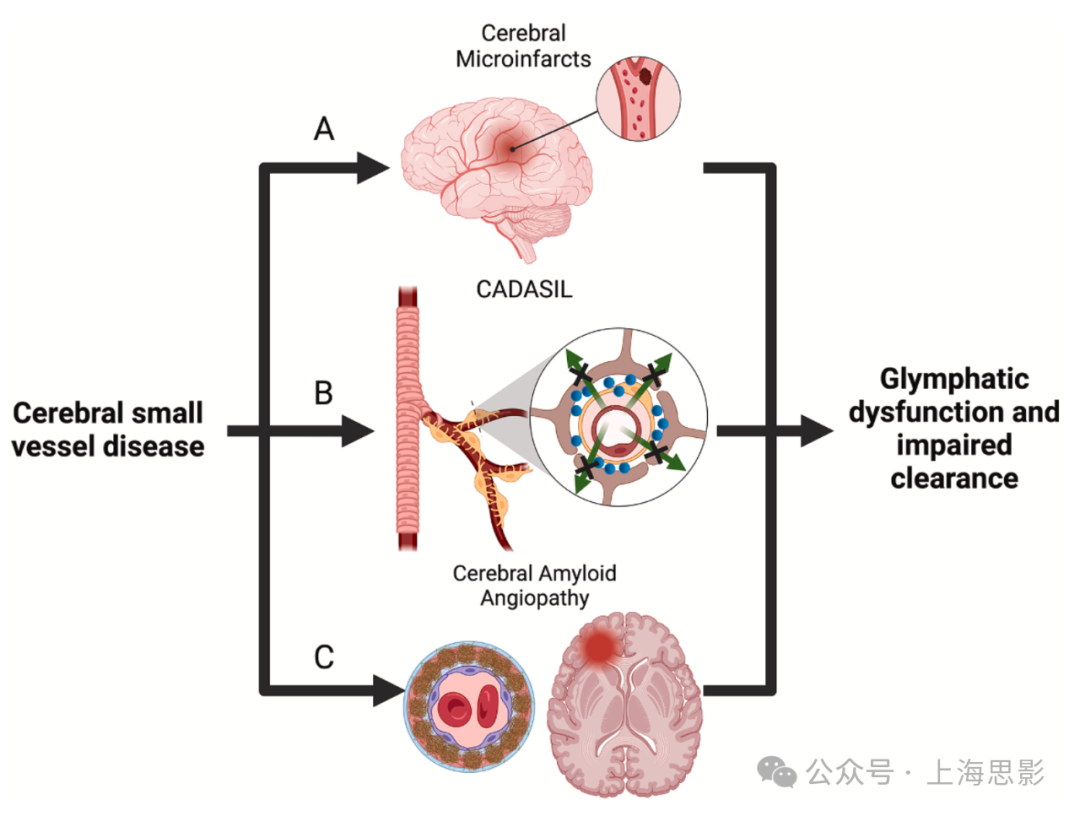
图3. 脑小血管疾病可能作为脑淋巴功能障碍的中介
(A) 使用脑脊液(CSF)示踪剂的脑微梗死动物模型显示示踪剂被困在梗死区域,提示局部脑淋巴功能障碍。
(B) 具有脑下皮质梗死和白质脑病的脑自体显性动脉病患者的组织病理学显示与脑淋巴系统相关的脑血管结构功能障碍。CADASIL患者通常在其血管周围间隙(PVS)中积累颗粒状嗜铂物质(GOM),这可能导致脑淋巴功能障碍。研究表明,CADASIL患者中铁沉积的升高也可能与脑淋巴清除不足有关。
(C) 淀粉样蛋白在脑血管中的沉积可能介导脑淋巴功能障碍。棕色沉积物代表脑血管中的淀粉样蛋白,可导致脑内出血,这是脑淀粉样血管病(CAA)的特征。CAA大鼠模型显示出增加的CSF从大脑排出,导致代谢废物清除受损和脑淋巴运输减少。
由于这些病变在临床环境中难以识别,脑微梗死损害正常认知的机制尚不清楚。然而,脑微梗死动物模型为这些病变的病理和后果提供了潜在的见解。使用脑脊液(CSF)示踪剂的实验显示,在受损小鼠的脑微梗死区域内示踪剂被困住,表明脑微梗死可能在局部区域引发脑淋巴功能障碍。在一种依赖于激光诱导微动脉阻塞的小鼠模型中,进一步发现脑微梗死抑制了脑内注射溶质的脑淋巴清除,且通过过表达Slit2可以恢复脑淋巴流入。
脑自体显性动脉病伴皮质下梗死和白质脑病 (CADASIL)
脑自体显性动脉病伴皮质下梗死和白质脑病(CADASIL)是最常见的单基因遗传性中风疾病。这种疾病是一种显性遗传的血管性痴呆形式,源自NOTCH3基因突变。在临床上,CADASIL可以表现为严重的偏头痛、复发性缺血性中风和精神障碍。这些表现是痴呆、残疾和死亡的常见原因。因此,CADASIL患者的平均预期寿命在男性中为64.6岁,女性中为70.7岁5。
对CADASIL患者的组织病理学研究揭示,该疾病改变了脑血管结构,这些结构是脑淋巴系统的一部分(见图3B)。尽管CADASIL的表型表现可能有所不同,患者可能表现出血管周围间隙(PVSs)扩大和小血管平滑肌退化。重要的是,大多数CADASIL患者在其PVSs中表现出颗粒状嗜铂物质(GOM)的积累。这些大量蛋白质沉积对于CADASIL的进展至关重要,据信是由于周皮细胞向PVS分泌异常的Notch3同种型所致。尽管关于CADASIL患者和CADASIL动物模型中脑淋巴功能的数据尚缺乏,但GOM的沉积可能阻碍PVS并阻止脑淋巴流动是可能的。一些研究发现脑铁沉积可能是脑淋巴功能障碍的一个标志,且CADASIL患者在基底节中有较高的铁含量,这在一定程度上支持了这一观点。此外,CADASIL小鼠模型TgNotch3R169C显示,由于周皮细胞丧失,星形胶质细胞末端脱离。这种末端附着的破坏无疑会导致脑淋巴功能障碍。
脑淀粉样血管病
脑淀粉样血管病(CAA)是一种脑小血管疾病(CSVD),其特征是在血管壁沿线沉积淀粉样β。CAA通常与认知障碍和脑内出血风险增加相关,并且还促成了衰老和阿尔茨海默病的病理生理过程(图3C)。在脑淋巴系统被发现之前,针对阿尔茨海默病中CAA的研究已识别出淀粉样β的血管周围排泄受损作为淀粉样β沉积的一个因素。随着脑淋巴系统和脑膜淋巴管的最近发展,过去十年中关于血管周围间隙与CAA病理生理关系的研究也在不断增加。
多项研究已将扩大的血管周围间隙(EPVS)和脑淋巴功能障碍与CAA(脑淀粉样血管病)及其标志物联系起来。这些CAA的标志物包括脑内出血、脑微出血和通过MRI或CT可见的皮层表面铁质沉积。许多影像学研究已将白质通路内的EPVS,特别是半卵圆中心的EPVS,识别为CAA的潜在新标志物。半卵圆中心的EPVS能够区分CAA与其他脑血管病变,如高血压性动脉病变,后者则与基底节的EPVS相关联。基于这些研究,EPVS的位置被提出作为区分自发性脑内出血原因的方法。其他研究发现,与CAA相关的脑微出血也与扩大的皮层旁血管间隙(jPVSs)共定位,这些jPVSs(扩大的皮层旁血管间隙)的数量和扩张程度也与CAA的严重程度相关。
近期专注于与CAA(脑淀粉样血管病)相关的脑淋巴功能变化的研究发现,CAA中脑淋巴运输减少。在一种严重型1型CAA的大鼠模型中,患有CAA的大鼠在动脉旁入流路径上的CSF和溶质流动速度更高,但这些CSF流动被引导离开大脑,减少了整体脑淋巴运输和向深颈淋巴结的淋巴排泄。值得注意的是,该研究还发现,与野生型大鼠相比,这些大鼠的血管周围AQP4极化减少。在另一项近期研究中,Xu等人通过使用ALPS指数(利用MRI量化血管周围间隙的扩散性)量化了人类CAA患者的脑淋巴功能。在这项研究中,发现CAA患者的脑淋巴功能较对照组下降,且CAA患者较低的脑淋巴功能与基底节中EPVS的增加、白质高信号的增加、腔隙性梗死的增加、更大的脑小血管疾病负担和较低的认知功能相关联。
结论
总体而言,近期研究的回顾表明,临床医生和研究人员对脑淋巴系统的理解和重视在过去十年中迅速增长。证据清楚地表明,脑淋巴系统这一名称反映了其依赖于胶质细胞星形胶质细胞末端的特性以及其在功能上类似于身体其他部位淋巴系统的角色,其在调节废物的积累和清除中至关重要。脑淋巴系统的流动还受到精细的调控,其流动方向由心动周期引发的动脉壁脉动性决定,并与血管周围CSF的流入相关联。此外,脑淋巴系统功能障碍与CSVD(脑小血管病)之间显然存在重叠,CSVD是一组具有显著发病率和死亡率的病理状况。CVSD的流行和已知风险因素(高血压、糖尿病、衰老、睡眠障碍和神经炎症)显然与脑淋巴功能障碍的发展有关。研究表明,慢性高血压和糖尿病通过改变动脉脉动性损害脑淋巴清除,而衰老和睡眠障碍也与脑淋巴活动减少相关,尽管其机制尚在探索中。此外,来自小鼠模型的实验数据揭示了CSVD疾病状态导致脑淋巴功能障碍的观察结果。这些发现表明,在CSVD的情况下,中枢神经系统的损伤可能源于脑淋巴功能障碍及随后神经毒性废物的积累。因此,维持最佳的脑淋巴功能可能是预防或减缓神经疾病进展的重要因素。有趣的是,一些人假设脑淋巴功能障碍不仅加剧了CSVD,还可能是CSVD的起始因素。虽然如CAA中的淀粉样蛋白沉积可能是由于脑淋巴流动减少的次要结果,其他疾病案例研究尚未支持这一理论。总体而言,尽管需要进一步解析脑淋巴系统与CSVD发病机制之间的相互关联,但它们关系的重要性和动态性是不可否认的。
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








