《DG-ECG: Multi-stream deep graph learning for the recognition of disease-altered patterns in electrocardiogram 》[1]
[1] Chen Kan, Zehao Ye, Houliang Zhou, Sreekanth R. Cheruku,DG-ECG: Multi-stream deep graph learning for the recognition of disease-altered patterns in electrocardiogram,Biomedical Signal Processing and Control,Volume 80, Part 2,2023,104388,ISSN 1746-8094,https://doi.org/10.1016/j.bspc.2022.104388
目录
摘要
心电图表征学习已成为心脏疾病自动检测的一个活跃研究领域。除了提取心电的时间和频域特征外,越来越多的研究将深度神经网络用于疾病改变的心电模式的识别。然而,许多深度学习模型被部署为黑盒,而没有充分探索隐藏在信号中的疾病相关信息。因此,降低了模型的有效性和可解释性,阻碍了在临床实践中的应用。为了解决这个问题,我们开发了一个新的多流心电深度图学习(DG-ECG)框架,该框架集成了多流图神经网络,从多个角度(例如,心电信号的形态和节奏)揭示疾病改变的心电模式。在每个流中,对可见性图进行建模,将信号模式转换为图拓扑特征,然后通过图卷积挖掘。此外,将注意机制融入到心电图中,进行多层次的信息融合,提高心电图的检测能力和可解释性。实验结果表明,与基准模型相比,所开发的DG-ECG能够更好地从多通道心电信号中收集疾病相关信息。所开发的框架是可扩展的,适合于各种心脏疾病的模式识别。
一、介绍
心脏病仍然是世界上主要的死亡原因[1]。准确检测心脏病对于及时进行医疗干预和提供挽救生命的治疗至关重要。值得注意的是,人类心脏的活动是由传导系统调节和协调的。电脉冲由窦房结发出,经房室结和His-Purkinje系统传递,刺激心肌细胞,引起心房和心室肌壁的交替收缩和舒张,从而产生心跳[2]。几十年来,心电图(ECG)一直被普遍用作测量心电活动的无创工具[3]。如图1所示,一个心电周期主要包括三种波形,即p波、QRS-complex和t波。每个波形的振幅和持续时间与特定心室的活动密切相关。例如,心房去极化是由p波反射的,心室去极化和复极化分别与QRS-complex和t波相关[4]。随着心脏疾病(特别是心传导障碍和电生理障碍)的发生,电脉冲的正常传播被中断,导致心室活动不规律,表现为心电图异常[2]。因此,在心电图中识别疾病改变模式对心脏病的诊断和预后至关重要。

可以注意到,心电图信号提供两种主要类型的信息,其中包括与心电活动相关的信息。首先,从心电图中测量的时间间隔揭示了电脉冲通过心室所需的时间。这些信息与心脏节律密切相关,可用于心律失常情况的识别[5]。如心律不规律表现为R-R间期异常(如心动过速或心动过缓),可由心房颤动(AF)引起[6]。其次,心电波形形态揭示心电活动的时间演变。心电图形态异常提示电脉冲传导紊乱(如通路受阻),可能由心肌梗死、束支阻滞(BBB)等疾病引起[8]。值得注意的是,许多心脏疾病表现为心律和ECG信号形态的复杂异常。例如,AF的特征是R-R间隔不规则(即节律异常),以及没有p波和QRS复合的混沌波形(即形态异常)[9]。因此,准确识别复杂的心脏疾病,需要从ECG信号中描述节律和形态模式。
近年来,关于疾病改变的心电图形态和节律的研究越来越多。例如,从R-R区间、Q-T区间、PR段提取的时域特征,以及p波、QRS复合物和t波的形态学,被用于检测心脏疾病[5]。许多研究进一步在频率或时频域描述了疾病改变的ECG模式。对心电信号进行傅里叶变换[11]和小波分解[12],利用功率谱密度和小波系数检测异常心电模式。此外,文献报道了心电信号的相空间分析[13]和复发分析[14]等方法用于疾病模式识别。值得注意的是,从上述方法中提取的特征通常被输入到预测模型中,如逻辑回归(LR)和支持向量机(SVM),以区分正常和病变的心电图。随着深度学习的进步,多层感知器、卷积神经网络(CNN)和循环神经网络(RNN)模型等在心电信号分析中得到越来越多的利用。研究表明,深度学习在建模非线性非平稳心电活动和检测心电信号中的细微异常方面取得了极好的效果。此外,深度学习的使用促进了端到端学习结构的构建,将特征工程和分类集成到一个模型中,从而提高了心电模式识别的效率(以及大多数情况下的准确性)。关于ECG分析的深度学习的更多见解可以在2.1节中找到。
在已有的研究中,已经有一些尝试使用图模型对心电信号进行分析。例如,基于ECG信号(或相关信号,如心率变异性(HRV)和矢量心电图(VCG))之间的相似性构建图形,并开发了从图形中提取特征以检测疾病改变的心脏模式的方法[2,15]。值得注意的是,图建模在各种类型的时间序列、图像和视频的表示学习中取得了成功[16 17]。在2.2节中,回顾了基于图的ECG分析方法。
然而,很少有现有的研究试图利用图建模来表示ECG中与疾病引起的改变有关的多重信息,并进一步利用深度神经网络来探测疾病识别的潜在图模式。为了填补这一空白,本研究提出了一种新的心电多流深度图学习框架(DG-ECG)。每个流通过小波分解、可见性图(VG)建模和图卷积,从某种角度(如形态学习或节奏学习)对疾病改变的心电模式进行表征学习。进一步发展多层次注意机制,全面融合信息,收集显著特征,用于异常心电模式的检测。本文的主要贡献有四个方面:
a)本研究创新地将VG建模与深度图学习相结合,用于心电模式识别。通过对图拓扑变化的挖掘,开发的DG-ECG框架能够更好地揭示疾病改变的局部和全局模式。
b) DG-ECG整体集成了多层次注意机制,融合了ECG各频段、段和导联的信息。注意机制自适应地突出突出显著特征,这有助于更好地识别疾病模式并提高可解释性。
c)提出了一种新的多流学习架构,从多个角度提取疾病相关模式。深度图形学习被整合到每个流中,从特定的角度揭示与疾病相关的信息。有了完善的结构,DG-ECG可以检测各种类型的心脏疾病。
d)开发的方法已在两个具有不同类型心脏病的真实数据集上进行了评估。实验结果表明,DG-ECG优于包括深度神经网络在内的基准方法。
本文的其余部分组织如下。第2节回顾了与本研究相关的最新方法。第3节介绍了提出的研究方法的细节。第4节讨论了实验结果,第5节包括本研究产生的讨论和结论。
二、相关工作
1、深度学习在心电模式识别中的应用
近年来,人们对利用深度学习进行心电分析的兴趣激增。作为应用最广泛的深度学习模型,cnn在心电分割、心跳分类等任务上表现出色。Kiranyaz等[18]采用香草cnn检测心律失常。Fan等[19]改变了cnn中卷积滤波器的大小,从心电中捕获多尺度信息,用于AF的识别。使用cnn,心电模式识别的两个主要任务(即特征提取和分类)可以合并到一个框架中。这优于传统方法,即对原始ECG信号进行复杂的预处理和后处理,以提取手工制作的特征。
除了cnn之外,rnn由于处理数据中的时间依赖性的能力也被广泛用于ECG分析。例如,Saadatnejad等[20]结合多个长短期记忆(LSTM)网络对连续心跳进行分类,用于心律失常检测。该算法应用于可穿戴式心脏监测传感器。Peimankar和Puthusserypady[21]将CNN和RNN结合起来进行心电分割。通过三个一维卷积层和一个双向LSTM,心电图通过输出层分别为Pwave、QRS-complex、t波和无波四组中的一组。更多关于基于深度学习的心电分析的综述可以在[22]中找到。值得一提的是,许多深度学习模型[10]虽然最初不是为心电分析而设计的,但在心电特征提取和模式识别方面具有很大的潜力。
然而,大多数深度学习模型被用作黑盒,而没有利用关于疾病改变心脏电活动的丰富病理知识。这反过来又阻碍了临床实践中急需的有效性和可解释性。此外,许多人接受过检测特定类型心脏病的培训。当用于检测其他心脏疾病时,它们的性能可能会受到极大的阻碍。因此,需要一个新的框架来探索ECG中的多重疾病相关信息,同时保持深度学习的有效性。
2、用图模型分析心电图
在文献中,图形越来越多地用于建模各种类型的数据,包括时间序列、图像、视频和点云。图由两个基本组成部分组成:节点和边。在图建模中,数据元素(如样本或图像像素)由图节点表示。边(有或没有权值)用于描述节点之间的关系。将数据建模为图提供了很好的机会:1)有效地处理高维数据;2)利用图论丰富的主体进行信息处理和模式识别。
特别是在心电分析领域,图形建模和分析仍处于探索阶段。Li等[23]用k近邻图表示一段心电信号。每个节点对应一个心电周期,两个节点之间的边表示两个周期相邻,属于同一类。Fotoohinasab等[24]将P波、QRS波和T波表示为约束图中的节点,对约束图中的上下变化进行建模,提取r峰。Yang等[15]量化了心电周期之间的形态变化,并将其进一步嵌入为可视化和状态监测的大尺度图形。如果相应的节点投影远离正常节点簇(从正常ECG周期嵌入的节点),则认为该ECG周期异常。
三、研究方法
1、综述
如图2所示,所提出的框架通过多流架构处理心电信号:1)学习节奏模式的r流和 2)专注于学习心电形态模式的m流。在r流中,首先通过记录R-R间隔将原始心电图转换为HRV,以突出疾病引起的节律变化。然后根据HRV构造一个VG,再通过图神经网络对其进行处理。在m流中,原始心电的每个导联以并行方式处理。在每个导联内,ECG被分成多个片段,并对每个片段进行小波分解,以表征不同频带的疾病改变形态。然后将小波系数表示为VGs,并通过图卷积层进行模式学习。为此,设计了一种多层次的注意机制,实现了心电各频段、各段、各导联的信息融合。具体而言,i)注意力是跨小波系数来聚合来自不同频段的信息。ii)采用双向LSTM来记录连续ECG段之间的时间变化,然后通过跨段注意力将其融合。iii)通过交叉导联注意力将多个心电导联获得的特征进行协同,生成最终的特征向量来表示m流中的所有信息。最后,通过加权和将r流和m流合并,然后建立全连接层对心电信号进行分类。值得注意的是,该方法由三个主要部分组成:1)小波分解和ECG的VG建模,2)图卷积神经网络,以及3)融合多层次信息的注意机制。在小节3.2至3.4中,分别详细阐述了这三个组件。

2、小波分解与可见性图建模
将第l层的第n个小波系数记为 (w0,0为原心电段),则小波包变换[25]可表示为:

其中i和
分别是高通和低通滤波器。由于它在每个级别分解高频(即细节信息)和低频成分(即近似信息),因此小波包变换保留了信号中丰富的时频信息。
在这两种流中,构造VGs来表示时间序列数据。由Lacasa等人[26]开发的VG已越来越多地被用作时间序列建模的重要工具包。将VG表示为G = (V, E),其构造方法是将时间序列中的点ht表示为图顶点vt。同样,时间序列可以是r流中的HRV或m流中的小波系数。然后,根据
和
在时间序列中的相互可见性,确定顶点
和
之间的边缘
'为:

根据[26]可知,如果没有和
直线相交的中间点,
和
可见。

这里t''是t和t'之间的时间戳。图3示出了ht与ht'之间的相互可见性。

此外,阈值ε通常应用于斜率并控制顶点之间的连接,从而调节图密度:

通过VG建模,疾病改变的ECG模式被转化为VG的拓扑变化。为了证明这一点,我们分别从正常心电图和右束支传导阻滞(RBBB)引起的异常心电图中投射出两个VGs。如图4所示,构建的VGs捕获了心电信号形态的差异。

3、图卷积网络
在过去的几年里,将深度学习扩展到图已经受到了越来越多的关注。在cnn的基础上,人们发展了各种方法将卷积运算从图像推广到图,称为图卷积。类似于在二维图像的像素上执行的空间卷积,顶点的图形卷积从其相邻顶点聚集信息[27]。因此,可以捕获和表征图的局部拓扑模式。为了学习全局图拓扑,可以执行图池化[28]。在本研究中,我们只关注空间图卷积。对于其他类型的图卷积(如谱图卷积)以及其他类型的图神经网络(如循环图神经网络),请参考[27]中的综合综述。
将VG的邻接矩阵表示为A(所有顶点都添加了自环),图卷积运算可以表示为[28]:
![]()
式中,D为对角度矩阵, X为顶点属性矩阵(在本研究中,由于没有为每个节点分配先验属性,因此均为1),W为可学习参数集合,f(⋅)为激活函数。利用Eq.(5)中定义的空间卷积,将每个顶点的局部拓扑信息聚合成顶点特征矩阵Φ。进一步,顶点信息通过多层图卷积传播,即:
![]()
其中,k为层索引,Φ(0) = x。最后,将输出连接为:
![]()
其中⊕表示连接操作。因此,Φ捕获VG的多尺度拓扑特征,并且Φ的每一行都是VG中相应顶点的特征向量。
将顶点信息编码为Φ后,为了便于预测,进一步对整个图进行编码是很重要的,即确定图(以及相应的心电记录)是否属于健康受试者。然而,直接使用所有顶点信息在计算上具有挑战性,因为VG可能包含大量顶点。与[28]类似,SortPooling被用于图粗化。值得注意的是,图卷积的输出为,其中T为图中顶点的个数,q为特征通道的个数。SortPooling的目的是通过根据结构重要性对顶点进行排序,将Φ的大小减少到M × q,并为后续层选择最上面的M(通常< T)顶点。由于图卷积层逐渐将图结构信息聚集到Φ的最后一个特征通道,即Φ(K)中,首先通过Φ(K)中的值降序排序顶点。如果两个顶点在最后一个通道中具有相同的值,则比较它们在Φ(K-1)中的值。排序后,如果T > M, Φ将被截断,只保留前M行,否则,(M-T)为零的行将被填充为Φ。据此,执行1D卷积将Φ映射到特征向量
。
4、信息融合与注意力
为此,通过对HRV时间序列(在r流中)和小波系数(在m流中)的VGs进行图卷积提取心电节律和形态特征。如何融合不同方面的信息,协同确定原始心电记录的标签是非常重要的。许多现有研究直接将特征向量拼接成一个长特征向量用于预测建模(例如[3,29])。虽然可以使用主成分分析(PCA)或特征选择[29],但隐藏在特征中的重要信息可能会丢失或模糊。因此,针对特定的模式识别任务,有必要自适应地确定特征的重要性,并突出显示重要性较高的特征。
本研究整合了注意机制进行信息融合。注意机制广泛应用于自然语言处理和计算机视觉,它通过动态选择有助于有效执行特定任务的输入部分来突出特征的重要性/相关性[30]。假设特征向量为:χ (p), p = 1,2,⋯,p,其中p是要融合的特征的总数。
注意机制的基本思想是得到特征的加权和为:

通过用双层神经网络识别权重αp:

这里f(⋅)是一个激活函数(例如,tanh(⋅)),U和V是可训练的权值。在DG-ECG中,为了融合来自i)多个小波系数,ii)连续心电段和iii)多个心电导联的信息,包括三个注意级别。特别地,注意力(方程式(8)和(9))首先应用于φ(w),即深度图神经网络的输出,由小波系数(w = 1,2,…,W,其中W为小波系数的总数)构造的VG进行交叉系数融合,得到5个心电段的特征向量η(s)。然后,在η(s)上部署双向LSTM网络[31](s = 1,2,…,S,其中S为从一个ECG导联获得的段总数),以表征连续段之间的时间关系。然后,将注意力应用于LSTM网络的正向和反向输出,以获得第c个ECG导联的特征向量γ(c)。最后,进行交叉导联注意,融合所有C导联的信息,获得m流的特征向量,并与r流的图特征聚合(例如,通过加权和)来预测原始心电记录的标签。
为了进一步增强注意机制,开创性的研究建议将先验知识纳入模型[32]。对于交叉系数融合,期望能量较高的小波系数包含更多的信息。然后从每个系数φ(w)中计算出知识为,其中PSD(⋅)是功率谱密度的函数。然后将这些知识与φ(w)结合,得到注意力权重αw。同样,对于横段融合,波动较大的ECG段可能表明异常的证据更强。因此,可以通过计算每段的标准差η(s)来获得知识,即
,并进一步将其与η(s)结合,以获得融合连续心电段信息时的注意权值。对于交叉导联融合,如果可以获得专家知识,则可以实施类似的基于知识的注意机制,以确定哪个ECG导联对某种心脏疾病的重要性更高。在我们的实验中,我们让注意机制自动确定ECG导联的权重(通过Eq.(8)和(9)),而不纳入知识。这反过来又证明了DG-ECG在没有先验知识的情况下处理各种心脏疾病的能力。
4、性能评估
本研究采用受试者工作特征下面积(AUROC)、精确召回曲线下面积(AU-PRC)和F-score对发育的心电图进行评价。给定从测试集中得到的真阳性(TP)、假阳性(FP)、真阴性(TN)和假阴性(FN),则真阳性率(TPR)和假阳性率(FPR)分别可计算为:TPR = TP / (TP + FN)和FPR = FP / (FP + TN)。ROC绘制了不同分类阈值下TPR相对于FPR的变化情况,并利用曲线下面积进一步总结得出AU-ROC。此外,precision和recall的计算公式分别为precision = TP / (TP + FP)和recall = TP / (TP + FN)。由此,F-score可计算为:
![]()
此外,准确度和召回率可以通过跨分类阈值的PRC可视化,这可以通过曲线下的面积总结为AU-PRC。值得注意的是,AU-ROC和AU-PRC是机器学习中广泛使用的指标。AU-ROC表征了模型的预测能力,AU-PRC强调了正预测值与真阳性率之间的关系,当数据集包含不平衡类别时,真阳性率通常用于补偿AU-ROC[32]。F-score也被广泛应用于医疗数据分析。它向医生提供简明的信息,在临床实践中得到广泛应用。
四、实验结果与讨论
为了评估所建立的方法,本研究进行了两个现实案例研究,即血脑屏障的识别和房颤的筛查。值得注意的是,选择这两种心脏疾病,特别是因为1)血脑屏障主要反映在ECG形态学的异常上,2)房颤主要改变心律。
1、案例研究1 -束状分支块的识别
血脑屏障是由His-Purkinje系统的电传导通路阻塞引起的,从而破坏了正常的心室活动。阻塞可能发生在左(右)心室束,当左(右)心室束阻塞时,左(右)心室的激活将被延迟,因为它起源于隔膜。因此,将在QRS复合体中产生“M形”模式,可能出现S波加宽和T波异常。血脑屏障通常预示着其他心脏疾病,并可能导致严重后果。例如,发生左束支传导阻滞(LBBB)的患者可能会发展为心力衰竭,而患有RBBB的患者全因死亡率和心源性死亡的风险增加[33,34]。因此,检测血脑屏障对早期医学干预和治疗具有重要意义。
本病例研究的重点是RBBB,因为RBBB被认为更难检测(例如,与LBBB相反,心轴在RBBB存在时仍保持正常)。12导联心电图记录来自2018年中国生理信号挑战(CPSC)数据集[35],该数据集来自多家医院。总共使用了2613个心电图记录,其中包括来自RBBB患者的1695个记录和来自健康受试者的918个记录。心电记录长度为6 ~ 60秒,以500hz采样率进行数字化处理。在这里,我们按照[32]对心电记录进行滑动窗口预处理,得到等长信号(即每个12导联心电信号的长度固定为3000)。
(1)基准及表现量度
我们首先比较了心电图与基准方法。具体来说,考虑了两类基准方法:
a)手工制作心电特征+预测建模。在文献中,手工特征被广泛用于疾病改变的ECG模式的识别。根据最先进的研究[36 - 39],从心电信号的时间和频率域中提取了36个手工制作的特征。36个特征的详细信息如附录a中的表A1所示。进一步进行特征选择以降低特征集的维数(选择前15个特征)。此外,本文还采用了目前心电分析中常用的两种预测模型LR和SVM,分别记为HandFeatures-LR和HandFeatures-SVM。
b)深度学习方法。正如引言部分所讨论的,深度学习越来越多地用于ECG模式识别。在本研究中,我们将开发的DG-ECG与i)堆叠周期用于ECG分类的CNN模型[40](表示为CNN)进行比较。ii)心电信号和HRV同时作为输入的双流CNN,然后是RNN模型[41](记为bi-stream - crnn)。iii)以心电图像为输入,用二维卷积神经网络进行处理的CNN模型[42](记为ECG- image)。iv) A C. Kan等。一个流是CNN,另一个流是袋装树集成模型的并行模型[43](记为CNN- ensemble)。附录A提供了深度学习基准的实现细节
(2)DG-ECG的实现细节
对于r流,通过检测心电记录中连续的r峰提取HRV时间序列。对于m流,每个心电导联被分成长度为1000的不重叠段。采用小波包变换将每个心电段分解为4个系数(2级),仅保留前两个系数,后两个系数主要传递高频噪声。进一步,将每个系数转换为一个VG,阈值ε = 0(即对图密度没有约束)。对于图卷积神经网络,我们采用[28]的结构,即网络由四个图卷积层组成,分别为32、32、32和1个通道。为了注意,我们采用了广泛使用的两层结构[32,44]。如上所述,专家知识已被纳入交叉系数和跨段注意中,并且在没有先验知识的情况下进行交叉引导注意。M-stream和R-stream的输出通过加权和进行汇总,然后是两个1-D卷积层,一个完全连接层和一个Softmax层来生成最终的预测(与[28]中的设置相同)。值得注意的是,使用加权和代替注意力机制来允许进一步合并临床领域知识。例如,如果心脏病专家认为目标疾病对心律的影响更大,那么Rstream可以被赋予更高的权重。如果没有提供临床领域知识,那么将相等的权重(即50%)分配给两个流。我们的实验是基于Mstream和R-stream之间的相等权重。
(3)性能比较
DG-ECG与基准之间的性能比较结果总结于表1。对于类别#2中的两个基准,即CNN和Bi-Stream-CRNN,以及开发的DG-ECG,它们分别在单导联ECG和12导联ECG信号上实现。其余的仅在V1导联上实现(通常用于诊断RBBB)。
如表1所示,选择的手工ECG特征(即基准类别#1)在检测RBBB模式方面非常有效,更复杂的分类器(即SVM)比简单的分类器(即LR)表现更好。使用深度神经网络,基准类别#2中的方法和我们的DG-ECG与基准类别#1中的方法相比,显著提高了检测性能。具体来说,当只使用V1导联时,所提出的DG-ECG效果更好。f值为0.942,比Bi-stream-CRNN(第二优模型)提高2% =(0.942 - 0.923)/0.923,比ECG-Image(第三优模型)提高2.6%。对于其他两个指标,它实现了0.974的AU-ROC,与Bi-stream-CRNN相比提高了1%,与ECG-Image相比提高了1.3%。DG-ECG的AU-PRC为0.982,比Bi-stream-CRNN高1.2%,比ECG-Image高3.5%。当全部使用12根导联时,DG-ECG的F-score比Bi-stream-CRNN提高了1.6%,也达到了最佳效果。值得注意的是,执行了10次交叉验证,表1中的结果是通过在10次交叉验证上平均测试折叠上的性能得到的。

图5a和5b分别显示了10次折叠的ROC和PR曲线。对于ROC,曲线越靠近左上角表示性能越好(即真阳性率越高,假阳性率越低)。对于PR,右上角的曲线显示了更高的准确率和召回率。值得注意的是,DG-ECG在ROC和PR的每一层上都表现良好,10层之间的变化非常小(见灰色阴影区域)。这反过来又证明了所开发方法的健壮性。
 (4)注意力和可解释性
(4)注意力和可解释性
除了检测能力外,模型的可解释性也是临床应用中需要关注的问题。与许多直接将深度神经网络训练为黑盒的方法不同,DGECG的输出由于多层次注意机制而具有较高的可解释性。为了说明,图6a和6b显示了两个心电信号的横段注意结果。如图6a中红色箭头所示,seg# 1内的信号有一个明显不规则的周期。对于图6b中的信号,三个段内的周期非常相似,变化很小。如图6a下半部分所示,与图6a中其他两个片段的权重相比,第一个片段获得的跨片段注意权重最高。对于图6b中的信号,三个权值非常接近。因此,DGECG的注意机制能够自动强调重要性较高的相关成分(即对ECG异常的检测和鉴别贡献更大)。这反过来又说明了DG-ECG的检测结果具有高度的可解释性,从而在临床实践中提供了支持循证心电图诊断的重要信息。
(5)消融实验
此外,我们通过消融术研究来评估已开发的DG-ECG。对于影响心电图心电图性能的参数,部分采用原模型并保持不变,如;例如,图卷积神经网络的结构和注意网络的结构,其中一些是手动调整以获得最佳性能,例如,每个心电段的长度(设置为1000)和小波分解水平(设置为2)。在这里,我们实验评估了DG-ECG对1)心电下采样,2)VG构建和3)图池化的关键参数的敏感性,这些参数涵盖了实现DG-ECG的三个阶段,即:心电数据准备,基于图的心电表示,以及用于心电模式识别的图学习。值得注意的是,当使用单导联心电图(V1导联)时,进行消融研究。
心电下采样已广泛用于表征学习以减少计算负担[45]。目标是在降采样后缩短的信号中保留原始ECG的主要(粗粒度)模式。在这里,我们均匀地将ECG降采样到原始长度的90%、80%和70%(表1所示的结果没有降采样,即原始长度的100%)。如图7所示,失去信号中的细粒度细节将影响开发的DG-ECG的性能。当降低到90%和80%时,前两个指标(即AU-ROC和AU-PRC)分别略微下降最多1.5%和1.2%,Fscore下降4%。然而,当只剩下70%的长度时,与使用100%相比,这三个指标显著下降,即AU-ROC下降>8%,AU-RPC下降>6%,F-score下降>6%。
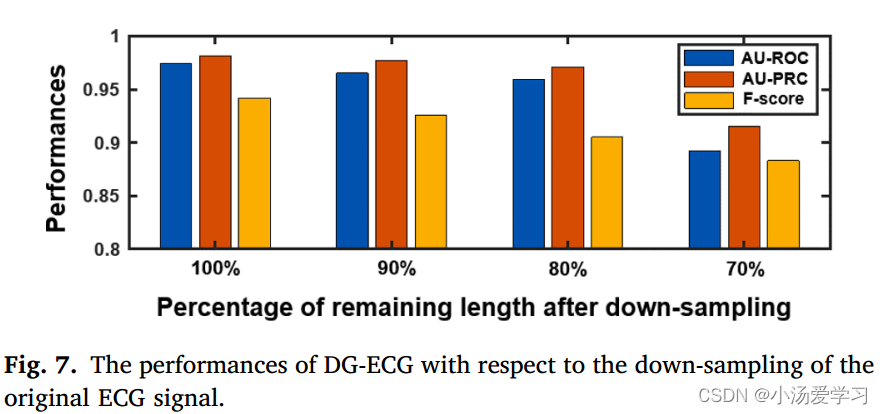
图8显示了VG构建中不同阈值ε(见Eq.(4))时DG-ECG的性能变化。可以注意到,随着ε的增加,图中可以连接的顶点越来越少。因此,VG的密度降低了,也就是说,图变得稀疏了。如图所示,这三个性能指标急剧下降。ε从0增加到0.005将使AU-ROC降低5%,AU-PRC和F-score降低近4%。当ε增大到0.015时,各项指标均低于0.85。
 最后,DG-ECG的性能根据SortPooling参数M进行评估,即SortPooling后保留的顶点数(见3.3节)。与[28]类似,我们不直接改变M,而是使用百分比,定义为训练集中顶点数大于M的图的百分比。例如,当使用60%时,M设置为位于训练集中排序图的第40百分位(从最大到最小)的图的顶点数。如图9所示,所开发的DG-ECG对SortPooling参数的变化具有鲁棒性。当将参数从80%降低到40%时,可以观察到性能指标的微小变化(即不超过0.6%)。
最后,DG-ECG的性能根据SortPooling参数M进行评估,即SortPooling后保留的顶点数(见3.3节)。与[28]类似,我们不直接改变M,而是使用百分比,定义为训练集中顶点数大于M的图的百分比。例如,当使用60%时,M设置为位于训练集中排序图的第40百分位(从最大到最小)的图的顶点数。如图9所示,所开发的DG-ECG对SortPooling参数的变化具有鲁棒性。当将参数从80%降低到40%时,可以观察到性能指标的微小变化(即不超过0.6%)。

2、案例研究II -房颤筛查
房颤是最常见的心律失常,是由心房复杂的电缺陷引起的(例如,快速聚焦、复杂的多重重入电路或旋翼)。当心房颤动发生时,窦房结的正常节律被快速和不规则的心房活动打乱(例如,心房颤动时心房细胞每分钟放电400 - 600次)。结果,心房只颤动而不收缩,这影响了正常的心室率(即心率)。此外,心房和心室的收缩可能不协调,导致心输出量降低。据美国心脏协会统计,美国有270多万人患有房颤[46]。房颤是中风和充血性心力衰竭的主要原因,在心脏手术后患者中发病率很高(约为20% ~ 50%)[6]。因此,准确检测房颤对于及时提供挽救生命的治疗(例如,抗心律失常药物和电复律)是非常必要的。
在本研究中,使用了2017年PhysioNet挑战赛的单导联心电信号[47,48]。数据集由738例房颤患者和5050名健康受试者的信号组成,采用AliveCor设备记录心电信号(采样频率为300 Hz,长度为9 ~ 60 s)。与案例研究1类似,我们将每个心电记录的长度均衡为3000。所开发的DG-ECG和基准方法的性能如表2所示。在这里,执行了10次交叉验证,表2中的结果是通过在10次交叉验证上平均测试折叠上的性能得到的。可以注意到,DG-ECG的性能明显优于所有基准。在基准类别#1中,两种方法的au - roc都在0.86左右,au - prc <0.9, f分数在0.85左右。与它们相比,类别#2的基准具有较高的性能。在所有基准中,ECG-Image的AU-ROC最佳,为0.925,Bi-stream-CRNN次之,为0.919。对于AU-PRC, Bistream-CRNN是最佳基准(0.922),其次是ECG-Image(0.883)。对于F-score, Bi-stream-CRNN达到了0.897,是其他基准测试中最好的。最后,开发的DG-ECG在AU-ROC中的表现优于ECG-Image 3.8%。与Bi-stream-CNN相比,AUPRC提高了2.5%,F-score提高了1%。结果表明,DG-ECG检测af诱发的心电图异常模式是有效的。
五、结论
在这项研究中,提出了一种新的心电图-心电图框架,用于心脏信号的疾病模式识别。DG-ECG结合了多个深度图学习流,从多个角度提取疾病改变的ECG模式。在每个流中,信号由VGs建模,并由图卷积神经网络进一步处理。通过探索图拓扑,可以揭示潜在的疾病引起的心脏电活动变化。此外,将注意机制整合到心电图中,实现多层次信息融合。有了注意力网络,重要的特征会被学习并自动突出显示。这反过来又增强了已开发框架的检测和区分能力及其可解释性。实验结果表明,开发的DG-ECG能够检测疾病改变的ECG形态模式以及节律模式。
值得注意的是,DG-ECG并不局限于特定类型的心脏病。相反,它适用于各种心脏疾病。本文将DG-ECG用于血脑屏障和房颤两种疾病的检测,血脑屏障主要影响心电图形态,房颤主要改变信号节律。因此,我们在DG-ECG中分别使用Mstream和R-stream来识别疾病改变的形态和节奏模式。对于其他心脏疾病,很容易将更多的流合并到DG-ECG中,并根据需要从ECG信号中捕获其他方面的信息以进行疾病模式识别
总之,DG-ECG在临床实践(如心脏重症监护病房)中具有很大的应用潜力,可用于识别各种心脏疾病并促进循证诊断和预后。目前的临床实践在很大程度上依赖于训练有素的心脏病专家对心电图模式的手动分类(这已被证明效率较低,并受到人为错误的污染),以及使用简单的时间和频域特征(识别复杂疾病动态或早期疾病改变的心电图模式的能力较弱)。DG-ECG有望在临床实践中提高心电图分析的准确性和效率。沿着这个方向,未来的工作将主要在三个方面进行。首先,在本研究中没有评估DG-ECG对噪声的鲁棒性。值得注意的是,在临床实践中,心电信号中的感知噪声是常见的,它会降低信号质量,给模式识别带来重大挑战。在我们未来的工作中,在将信号分类到DG-ECG的多个流之前,将增加一个去噪模块。其次,我们的病例研究侧重于区分某些ECG异常与正常模式。我们未来的工作将扩展DG-ECG,加入多类别分类功能,从而发现和解释各种疾病引起的异常心电图模式。第三,我们量身打造DG-ECG从分类到连续监测,结合统计控制图。与我们之前的工作[49]类似,DG-ECG将添加实时对比图,当检测到具有统计学意义的异常时发出信号。























 2721
2721

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








