
肝母细胞瘤(HB)是最常见的儿童恶性肝脏肿瘤之一,80%~90%发生在5岁以内。HB被认为来源于肝前体细胞,在形态上与未成熟的肝细胞相似。目前,通过术前化疗和手术切除,已成功挽救了许多患者的生命。对于该癌症的早期患者,治疗后的五年生存率已超过80%。但对于晚期患者,五年生存率低于60%。此外,医学上对HB的临床预测指标并不完善,因此改善高度恶性HB患者的预后,对HB进行恶性分级评估非常必要。
近期,来自广岛大学生物医学与健康科学研究所小儿外科的桧山英矶博士在Nature Communications杂志上在线发表题为“Genetic and epigenetic basis of hepatoblastoma diversity”的文章。研究团队根据从日本小儿肝脏肿瘤研究组(JPLT-2)获得的数据对163例儿童肝脏肿瘤(154例HBs和9例肝细胞癌)进行了综合基因组分析。研究结果阐明了肝母细胞癌变过程中的分子机制,并通过全面的基因组、表观基因组和转录组分析确定了HB在分子水平上区分的亚型。

文章发表在Nature Communications上
研究人员首先使用全基因组测序分析(WGS)、全外显子组测序分析、PCR和sanger测序检测外显子中特殊的片段——CTNNB1。通过大量组学手段的分析,结合Karkinos软件的分析,绘制出HB的种系突变谱图(图1)。研究发现,在所有肿瘤数据中CTNNB1基因大量缺失,说明CTNNB1是最常突变的基因(77.6%)。此外,根据测序数据发现,HB的突变频率与诊断年龄呈正相关(图 1c);HB的突变频率显着低于成人肝细胞癌(HCC)(图 1b)。基于WGS数据的体细胞碱基替换模式分析(图 1d)显示,最常见的碱基替换是C-to-T转换(32%),其次是C-to-A转换(21%)和T-to-C的转换(20%)。

图1.HB的突变谱图。来源:Nature Communications
随后,研究人员通过Affymetrix 6.0 SNP阵列分析、GISTIC2.0分析和WGS分析,确定了HB的SV、SNP和染色体稳定性(图2)。Affymetrix 6.0 SNP阵列分析了112个HB体细胞拷贝数变化,以识别染色体臂水平的增加和丢失、区域性扩增和缺失以及单亲二体(UPD)(图 2a)。阵列分析发现,4q35.1的缺失包含了IRF2基因(图 2b)。IRF2基因被报道为HCC中p53相关的肿瘤抑制基因。SNP阵列上的等位基因特异性调用显示,11p染色体中有39例(34.2%)UPD,其中包含H19/IGF2印记区域(图 2c)。染色体的稳定性分析显示32例(29%)具有染色体不稳定性(CIN)(图 2d)。

图2.HB基因组的SV和基因组稳定性。来源:Nature Communications
随后,研究团队通过RNA测序和共识聚类分析确定了三种肿瘤亚型和正常组织(图3)。
“proliferative”:主要表达细胞周期相关基因(CCNB2、E2F1、MKI67、MYCN)和AFP,表明其具有细胞增殖的侵袭性。该亚型的肿瘤还具有经典Wnt 靶向基因(LGR5、TBX3、BMP4、ASCL2、RNF43、DKK1、SP5、NOTUM和GPC3)的高表达,这些基因与CTNNB1的高频率突变或缺失相关。
“mesenchymal”:肿瘤中上调的基因组以T细胞受体、基质金属蛋白酶(MMPs )和颗粒酶(GZMs)为特征,表明细胞毒性免疫细胞(CTLs、NKT 和单核细胞) 的肿瘤内浸润与ECM降解相关。
“hepatocyte”:肿瘤高表达与成熟肝细胞代谢功能相关的基因,;例如细胞色素P450(CYPs)、UDP葡萄糖醛酸转移酶(UGTs)和金属硫蛋白家族基因(MTs)。

图3.HB中的基因表达亚型。来源:Nature Communications
研究团队还对146个肿瘤和11个非癌性肝组织使用Infinium HumanMethylation450 BeadChip (Illumina)分析。BeadChip和全基因组亚硫酸氢盐测序(WGBS)显示出临床样本中甲基化水平的良好相关性。从两种已知 ICR的甲基化分析结果中可以得出,在肝母细胞癌发生过程中父本等位基因会被优先选择。IGF2启动子1(Pr1),被称为成人肝脏特异性启动子,在胎儿肝脏(胎龄18周)中甲基化密集,但在儿童HB肝脏中以年龄依赖性方式逐渐低甲基化(图 4)。相反,Pr2(胎儿组织启动子)在非癌性肝脏样本中表现出甲基化逐渐增加,在成人肝组织中表现出甲基化密集。

图4.HB中IGF2启动子的甲基化状态。来源:Nature Communications
研究团队通过CHIP-seq技术,使用H3K27ac探针,基于甲基化水平将HB进行分型(图5)。亚型E1肿瘤具有TLCT/HCN-NOS和TERT启动子突变,E1中的超甲基化显示富含GC的序列富集,这意味着富含CpG的增强子附近的超甲基化。E2/3亚型在H19/IGF2区域中表现出高频率的拷贝数畸变,表明该亚型具有高有丝分裂活性的胚胎表型。亚型E4显示出增强子甲基化的细微变化,可能是由于肿瘤含量低(“正常样”)。E4中的低甲基化显示出ETS因子识别基序的富集,与免疫细胞的肿瘤内浸润一致。

图5.HB中的增强子甲基化亚型和异常低甲基化。来源:Nature Communications
上述研究结果表明,HB表观遗传失调以及IGF2启动子的异常甲基化模式,可能支持HB细胞中“细胞起源”的假设(图6)。
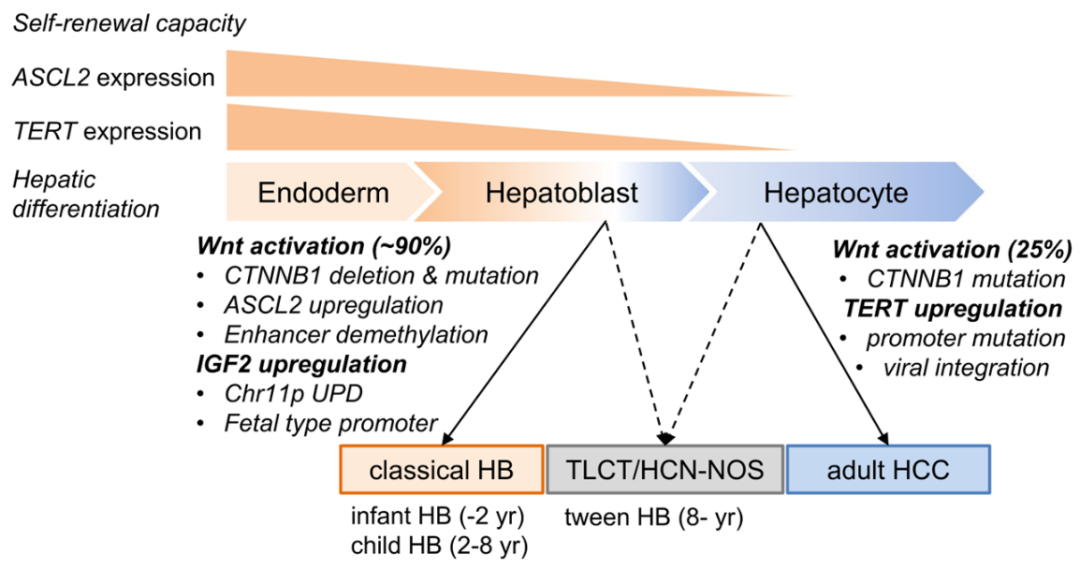
图6.儿童和成人肝脏恶性肿瘤的“起源细胞”假说概述。来源:Nature Communications
在细胞从定形内胚层向成肝细胞和肝细胞分化成熟的过程中,干细胞相关因子ASCL2和永生相关基因TERT的表达降低,自我更新能力下降。由于遗传和表观遗传异常,源自成熟肝细胞的经典HB表现出Wnt的高激活和IGF2的持续上调,而源自具有低TERT表达的成熟肝细胞的成人肝细胞癌(HCC)由于启动子突变表现出上调和病毒式整合。Wnt 激活(25%)主要是由于CTNNB1的突变。
总结
虽然儿童肝肿瘤国际合作(CHIC)近期的评估表明HB临床和表型多样性,但尚未对其分子背景进行分析。此前研究中包括的患者数量不足以确定个体间异质性或仅应用于单个分子特征。在该研究中,原发性儿童肝脏恶性肿瘤的综合分子分析揭示了HB中基因组、表观基因组和转录组特征的明显多样性。全基因组和全外显子组分析表明,HB的基因组畸变与诊断时的年龄密切相关。拷贝数分析结果显示,28.6% HB的染色体不稳定。此外,研究团队基于这个庞大的HB样本群确定了分子水平区分的HB亚型。HB系统的分子分析对于了解在肝母细胞癌发生过程中发生的表观遗传驱动事件至关重要,可为精准医学中的风险分层提供必要线索。
参考文献:
Nagae, G., Yamamoto, S., Fujita, M., Fujita, T., Nonaka, A., Umeda, T., ... & Hiyama, E. (2021). Genetic and epigenetic basis of hepatoblastoma diversity. Nature Communications, 12(1), 1-16.
https://www.nature.com/articles/s41467-021-25430-9#Sec31
往期精品(点击图片直达文字对应教程)
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集























































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








