点评丨朱冰(中国科学院生物物理研究所)、李兵(上海交通大学医学院)
责编丨迦溆 来源 | BioArt
温馨提示:本次点评精彩纷呈,不容错过!
真核细胞的基因转录需要经历起始,延伸,终止等多个阶段。多细胞生物为了满足在同一套基因组的基础上实现差异性的基因表达,需要经过非常复杂且精细的基因表达调控过程。基因表达调控主要集中发生在转录的起始阶段,细胞中基因的转录默认是低活性状态,需要经历一系列复杂的转录起始过程,才能起始基因表达。RNA聚合酶II(Pol II)本身不具备结合和打开基因启动子的能力,需要与6个通用转录因子(general transcription factors,GTFs)包括TFIID、TFIIA、TFIIB、TFIIF、TFIIE以及TFIIH共同在启动子上组装形成转录前起始复合物(preinitiation complex,PIC),才能起始转录。在ATP的驱动下,PIC打开转录起始位点(transcription start site,TSS)附近的DNA双链,DNA模板链进入Pol II活性中心,以NTP为素材,开始生成RNA。转录起始过程涉及十余个复合物上百个蛋白的巨大转变,过去几十年来,众多的课题组利用生物化学、单分子生物物理以及结构生物学等方法开展了大量探索性的工作,但对其发生过程和分子机制的理解还远远不够深入。
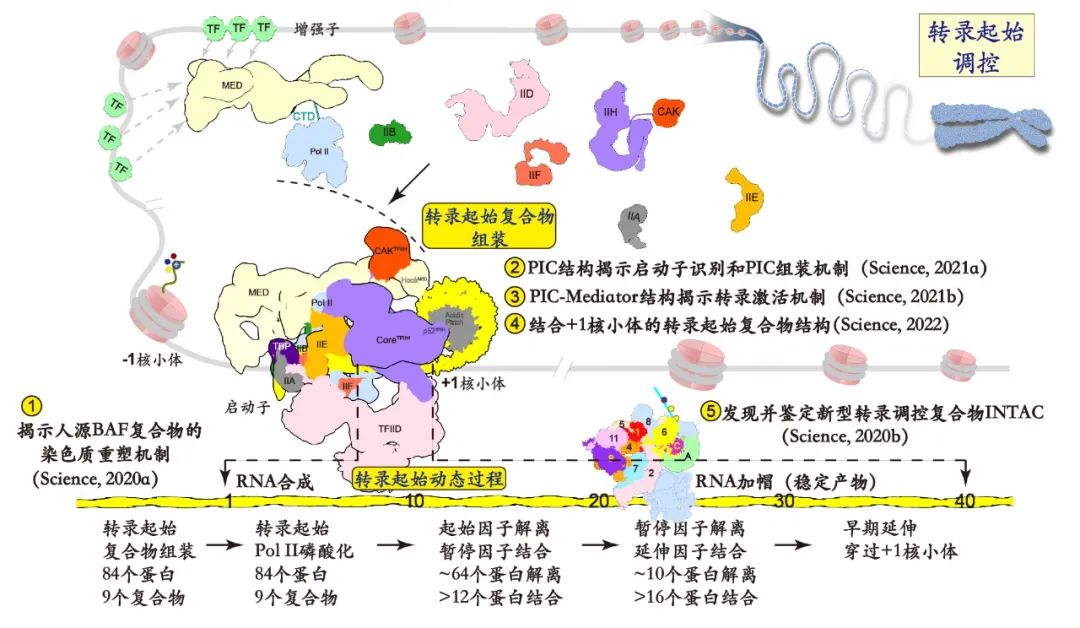
图1. 转录起始调控示意图。黄色数字标注是徐彦辉团队过去几年来在转录起始方向取得的代表性成果。
近几年,复旦大学徐彦辉团队连续在Science杂志发表5篇研究论文,揭示多个转录起始关键过程的分子机制,包括揭示人源BAF复合物的染色质重塑机制(Science丨徐彦辉团队揭示人源BAF复合物的染色质重塑机制)、揭示转录起始复合物识别基因启动子及其动态装配机制(专家点评Science丨新突破!徐彦辉团队全面揭示转录起始复合物的工作机制)、揭示中介体促进RNA聚合酶磷酸化和转录激活机制(专家点评Science丨徐彦辉团队揭示完整转录起始超级复合物结构与功能)、揭示+1核小体调控转录起始的分子机制(专家点评Science | 徐彦辉团队揭示+1核小体调控转录起始的分子机制)以及发现并鉴定新型转录调控复合物INTAC (专家点评Science | 徐彦辉/陈飞合作发现新的转录调控复合物INTAC并揭示其结构和功能,更新对磷酸酶PP2A的认知)。上述工作较为系统的揭示了转录起始各个阶段关键点的复合物状态,推动了对转录机制的深入理解。 但上述工作,以及目前几乎所有的研究工作,都没有展示出转录起始从双链DNA打开,RNA合成,到聚合酶在DNA上运动这些动态过程,我们对转录的理解仍然停留在静止的阶段。
过去数十年积累的大量生化研究提出了转录起始阶段会发生显著的功能和蛋白组成的变化。当转录开始时,TFIIH将转录起始位点附近的DNA双链打开,模板链进入Pol II的活性中心,PIC转变形成了初始转录复合物(initially transcribing complex, ITC);随后,Pol II以NTP为底物,催化合成RNA,期间经历一系列复杂的结构和复合物组成变化,ITC转变形成早期延伸复合物(early elongation complex, EEC),进入后续的延伸过程。这些生化实验描绘出了转录起始的大致过程,但由于实验设计和实验材料的不一致,不同的实验结论之间相互矛盾,许多结论长期以来未得到统一。尽管领域内进行了几十年的生化和结构研究,但对于转录从头起始如何发生、ITC如何转变成ECC、转录泡为何崩塌,以及转录起始早期过程中潜在的分子机制仍然存在很多问题未被解答。
2023年12月22日,复旦大学徐彦辉团队在Science杂志上在线发表题为Structural visualization of transcription initiation in action 的研究长文。该项研究首次用结构重现出了转录从头起始的16个连续动态全过程,揭示了通用转录因子(GTFs)和转录泡协同RNA聚合酶Pol II调控转录起始向转录延伸转变的分子机制。

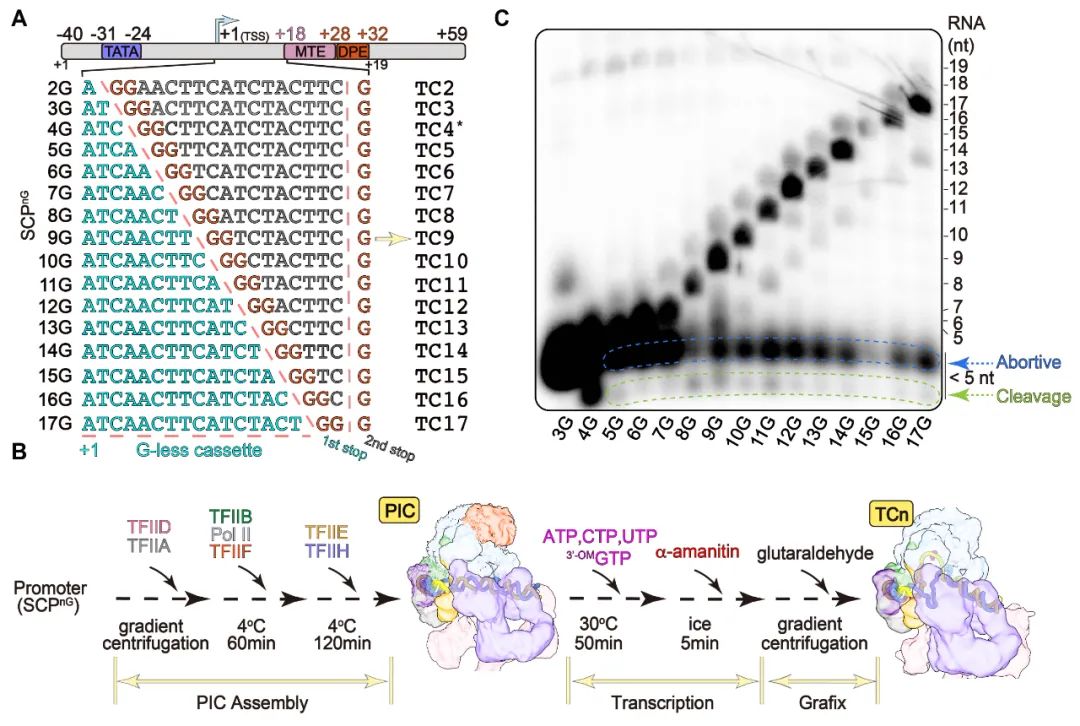
图2.体外重建转录复合物体系。(A)16个(分别暂停在转录起始位点下游2-17位核苷酸的位置)的G-less DNA模板示意图。(B)体外转录活性实验。(C)转录复合物体外组装示意图。
研究团队通过在G-less DNA模板(从转录起始位点TSS到转录暂停位点中间的非模板链不包含G,转录暂停位点处添加GG)上组装转录前起始复合物PIC,随后通过加入ATP, CTP, UTP以及GTP类似物(3’-O-methly-GTP)起始转录反应(图2)。利用该转录体系,研究人员将转录反应人为的暂停在转录起始位点下游2-17位核苷酸的位置,随后结合体外活性实验分析以及冷冻电镜单颗粒技术展开研究。
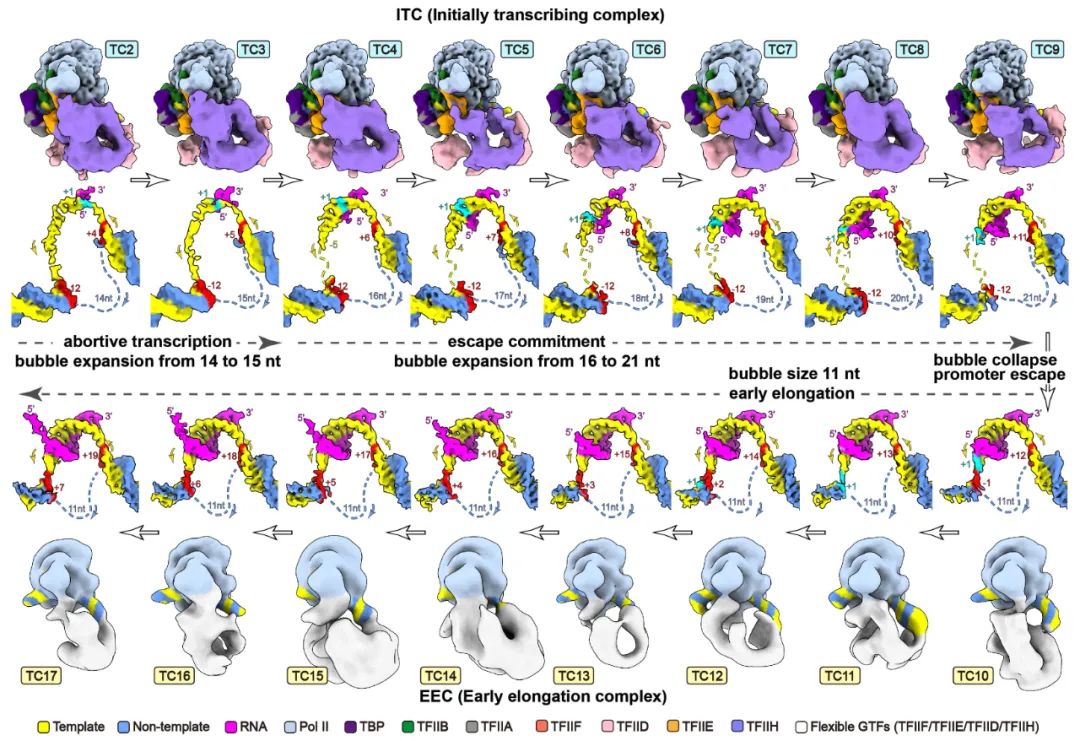
图3. 解析的16个转录复合物结构。
由于复合物的组成和构象不均一,为了获得高分辨率结构数据,研究人员利用300 kV 冷冻电镜上采集了约110天,共580,409张照片数据,获得了分别暂停在转录起始位点下游2-17位核苷酸,核心分辨率为2.7-3.3 Å,共16个转录复合物(TC2-TC17)的结构(图3)。通过这16个连续的结构,结合早期该课题组解析的转录前起始复合物PIC结构,研究团队描绘出了连续的17个转录起始动态全过程,揭示完整转录起始过程及其分子机制(视频1):
视频1. Pol II转录起始过程。三个不同的方式展示同一个动态过程。其中左侧为完整复合物,右上为隐去覆盖核酸的部分蛋白质以显示催化中心和核酸相互作用关系,右下为核酸(黄色的为模板链)。
转录开始时,PIC中的TFIIH利用ATP水解产生的能量,使下游启动子移位(translocation),DNA双链打开,模板链进入Pol II的催化中心,形成一个包含约13个nt的转录泡(transcription bubble)的开放复合物(OC/TC1)。随着NTP的加入,OC转变为初始转录复合物ITC(TC2到TC9),RNA开始合成并逐步经历由流产转录(abortive initiation)向逃逸决定(escape commitment)状态的转变,解开的模板单链引导新生RNA合成,随着RNA链从2到9个nt的逐步延长,RNA与模板链的结合逐步紧密。在此过程中,Pol II与启动子上游以及GTFs保持紧密结合,转录泡从14个nt逐步扩大到21个nt。
当RNA链由9nt增加到10nt时,NTP水解驱动RNA-DNA移位并推动所累积的模板单链胀破由TFIIB和Pol II形成的模板链通道,导致TFIIB连带其他GTF从Pol II上解离,转录泡从21nt“崩塌”(bubble collapse)成11nt,转录复合物由ITC转变成EEC状态,Pol II从启动子逃逸(promoter escape)。逃离起始区域的Pol II以EEC的状态(TC10-TC17)继续在DNA上转录。这一复合物后续会发生转录暂停、RNA盖帽、暂停释放、稳定延伸、终止等过程(机制待未来揭示)。
为什么起始过程中转录复合物需要经历如此大的转变?
为了避免错误转录的发生,高等生物进化出复杂的转录起始复合物,利用GTFs帮助Pol II结合和打开基因启动子,因此GTFs对于正确的转录起始是极其必要的存在。但由于GTFs、Pol II和启动子之间的稳定相互作用也会对Pol II离开起始区域造成了巨大的阻碍。为了保证Pol II能够成功的逃离起始区域,进入转录延伸阶段,这些GTFs、Pol II和启动子之间的相互作用必须被破坏。
在早期ITC(early ITC, TC2-TC3)中,Pol II活性中心和模板链通道可以容纳模板链,允许转录泡扩张和初始不稳定的短RNA的合成。在晚期ITC(late ITC, TC4-TC9)中,随着RNA的合成,RNA-DNA杂交链逐渐稳定,二者稳定的结合为支持NTP所驱动的DNA-RNA移位以及GTFs-Pol II-启动子之间相互作用的瓦解提供了基础。在最终形成的EEC中,结合松散的GTFs不再限制Pol II停留在启动子上,使得Pol II 能够轻松逃离起始区域,进入下一延伸阶段。因此,GTFs和转录泡的协同变化完美的支持了Pol II从需要GTFs结合并打开启动子进行初始RNA合成到后续Pol II需要GTF解离和转录泡崩塌以逃离启动子进入稳定RNA生产的功能性过渡。
这项工作研究将过去几十年来数百篇关于转录起始研究中的众多看似矛盾的结论作了统一,这些矛盾结论的产生可能是因为实验条件局限性和体系差异造成。工作回答了起始过程中众多核心问题,揭示了转录起始调控的机制,为理解基因表达调控奠定了结构基础。该项工作也开创了利用生化和结构生物学重构生物大分子机器动态过程,揭示其工作机制的新路径,为众多复杂过程的研究提供了新思路。
复旦大学生命科学学院青年研究员陈曦子、复旦大学生物医学研究院2019级直博生刘维达、青年研究员王茜敏以及粤港澳大湾区精准医学研究院博士后王鑫鑫为本文共同第一作者,复旦大学附属肿瘤医院研究员/生物医学研究院双聘研究员徐彦辉为通讯作者。
原文链接:
https://doi.org/10.1126/science.adi5120
专家点评

朱冰(中国科学院生物物理研究所研究员)
有一种爱是为了分离
——将刹那定格为永恒
转录,或者说mRNA的合成应该是地球上最重要的生物化学反应之一。Rober Roeder因发现三种真核生物RNA聚合酶获得了2003年的拉斯克奖;Roger Kornberg因解析RNA聚合酶II的结构促进了对mRNA合成机制的理解,获得了2006年的诺贝尔化学奖。然而,转录是一个非常复杂的过程,仍有很多未解之谜有待揭示。
随着冷冻电镜等结构生物学技术的发展,以复旦大学徐彦辉、德国马普所Patrick Cramer、日本东京大学Hitoshi Kurumizaka等为代表的一批科学家在近期取得了大量的重要进展,揭示了一系列转录相关重要事件的分子机制,其中包括转录预起始复合体的结构和动态组装机制、染色质模板对转录起始的调控机制、RNA聚合酶II的共转录磷酸化修饰调控机制等。在Science杂志刚刚发表的本项研究中,复旦大学徐彦辉组又解析了一个转录过程中十分重要的动态事件:从转录起始向转录延伸的过渡,这一事件也被称为启动子逃逸。
大学本科生物化学教科书在介绍RNA聚合酶II对启动子的识别时有一个著名的“尝试与错误”模型。该模型指的是基因组中其实有很多类似于启动子的序列,RNA聚合酶II是通过不断试错才能找到真正的启动子。这个模型的核心机制是RNA聚合酶II核心酶需要在众多通用转录因子的帮助下实现对启动子DNA序列的稳定结合,形成转录预起始复合体(也叫RNA聚合酶II全酶),实现转录起始。在这一过程中,众多通用转录因子的主要功能是使RNA聚合酶II与启动子DNA的结合能够稳定稳定再稳定。这马上就产生了一个悖论:转录预起始复合体的形成需要RNA聚合酶II对启动子DNA的稳定结合,然而稳定结合在启动子上显然不是RNA聚合酶II的最终目的,它只有最终能够离开启动子才能实现转录。
启动子逃逸是转录从起始到延伸的关键转折步骤,在这一过程中RNA聚合酶II的构象需要发生变化,在生成RNA产物的同时解离通用转录因子。那么这一过程究竟是怎样实现的呢?这是领域中一个长期未能解决的问题,原因也很简单,这是一个快速的动态事件。RNA聚合酶II延伸的速度一般被认为是每分钟几千个碱基,而启动子逃逸过程涉及的大约只有最初的20个左右的碱基的合成,也就是说需要在几秒钟内完成一系列的动态事件,这对于结构生物学研究是一个极大的挑战。
为了捕捉到这些瞬间发生的动态事件,将刹那定格为永恒,徐彦辉组设计了非常巧妙的实验。他们设计了一系列的转录模板,这些模板拥有同样的启动子和转录起始位点,差别是转录起始位点后面放上了不同长度的所谓G-less cassette。在利用含G-less cassette的模板进行体外转录时,他们用的NTP混合液中缺了GTP,因此当延伸到需要G的时候RNA聚合酶II就会被停滞住。利用这些不同长度的G-less cassette,他们就能够把RNA聚合酶II停在转录最初17个碱基时的任意一个碱基位置。
有了这样精妙的实验设计,他们成功捕捉了RNA聚合酶II在转录最初17个碱基时的每一个阶段性构象,像拍动画片一样用17幅图构成了一部电影。而这部电影揭开了启动子逃逸这一重要生物事件的神秘面纱。
最后,我想延伸一下点评。在后AlphaFold时代,结构生物学家常常被询问的是“如果AlphaFold已经能预测出结构了,你们做什么?”徐彦辉组的这个工作给出了一个漂亮的回答“做AlphaFold做不了的!”。科学不会因为工具而死亡,恰恰相反,更好的工具会促使科学家去挑战更高的科学问题。
专家点评

李兵(上海交通大学医学院教授)
令人泪奔的“小样”
很幸运听到过几个知名艺术家创作经典传唱的作品时,头几个简单但最富有灵魂音符和和弦,不复杂,不花哨,但感觉“这肯定能火吧”。
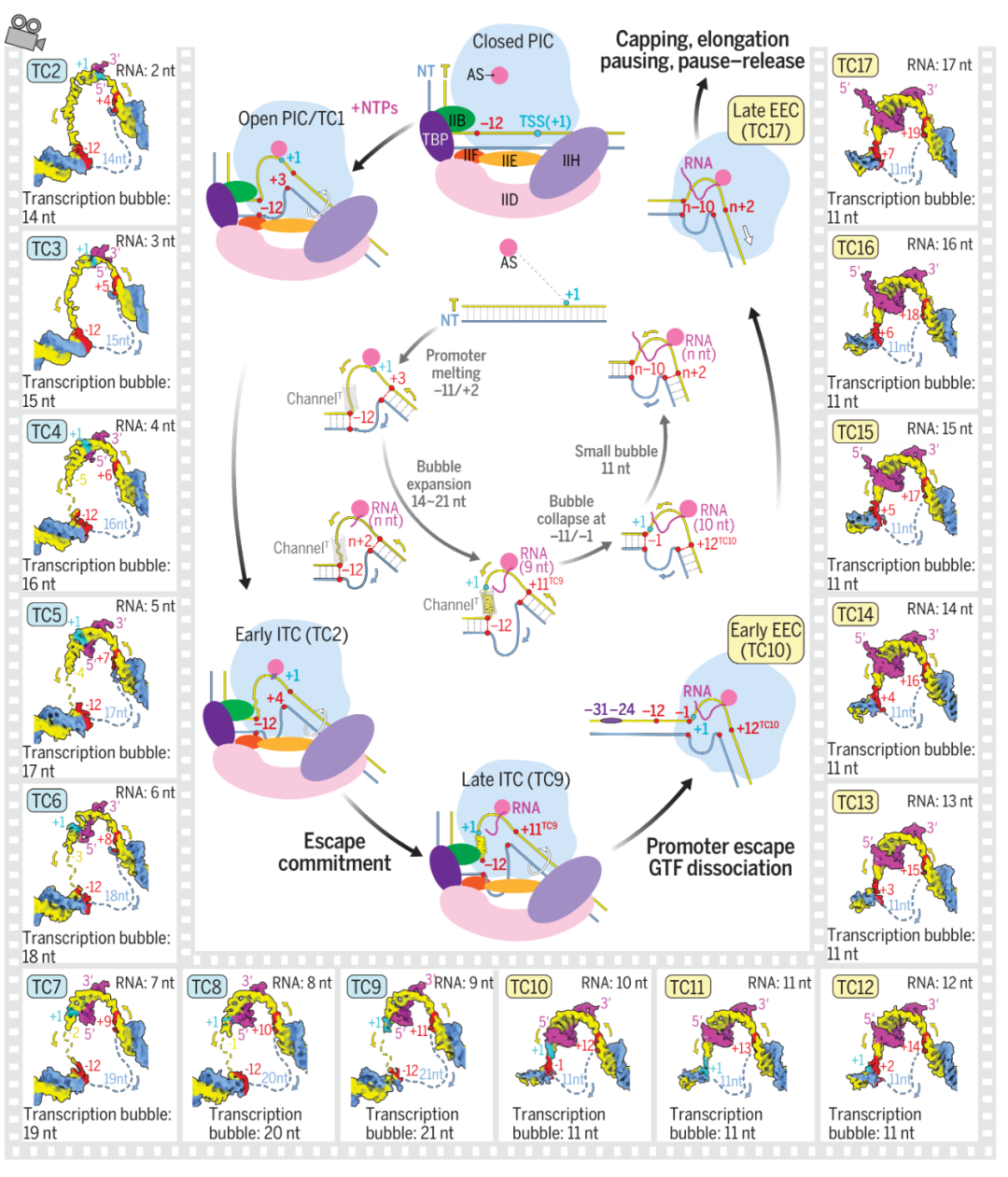
转录起始的连续动态模式图。来源:Science
徐导约我们去看个小样,当时一帧一帧的放出来,没有现在这个版本里精美的模式图。(广进按:用王勃写《滕王阁序》的故事中阎都督和女婿的反应比拟下面的场景)前几张TC2,3感觉很漂亮(“豫章故郡,洪都新府。星分翼轸,地接衡庐”——阎都督说不过是老生常谈);看到TC5-6时感觉“不会吧,不会这么简单吧”(“襟三江而带五湖,控蛮荆而引瓯越”——阎都督说这个好像我也能写);到了TC7,8时感觉好像已经呼吸急促(“物华天宝,龙光射牛斗之墟;人杰地灵,徐孺下陈蕃之榻”——阎都督和女婿意味深长的相互看了一眼不说话了)了;TC9到10,泪奔了(“落霞与孤鹜齐飞,秋水共长天一色”——阎都督和女婿坐不住了直接跑出去见证历史了)。瞬间忽然感觉自己好像也懂一点转录了。我当时对徐导就说了几个字,“我不懂哈,就是它了!(“关山难越,谁悲失路之人;萍水相逢,尽是他乡之客”——阎都督读到这句后,直呼“天才”)”。
Pol2很厉害,负责转录细胞里最重要的编码RNA,但又很笨,需要几百个蛋白把它拖到启动子上, 先形成个重要的碉堡,叫PIC(转录前起始复合物)。然后需要几个人把双螺旋模板拧开,把模板链放到Pol2嘴巴里,这时叫OC(开放复合物)。然后Pol2开始合成头几个核苷酸, 这状态叫ITC(初始转录复合物,也就是前面说的TC2-TC9)。ITC还不争气,经常合成几个核苷酸后会掉下去(流产转录,abortive transcription),来回几次后才终于有一次能顺利地冲出去,脱离PIC,变成EEC(早期延伸复合物),这以后的Pol2就可以撒开腿跑开了。这个过渡是转录过程最关键的限速步骤,领域的前辈们前赴后继,包括获2006年炸药奖的Roger Kornberg, 都期望能捕捉到这一美妙的时刻。几个小问题: 1)以前用的PIC里缺了一大块 (TFIID)估计应该有很重要的功能;2)大家多用部分不配对的DNA模板来模拟双链打开状态,或者再加上一个互补的RNA模拟RNA开始合成,所以虽然也有很多感人的片子拍出来,但对于非专家来说总觉得不太真实。Now, 徐导的团队通过巧妙的设计,利用DNA模板让Pol2酶每添加一个核苷酸就停下来,这样他们逐步将ITC-EEC的自然转化状态,以高清慢动作的方式记录了下来。TC9到10 恰恰捕捉到了Pol2作为酶和反应临界状态紧密结合后,利用前面DNA合成积攒的能量将Pol2弹出PIC的瞬间。影片精彩纷呈,不容错过!
抱歉剧透太多了,大家还是自己看吧,带手绢哈和字典。
复旦大学徐彦辉课题组招聘
徐彦辉,复旦大学附属肿瘤医院和生物医学研究院研究员。曾获新基石研究员项目、国家杰出青年科学基金、“长江学者”特聘教授、国家“万人计划”科技创新领军人才等人才项目,科学探索奖、谈家桢生命科学奖(创新奖)、中国优秀青年科技人才奖等荣誉。曾主持国家重点研发计划2项(项目负责人),国家自然科学基金重点项目4项等。课题组(http://xulab.fudan.edu.cn)长期从事基因表达调控的研究,围绕基因启动子区发生的转录起始复合物装配,染色质重塑和DNA甲基化调控,系统揭示了基因表达调控的分子机制,成果得到国内外同行高度评价。发表通讯作者论文40余篇,包括6篇Science,2篇Nature,1篇Cell,14篇Cell research,5篇 Nature Communications, 等。部分成果获得教育部“高等学校科学研究优秀成果奖自然科学一等奖”(第一完成人)、2021年度“中国生命科学十大进展”和中国2021医学重要进展。自2023年开始,实验室做了较大的研究方向调整,研究方向包括:
1. 转录调控-结构生物学方向:开展基于染色质环境的转录起始的机制研究,拓展研究方法,包括体外生化分析,利用测序技术表征转录起始过程,单分子生物物理方法研究转录起始的动态过程等。综合利用结构生物学、生物化学、生物物理等方法,系统的阐释转录起始这一极其复杂且重要的生物学过程。
2. 蛋白质抗体库-高通量单细胞测序方向:开展以蛋白质抗体库作为独特的研究工具,开发同时靶向多种蛋白质的测序新方法,在单细胞、发育、病理等层面解析生物大分子在细胞层面的复杂相互作用和功能,以指导深入的分子生物学研究,研究体系也可应用在基础研究和临床诊治等众多方面。
我们将投入最大的热情和耐力开展上述研究工作,期待不同学术背景,志同道合、热爱科研的人们与我们同行,我们将提供有竞争力的待遇!
招聘岗位:
副研究员(4名)、助理研究员(3名)、博士后和技术员若干名,常年招收研究生。
申请方式:
请申请人投递个人简介,我们承诺对申请材料保密。
简历投递(有意者请将个人简历等材料发至):
https://jinshuju.net/f/ZqXwZt或扫描二维码投递简历

制版人:十一
高颜值免费 SCI 在线绘图(点击图片直达)
往期精品(点击图片直达文字对应教程)























































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








