点击蓝字 关注我们
先进糖蛋白质组学揭示了糖基化修饰在男性生殖的生理和病理过程中的作用

综 述
● 原文链接DOI: https://doi.org/10.1002/imo2.10
●2024年7月1日,四川大学华西医院张勇和四川大学华西第二医院李福平团队在iMetaOmics在线发表了题为“Developing glycoproteomics reveals the role of posttranslational glycosylation in the physiological and pathological processes of male reproduction”的文章。
● 本研究总结了人类精液的糖蛋白组,目前对男性生殖系统及相关疾病中糖基化的认识,糖蛋白质组学方法的进展,以及最新糖蛋白质组学技术在男性生殖中的潜在应用。
● 第一作者:程庆元、罗盟錡
● 通讯作者:李福平(lfpsnake@scu.edu.cn)、张勇(nankai1989@foxmail.com)
● 合作作者:徐梓赫
● 主要单位:四川大学华西医院、四川大学华西第二医院、四川省人类精子库
亮 点
● 由于糖蛋白组学中的技术挑战,目前对男性生殖中的糖基化修饰理解有限;
● 本综述总结了当前男性生殖系统中糖基化修饰的进展以及先进糖蛋白组学在男性生殖研究中的潜在应用;
● 本综述提供了关于男性生殖疾病糖蛋白组学的全面概述。
摘 要
糖基化修饰在男性生殖的生理和病理过程中发挥着关键作用。它影响着成千上万的蛋白质,并在生殖的所有阶段,包括精子生成、成熟、获能和受精过程中,持续进行。尽管糖基化修饰的重要性不言而喻,但人们对男性生殖过程中的糖基化修饰理解仍然有限,这在很大程度上是由于在糖蛋白组学领域遇到的技术障碍。最近的进展已经实现了利用最新糖蛋白组学技术绘制人类精子和精浆糖蛋白组谱图。这一突破为深入研究糖基化修饰对男性生殖系统及相关疾病的影响奠定了基础。然而,这一领域仍面临许多挑战,需要在糖蛋白组学方法上进一步发展。为了追求这一目标,该综述仔细评估了先进糖蛋白组学技术在男性生殖研究中应用价值,综合分析了人类精液糖组和糖蛋白组的详细图谱,并总结了目前对糖基化修饰在男性生殖系统中作用的理解以及糖蛋白组学的最新进展。我们的目标是为生物学家提供对男性生殖糖蛋白组更深入、更准确的洞察。此外,这篇综述通过糖组学和糖蛋白组学的视角,汇集了关于异常糖基化与男性生殖障碍之间联系的重要发现。本综述的目的是促进糖相关生物标志物和靶点在治疗不育症的临床应用。
视频解读
Bilibili:https://www.bilibili.com/video/BV19H4y1F7pm/
Youtube:https://youtu.be/MwFi1AfBZzE
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/imetaomics/
全文解读
引 言
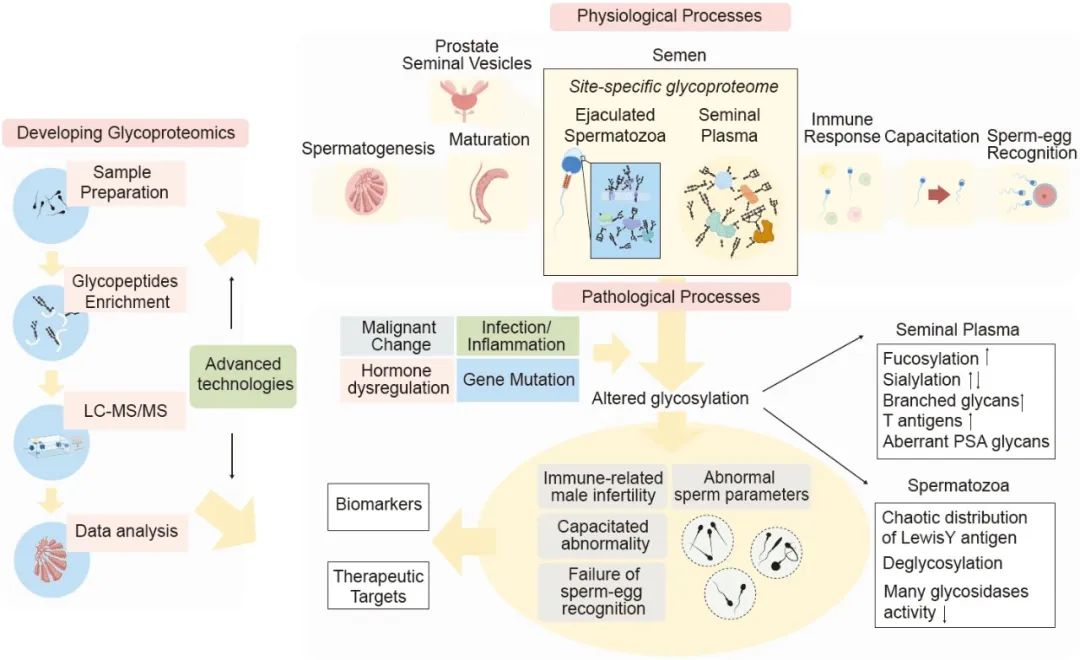
糖基化在男性生殖中起着重要作用,其过程复杂、动态、活跃,并在整个精子生成、成熟、与精液混合以及进入女性生殖道直至卵子受精的过程中受到调控。一个显著的特征是,人类精子表面覆盖着一层厚厚的糖萼,由数千种糖类和糖蛋白组成。精浆作为人体的一种特殊体液,富含此类碳水化合物。在过去的几十年中,已经鉴定出多种人类精子和精浆糖蛋白,功能特性研究表明它们在精子成熟、生物物理变化、免疫调节效应以及在女性生殖道中的精卵结合中发挥作用。在患有男性生殖障碍如不育症和前列腺癌的男性中发现糖基化异常,表明糖基化在男性生殖系统的生理和病理过程中起着深远的作用。
作为生物体中最丰富的翻译后修饰之一,糖基化是一种酶促生物过程,通过在脂质或蛋白质上组装和修改糖链来合成具有各种重要功能的糖脂和糖蛋白,如配体-受体相互作用、细胞分化和信号转导。此外,应当注意的是,蛋白质可以通过非酶促反应发生糖化作用,导致可能有害的终产物的形成,这在男性生殖系统中已被观察到。根据糖-蛋白连接方式,蛋白质糖基化可以分为两大类:N-糖基化和O-糖基化。N-糖基化是最常见和广泛的蛋白质糖基化类型之一,涉及将糖链共价连接到天冬酰胺残基上,分为三种类型:高甘露糖型、复杂型和杂合型N-糖链。O-糖基化也是结构高度复杂且丰富的,通过不同糖类连接到丝氨酸、苏氨酸或酪氨酸的羟基上,从而产生O-N-乙酰半乳糖胺(O-GalNAc)、O-N-乙酰葡萄糖胺(O-GlcNAc)、O-半乳糖、O-甘露糖、O-岩藻糖等。N-糖基化和许多类型的O-糖基化发生在内质网(ER)表面,随后进入ER和高尔基体进行后续加工和延伸。有些例外情况下,O-GlcNAc在细胞质和核中被报告,而O-GalNAc在早期高尔基体中被报告。糖基化是如此普遍,以至于至少一半的蛋白质和大多数分泌蛋白在人类中是糖基化的,这是一个高度复杂且分步进行的过程,由超过200种糖基转移酶和糖苷酶通过16种不同的糖基化途径协同作用,而不是依赖模板来产生核酸或蛋白质。值得注意的是,糖基化可能对男性生殖具有特殊意义。它不仅在精子生成期间频繁且活跃地发生,而且在精子成熟过程中也发生,在这一过程中,精子仍然经历深刻的生理变化,这些变化在很大程度上由于失去了原位合成蛋白质的能力而由翻译后修饰决定,因此需要深入研究。
到目前为止,糖基化在男性生殖中的结构和功能仍然不清楚。尽管它极其复杂并发挥累积作用,但大多数研究长期以来都集中在男性生殖细胞中的一种糖类或单一糖蛋白上。探测糖基化的传统方法依赖于糖类和蛋白质之间的特异性结合,如抗体或凝集素。近年来,随着组学技术的显著进步,已经鉴定并功能性地表征了男性生殖系统中多种糖类的组成和结构以及糖蛋白上的糖基化位点。人类精子和精液的糖组首次分别在2007年和2009年被绘制。几年后,人类精子和精液的大规模N-糖蛋白组逐渐被报道。然而,这些研究无法提供详细的糖链结构及其在糖蛋白中的确切糖基化位点,导致结构-功能相关性不清晰。最近,通过利用大规模和位点特异性糖蛋白组学方法克服了这一缺点。基于这些发展,可以认为,正常精子质量的男性的精子和精液N-糖蛋白组已被大致描述,为进一步研究它们与男性生殖疾病的关联奠定了坚实的基础。此外,糖蛋白组学不断发展,有潜力完善男性生殖糖蛋白组,鉴定复杂的O-糖基化,并解决被认为是最严重的全球公共卫生问题之一的主要男性生殖挑战。考虑到已有大量报告表明精子中的许多糖蛋白对男性生殖至关重要,并已经进行了详尽的回顾,我们从组学角度更新了男性生殖系统的糖类和糖蛋白质谱及其与男性生殖障碍的关系。我们还总结了在男性生殖中应用的糖蛋白组学技术及其最新进展。本综述旨在提供洞察,了解哪些有价值的数据和先进技术可用于促进男性生殖健康。
人类精液糖组和糖蛋白组学图谱
尽管近年来对男性生殖道蛋白质组进行了大量研究,但对应的糖蛋白质组研究仍处于初级阶段。早期关于人类精子和精浆中糖基化模式及糖蛋白的研究表明,在精子发生、成熟和受精过程中糖基化发生了变化。然而,这些研究仅关注了几种糖蛋白或糖链,并且缺乏每种糖蛋白特定位点的具体信息,这远远不足以进一步详细研究它们的功能,例如特定糖基位点上的每个糖链结构是如何影响特定糖蛋白的功能。最近,在研究精液糖蛋白质组方面取得了重大进展,实现了大规模糖蛋白的位点特异性N-糖基化鉴定和功能表征,为进一步深入研究这些糖蛋白在男性生殖的生理和病理过程中的作用奠定了基础。
精子糖组和糖蛋白组特征
迄今为止,在人类精子中已鉴定出1036种N-糖蛋白,包含1489个糖基化位点、719种不同的N-糖链结构和292种糖链组成。大部分糖基化位点被高甘露糖型N-糖链(36%)、复杂型N-糖链(29%)和三种不同类型N-糖链的组合(12%)占据。超过一半的糖蛋白仅含有1个糖基化位点,40%的糖蛋白含有2-10个位点,而少于1%的糖蛋白含有超过10个位点。人类精子中存在多种糖链结构。复杂糖链的高含量表明它们在精子中的重要作用,如精子生成。与早期人类精子糖组学研究相比,糖链结构的鉴定显示了相似的特征:高甘露糖型N-糖链、双触角切割型糖链和含有大量岩藻糖的复杂型N-糖链,以及以Lewisx和/或Lewisy序列结尾。精子糖组学分析揭示了4种核心结构和13种分支结构。此外,许多糖链组成由不同的异构体组成(最多区分出10种异构体)。将持续鉴定更多糖蛋白和细节,以提高对整个糖蛋白组的理解。通过基因本体(GO)富集分析进一步探索了鉴定出的糖蛋白的功能和途径,但仍不清楚。通常,这些基因涉及免疫功能和精子-卵子相互作用。值得注意的是,与蛋白质组相比,人类精子的糖蛋白组包含特定的糖蛋白,而人类精子的蛋白质组分析表明它们的主要功能是代谢。
人类精子的糖蛋白组学分析揭示了几个独特的特征。最显著的是,人类精子中检测到重度岩藻糖化(>50%),并且在某些糖基化位点上检测到多达10个岩藻糖。发现Clusterin高度岩藻糖化,表明其在女性生殖道中的免疫耐受和激活中的作用。其次,人类精子含有双触角切割型N-糖链和以Lewis抗原结尾的寡糖,这与抑制自然和适应性反应有关。此外,已在精子中鉴定出200多种独有的糖蛋白,而这些糖蛋白在人类其他组织或细胞中未发现。功能富集分析表明,这些糖蛋白涉及非常特定的与精子相关的生物过程,如精子-透明带结合、精子生成、精子-卵子识别和受精。途径分析揭示了顶体反应、精子-卵细胞膜结合和精子运动。先前的报告揭示,精子中的N-糖蛋白主要涉及细胞识别和受精,特别是配子相互作用。强调了糖胺聚糖降解和溶酶体途径。除了精子中的糖链组成和结构,还鉴定了人类精子不同位置的一些特定糖基化特征,包括整个精子、质膜、细胞外区域、顶体、内质网、溶酶体和高尔基体。超过90%的精子糖蛋白位于膜、细胞外区域和溶酶体。特别关注顶体区域,糖链可能参与激活和精子-卵子识别。与其他位置和整个精子的糖蛋白相比,顶体中表达更高的切割核心结构(有无核心岩藻糖化)。许多精子顶体中的糖蛋白,如顶体素,可能来自溶酶体,如精子糖蛋白组中的溶酶体膜N-糖蛋白1(LAMP1)和2(LAMP2)。然而,需要更清晰地阐明糖链结构的精确位置。此外,GalNAcβ1-4GlcNAc基序(也称为N,N'-二乙酰乳糖二胺,LacdiNAc)的特殊分支结构在顶体中的数量大于整个精子。LacdiNAc结构和切割核心结构可能有助于顶体的特殊功能。精子糖蛋白组还揭示了精子发育的信息。在成熟精子中鉴定出27种睾丸特异性糖蛋白。与人类附睾精子的蛋白质组相比,鉴定出14个重叠基因,这与附睾在精子糖基修饰中的关键作用一致。此外,精子糖蛋白组中的114个基因也在精液中检测到。尽管精子与来自前列腺和精囊的精液短暂接触,它们仍可能附着在精子表面并对男性生育力很重要,通过替换外来健康精液以改善精子参数已被证明。然而,它们的相互作用需要进一步阐明。
精浆糖组和糖蛋白组特征
近年来,通过多项研究建立了人类精浆中N-糖基化蛋白质组的图谱,共鉴定出816种糖蛋白,包含773种N-糖链结构、317种N-糖链组成和1,019个N-糖基化位点。大多数糖基化位点由复杂型N-糖链占据(45%),其次是高甘露糖型N-糖链(18%)以及杂合型和复杂型N-糖链的组合(15%)。约70%的糖蛋白只含有一个糖基化位点,含有超过5个糖基化位点的糖蛋白占5%,最多的是在吸引素中发现的11个糖基化位点,这些糖基化位点已被证明与男性生殖有关。精浆中的主要糖链结构与精子中的糖链相似。复杂型糖链对糖蛋白的分泌至关重要,高甘露糖型糖链参与免疫调节作用。同样,这些精浆中的糖蛋白的功能和途径通过生物信息学分析进行了探索。功能富集分析的结果在几项研究中有所不同,这是由于鉴定出的糖蛋白数量不同。例如,在生物过程(BP)中,最显著富集的术语是生物粘附,其次是细胞外基质组织。总的来说,可以得出结论,大多数已鉴定的糖蛋白在应对刺激、免疫、粘附、运动性和趋化性方面发挥作用。与人类精浆蛋白质组的功能富集分析相比,存在显著差异。
尽管精浆糖组学个体间的变异性很高,但发现精浆糖蛋白中存在重度岩藻糖化(每个糖链中岩藻糖残基≥6个),类似于人类精子。在健康男性的精浆中检测到1个糖链中最多有9个岩藻糖残基。大多数精浆糖蛋白,如纤维连接蛋白、糖蛋白S和前列腺特异性抗原(PSA),报告了核心和触角岩藻糖化。精子与岩藻糖残基的触角的相互作用,尤其是Lewisx型的作用,比与糖链核心位于的蛋白的相互作用更为重要。clusterin和galectin-3结合蛋白的重度岩藻糖化表明这些糖蛋白可能参与免疫反应。然而,没有重度岩藻糖化的糖蛋白的功能富集分析也揭示了免疫反应的生物过程,这证明了精浆中糖蛋白的复杂性和异质性。最近的一项研究显示,精浆中60%的糖链结构被唾液酸化,这与之前大约30%的报告不同。唾液酸和岩藻糖可能对免疫反应产生协同效应。值得注意的是,大约一半的糖蛋白是分泌蛋白。然而,精浆中糖链和糖蛋白来源于附属性腺的研究相对较少。通过与人类精浆中的蛋白质标志物的糖蛋白组进行比较,鉴定出11种糖蛋白为附睾来源的糖蛋白,以及10种、4种和3种分别为睾丸、精囊和前列腺来源的糖蛋白。附属性腺的完整和更准确的糖蛋白组仍有待建立。
精液O-糖蛋白组图谱
与N-糖基化相比,O-糖基化的高复杂性带来了非常大的技术挑战。尽管近年来已经探索了人类精液中的O-糖链和O-糖蛋白,但我们团队利用一种名为基于两种互补碎裂方法的糖蛋白组学(GlycoTCFM)的新策略,生成了首个具有位点特异性信息的O-糖蛋白组图谱。发现了包含371个完整O-糖肽和202个O-糖基位点的68个O-糖蛋白,其中30个和25个分别在精子和精浆中特异性鉴定。与N-糖蛋白不同,有13个O-糖蛋白重叠。34个O-糖蛋白拥有一个O-糖基位点,其他的拥有两个或更多O-糖基位点。对于O-糖链,141个O-糖基位点包含一个,61个包含多个。功能富集分析揭示了O-糖蛋白在细胞粘附和血管生成中的作用。值得注意的是,两个丰富且复杂的O-糖蛋白(精液凝胶蛋白-1和精液凝胶蛋白-2),由精囊产生,以及一个O-糖蛋白(赤道蛋白)位于精子的顶体膜上,均高度O-糖基化,具有20多个O-糖基位点。建立的人类精液O-糖蛋白组图谱为O-糖蛋白组学技术的发展和了解男性生育能力与不育症中的O-糖基化奠定了基础。
精子和精浆糖组及糖蛋白组的共性与特异性
人类精液中精子和精浆的糖蛋白组学研究通常由同一团队进行,然后将二者进行比较。通常,糖蛋白的组成高度重叠。首先,糖组学分析揭示了包括富含Lewisx和/或Lewisy序列的丰富糖链在内的显著相似性。W型、平分型N-糖链在精浆中的丰度明显低于精子。个体之间,精子和精浆中的岩藻糖化和唾液酸化糖链水平差异巨大。进一步的糖蛋白组学分析揭示,人类精浆和精子中有383种糖蛋白和499种糖链结构重叠。然而,大约一半的糖链结构要么只在精子中识别,要么只在精浆中识别。即使是它们之间共有的糖蛋白,其特定结构也不同。与精子相比,精浆拥有更复杂的糖链结构。此外,精浆中以岩藻糖化核心结构为主,而不是精子中的常见核心结构。与糖组学结果一致,精浆中平分型核心结构的表达与精子相比大大减少。然而,复杂的岩藻糖化和唾液酸化分支结构在精浆中更为常见。相比之下,如高甘露糖和LacdiNAc这样的简单分支结构存在精子中更常见。上述差异可能具有生物学意义(图1)。

图 1. 人类精子在整个生命周期中高度活跃、复杂、时空调控的糖基化概览
在精子发生过程中,N-糖基和O-糖基都在积极合成。在精子分化的每个阶段,糖基化都有显著变化。糖基化在精子成熟期间继续进行,并由各种糖基修饰酶协同调控。此外,精子通过附睾体小泡获得糖蛋白。射出的精子可以从精液中捕获大量的胞外囊泡(EVs),这些囊泡含有前列腺和精囊分泌的糖蛋白。对射出的精子和精浆糖蛋白组进行了分析。这些蛋白对于精子在女性生殖道中的存活和精卵识别非常重要。
人类精子糖蛋白组的鉴定揭示了与身体其他细胞类型相比的许多独特特征。值得注意的是,除了精子外,其他人体组织未检测到重度岩藻糖化。例如,在肝脏中发现的clusterin上最多有4个岩藻糖,而在小鼠组织中未在clusterin上发现岩藻糖。有趣的是,在癌细胞和再生组织中检测到了岩藻糖化的改变。例如,前列腺癌细胞表达水平升高的岩藻糖化糖蛋白,可能是由于岩藻糖转移酶和岩藻糖酶水平的变化。在新生小鼠心脏中,核心岩藻糖化的增加与再生能力的减少相关。需要研究精子糖蛋白组的这些独特特征及其与增殖能力有无关系。
同样,精浆糖蛋白组的鉴定揭示了与其他体液相比的许多独特特征。与精浆不同,其他体液中未发现重度岩藻糖化。例如,血清中的clusterin上每个糖链只有一个岩藻糖。此外,人类糖基化中最不寻常的方面之一是与所有主要类型的糖结合物相关的终端Lewisx/Lewisy型序列的非常高表达。特别是,几乎在其他人类细胞类型或分泌产品中检测不到Lewisy序列。在人类血清中,一半的N-糖基位点至少被两个糖修饰,这比在精浆中观察到的要多。此外,血清中的唾液酸化程度大于精浆中。在人类尿液中,大多数糖肽是由唾液酸和岩藻糖组成的复杂或混合糖,这些糖肽与血清中的相似。令人惊讶的是,精浆中鉴定出的糖蛋白约有800种,超过了血清和尿液,尽管这些信息是从全身获得的。精浆糖蛋白组的报告指出了其丰富性,并反映了其特定功能的独特来源。
精子发生、成熟和获能过程中糖组和糖蛋白组特征
人类精子的发生、成熟和获能都伴随着糖基化的持续变化(图1)。科学家们研究了这一现象多年,并试图在这一过程中时空地确定糖基化特征。通过经典的凝集素结合测定,首次建立了人类睾丸内精原细胞和精液精子的糖基化模式。在分化过程中,精原细胞特异性地与凝集素反应。精液精子对所有20种凝集素都显示出反应性,但可以根据头部区域的结合位点进一步分组。同样,基于凝集素结合的策略已应用于检测小鼠、猫和狗的睾丸、附睾和精液精子。
基于凝集素的测定表明,在精子发生过程中糖含量发生了显著变化。进一步的研究揭示,与杂合型或寡甘露糖N-糖基化的糖蛋白相比,复杂型N-糖基化是精子发育所必需的。无论是核心1还是核心2的O-GalNAc糖基化,还是O-岩藻糖糖基化都不是这一过程所必需的。与睾丸中的精子发生相比,精子成熟和获能过程中糖组学特征的变化受到了更多关注,研究集中在糖蛋白的唾液酸化上。许多早期研究通过调查表面电荷或凝集素结合特性,揭示了许多哺乳动物附睾中糖基化模式的变化。肽N-糖基化酶F(PNGase F)和液相色谱串联质谱(LC-MS/MS)被用来探索大鼠附睾过渡期间N-连接的唾液酸化糖肽的变化。从65种不同的糖蛋白中鉴定出92种独特的N-连接的唾液酸化糖肽,并在头部、体部和尾部的精子中检测到与成熟相关的N-连接的唾液酸化糖蛋白的重塑。对于精子获能和顶体反应,唾液酸化的单糖被发现是必需的。一些唾液酸化的单糖在获能过程中从精子表面脱落,并受到唾液酸酶的控制。这些基因表达的减少可能与一些男性的特发性不育有关。同样,使用公猪精子的研究检测到在获能和顶体反应期间N-乙酰葡萄糖胺、唾液酸、甘露糖和岩藻糖残基分布的变化。对精子发生、成熟和获能的更精确的糖蛋白组学需要进一步研究。
男性生殖中糖组和糖蛋白组形成与修饰关键酶特征概述
糖基化在精子发生、成熟和获能过程中持续进行,对于发育成功能完善的精子并与卵梓受精至关重要。上述过程的完成是由男性生殖系统中存在的各种糖基修饰酶的累积效应所致,这些酶也储存在精子中,并直接参与受精。糖基化修饰酶在精子生产的不同阶段表现出独特的表达模式,表明它们在空间和时间上具有特定的调节作用。例如,发现β-D-半乳糖苷酶在精母细胞、圆形精子细胞、头部和尾部精子中的含量有所不同。此外,在睾丸精子和精子质膜中也检测到了岩藻糖苷酶和甘露糖苷酶。尽管这些酶在男性生殖中扮演着不可或缺的角色,但只有少数研究揭示了它们的数量和功能。
参与男性生殖的糖基修饰酶可以分为两大类,即糖基转移酶(合成性)和糖苷酶(水解性),它们共同作用于形成和修改精子糖萼。大多数糖基修饰酶也是N-糖蛋白,包含多个高甘露糖、复杂型,可能还有杂合型的糖链。
在精子发生期间,负责合成糖链、糖蛋白和糖脂的糖基修饰酶主要存在于未成熟精子细胞的内质网和高尔基体中。这些酶包括100多种类型,并在不同的时期和不同的位置表现出独特的表达模式。例如,α-甘露糖苷酶II是一种参与N-糖链合成的酶,在除了精原细胞和凝缩精子细胞之外的所有生殖细胞中都有丰富的表达。这个基因在小鼠中的缺失会导致不育,导致睾丸变小和精子不成熟,如多核细胞。GalNAc转移酶在精子和精母细胞的高尔基体中表达,以合成O-GalNAc糖链。这个基因的敲除会减少顶体的形成并在精子发生过程中增加细胞凋亡。β-1,4-半乳糖基转移酶家族在糖基化过程中执行β-1,4-半乳糖基化。这些基因的表达在睾丸发育和精子发生分化的不同阶段显著变化,表明睾丸糖蛋白的半乳糖基化差异。此外,睾丸中糖脂的岩藻糖基化与通过使用α1,2-岩藻糖基转移酶的精子发生有关,这需要FUT1或FUT2基因的表达。
当精子离开曲细精管并通过附睾转运时,附睾腔液中的糖基修饰酶主导精子糖基化,利用自由糖供体底物和携带糖链的细胞外囊泡(EVs)。例如,β-D-半乳糖苷酶修改精子表面的末端半乳糖基。此外,如岩藻糖基转移酶和唾液酸转移酶等糖基修饰酶在附睾腔液中与成熟过程中的精子结合。例如,在大鼠附睾头区域的活性大于尾区域。然而,唾液酸化显然是在精子转运过程中发生的。
许多糖苷酶,也称为糖水解酶,如半乳糖苷酶、岩藻糖苷酶、甘露糖苷酶和氨基葡萄糖苷酶,在精液中富含并显示高特异性。在人类精液中检测到显著更高的岩藻糖基转移酶III活性,这与高岩藻糖基化一致。根据人类精液的糖蛋白质组学,鉴定出10种糖基转移酶和10种糖苷酶。上述酶共同构成了男性生殖系统中一个高度特异、复杂和动态的酶谱,我们对这个酶谱的理解还远远不够。糖基修饰酶谱也是男性生殖糖蛋白质组的重要组成部分。
精液外泌体中的糖基化重要功能
精子的睾丸后糖基化是由附睾液中的细胞外糖基化修饰酶调节的。此外,男性生殖道外泌体(EVs)在这一过程中也被认为有重要作用。EVs是包裹各种分子的小型膜结合颗粒。它们在精液中高度丰富和多样化,并参与精子发育的每一个时期,而它们在睾丸后修饰中的作用引起了极大的兴趣。精液EVs来源于附睾、输精管和其他辅助性腺体,特别是前列腺。这些腺体通过释放EVs到男性生殖道来发挥它们的功能。随后,EVs与精子膜融合,传递如核酸、脂质、蛋白质和糖类等对精子成熟所需的物质,或者留在液体中,介导精子与女性生殖道复杂环境的接触。
EVs含有各种蛋白质,传递特定的糖基表位,并携带糖类,无论是在它们的表面还是作为货物。由于人类精子在离开曲细精管后失去了原位合成糖类和糖蛋白的能力,睾丸后糖基化在很大程度上由EVs介导。已知由附睾上皮细胞分泌的膜性囊泡——附睾小体,在附睾过渡期间将蛋白质转移到精子的特定区域。许多这些蛋白质是众所周知的糖蛋白,影响男性生育能力,如参与卵泡透明带结合的P25b;PH-20,在精子成熟期间重新定位;以及在远端体和尾部区域表达的HE5/CD52。CD44可能是公猪精液中附睾体的一个可能标记。因此,EVs中糖蛋白的异常表达可能导致男性不育。对精液外泌体的蛋白质组学研究发现,精子活力不足的男性中过表达的糖蛋白素,导致了正常的获能过程。除了EVs中包裹的糖蛋白外,精液EVs的糖基化模式可能参与它们与生殖道免疫细胞之间的相互作用。在健康男性的精液中提取的EVs中发现了常见的N-和O-糖基化物种。此外,EVs显示出与上清液不同的糖基化特征,包括增加的sia-α-2,6-Gal和N-糖类水平,以及树突状细胞特异性细胞间黏附分子-3抓取非整合素(DC-SIGN)和唾液酸结合免疫球蛋白样凝集素-9(Siglec-9)对它们的凝集素配体的亲和力增加。在不同的生理和病理条件下,精液EVs糖基化可能发生异常变化。例如,在正常精子和少精子症男性的前列腺体中,表面N-糖类具有唾液酸化和甘露糖化部分,这些部分构成了囊泡外层,显示出轻微的差异,而整合膜蛋白的重新分布显示出更大的差异,如由四跨膜蛋白和半乳糖凝集素-3组装所揭示的。这些分子可能共同建立了前列腺体的糖基化模式。由于前列腺体是精液中EV组成的主要贡献者,并且对精子运动性、免疫抑制活性和顶体反应性具有有益影响,因此应强调它们作为生物标志物的潜力。显然,糖类和糖蛋白贡献于精液EV组成,并在男性生殖系统中发挥重要作用。然而,关于它们的糖蛋白质组图谱和可能的生物学功能知之甚少。蛋白质组学分析揭示人类前列腺体中有1,282种蛋白质,而在小鼠附睾体中总共有1,640种蛋白质,为进一步专注于糖蛋白质组学的研究提供了坚实的基础。
精液糖组和糖蛋白组对男性生殖健康的影响
鉴于糖蛋白在男性生殖中的不可或缺作用,一些男性生殖疾病与变化的糖蛋白组有关。尽管最近已经建立了健康男性精液的特定位点糖蛋白组,但精准的糖蛋白组学尚未应用于患有生殖疾病的男性。目前,这些方法受到低丰度糖蛋白或多糖的限制。基于凝集素的方法无法准确反映寡糖的结构。它可能绑定较不特异但丰富的结构,也可能不绑定位于糖蛋白结构内部的多糖。尽管如此,糖组学或结合质谱(MS)的凝集素结合测定策略在男性生殖健康领域提供了大量信息,其中大部分集中在精浆。这些研究虽然不完美,但使我们能够总结病理状态下精液糖组和糖蛋白组的改变轮廓。在当前的综述中,我们从糖组学和糖蛋白组学的角度讨论这些问题。我们得出结论,不育男性观察到改变的人类精液糖蛋白组,并在一些男性不育病例中发挥作用,特别是与免疫相关和生育缺陷有关,并为无法解释的男性不育提供了线索。尽管关于不育男性精液糖蛋白组学的研究仍然稀少,并且大多数使用精浆进行,但聚焦于糖蛋白组的研究突显了其在男性不育中的作用,并为其诊断和治疗提供了线索。应该注意的是,糖组学可能揭示有关免疫反应的信息,而糖类和蛋白质的结合产生了更复杂的功能;也就是说,糖组学和糖蛋白组学可能分别提供信息并相互补充。
精液糖组和糖蛋白质组变化导致男性不育的潜在机制
近年来,男性不育症的发病率有所增加。男性不育症的病因复杂且大部分未知,这可能归因于糖基化异常(图2)。人类精子的糖基化生理作用受到越来越多的关注,但关注异常糖基化模式的研究却很少。已证明,精子上糖蛋白的糖链去除或异常会导致不育。此外,与正常精子相比,有缺陷的精子表面Lewisy表达的分布混乱,而正常精子则具有N-糖链的有序分布。此外,少精子症患者的精子中某些凝集素结合位点减少,这表明在不育过程中精子膜发生了分子重排。值得注意的是,与精子研究相比,已经进行了关于糖基化与男性不育之间的相关性研究,这些研究是针对精浆。精浆长期被认为只是精子的载体和加油站。近年来,人们重新考虑了其作用,认为它更为重要,并且可以为男性不育症和附属性腺功能障碍的诊断和治疗提供有价值的信息。精浆的功能在很大程度上依赖于其含有的丰富且独特的糖蛋白。发现精浆糖链通过在免疫调节中发挥重要作用以及防止精子过早的顶体反应,从而影响男性生育潜力。当精子进入女性生殖道后,它们必须避免在阴道中的免疫细胞的攻击,因为它们被母体免疫系统识别为自体移植物。其潜在机制尚不清楚;尽管如此,普遍接受的观点是精浆糖链作为免疫调节物质发挥重要作用,这与“人类胚胎防御系统”假说相符。精浆中糖链调节免疫耐受的机制与其他人体液体中罕见的几种独特的糖基化特征有关。精浆中独特的糖蛋白富含与免疫相关的糖表位,这些糖表位可能作为内源性凝集素的配体存在于免疫细胞表面。这些糖链包括Lewisx和Lewisy抗原、双切GlcNAc、末端唾液酸化和高甘露糖型序列。最近,一些截短的O-糖链,包括Thomsen-Friedenreich(T)和Thomsen-nouveau(Tn)抗原及其唾液酸化版本(sT和sTn),也被证明具有免疫调节作用。除了免疫调节作用外,精浆中的高度特异性糖链还有助于在母体环境中维持精子的生育能力。一个典型的例子是糖蛋白素,它在精子顶体反应和精子-卵子结合中发挥关键作用。同样,精浆中某些糖链水平的变化可能与精子表面相互作用,干扰正常的受精过程。
首先,早期研究使用凝集素识别糖蛋白糖基部分并结合MS,着重研究了不育男性精液浆中的一些独特糖基化模式。假设不育男性中N-糖链的含量减少。由于人类精浆的高岩藻糖化是一个显著特征,详细分析揭示了不育/亚育男性精浆中岩藻糖化糖肽的含量更高。岩藻糖作为Lewis型抗原,介导精子-透明带结合,体外添加含岩藻糖的糖链会抑制它们的结合。因此,糖链的过度岩藻糖化可能会扰乱它们之间的相互作用,影响男性生育能力。这些岩藻糖化糖肽进一步被证实存在于许多典型的精浆糖蛋白中,如前列腺特异性抗原、α-酸性糖蛋白(AGP)、糖蛋白素和纤维连接蛋白。然而,这项研究无法确定哪种蛋白质负责观察到的岩藻糖化增加,这可能作为不育男性精浆中潜在的生物标志物。实际上,总岩藻糖含量的增加可能与携带岩藻糖的糖蛋白表达增加或岩藻糖化途径本身的加强有关,这与蛋白质合成无关,但与酶活性相关。一个独立于糖蛋白的糖链的例子是在生育能力正常和不育男性之间比较PSA糖基化发现的。如上述研究所示,男性不育与糖链变化同时发生,而生育能力正常和不育男性之间的PSA糖基化没有差异。此外,糖蛋白可能以多种糖型存在,其中不同的异构体共享相同的蛋白质但不是糖链结构。例如,糖蛋白素是生殖中最重要的糖蛋白之一;它有4个糖基化位点,但每个糖型都有特定的功能,以至于蛋白质上的糖链结构决定了其功能。这一发现验证了这些蛋白质参与受精事件的涉及。此外,已经证明,不仅蛋白质表达,而且表面糖链可能至关重要。除了岩藻糖化外,精浆蛋白中高甘露糖和混合型寡糖的展示也受到了很多关注,并且在少精子症患者中发现显著减少。此外,鉴定了17种糖蛋白,这些糖蛋白中1/3的寡糖表达末端甘露糖残基。值得注意的是,精子正常但不育的患者中高甘露糖和杂合型糖链的水平也低于生育能力正常的男性,这可能与过早顶体反应有关。此外,对生育能力正常和不育男性精浆中末端唾液酸化和Lewisx及Lewisy糖抗原表达的详细分析揭示,许多携带这些免疫调节表位的糖蛋白至少在某些不育患者群体中发生了变化。这些装饰可能对受精过程中的碳水化合物-蛋白质交流至关重要。
随后,使用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)分析比较了生育能力正常对照组和少精子症、弱精子症和少弱精子症不育患者的糖组学。总体而言,在所有分析的样本中鉴定了86种N-糖链,发现精浆中存在高甘露糖和低唾液酸终止,与先前的报告一致。与不育组相比,生育能力正常对照组的唾液酸化显著减少,岩藻糖化更大。然而,在将生育能力正常对照组与精子参数正常的不育组进行比较时,高度分枝的糖链和唾液酸化的寡糖显著升高。
近年来,与精浆糖基化模式分析相关的研究主要集中在含岩藻糖和唾液酸的糖表位上。然而,这些末端糖表位可以存在于N-糖链和O-糖链上。近年来的研究主要关注N-糖组,因为其技术可获取性。然而,这种方法忽略了包括T和唾液酸化T/Tn抗原在内的重要截短O-糖链类别,尽管它们也被认为具有免疫调节作用。早期研究报告称,与精子正常组相比,弱精子症组中Sambucus nigra凝集素(SNA)-反应性唾液酸的表达显著不同。还分析了粘液型糖基化,表明与O-连结的Lewis型抗原有潜在的DC-SIGN凝集素反应性。此外,最近通过使用凝集素研究了精浆糖蛋白中的T/Tn抗原及相关结构。这项研究证实,与对照组相比,不育患者某些糖蛋白中T抗原优于Tn抗原。也鉴定了乳铁蛋白、催乳素可诱导蛋白、纤维连接蛋白和精液凝胶蛋白1和2作为带有Gal或GalNAc残基终止的糖链的蛋白。此外,鉴定的糖蛋白被认为参与免疫过程,表明它们可能在调节女性生殖道的免疫反应中发挥作用。

图 2. 与男性生殖障碍相关的男性生殖糖基化改变的病理机制
精子中糖基化的重新分布、脱糖作用以及糖基修饰酶的减少可能导致不育。此外,精液中发现了升高的岩藻糖化和唾液酸化以及特定糖基的变化。这种改变的潜在机制包括基因突变、激素失调、感染或炎症以及癌变,这些因素共同影响了精子发生、成熟以及附属性腺功能的糖基化,最终导致精子活力减弱、少精子症和性腺疾病如前列腺癌。
男性生殖系统中精液糖蛋白组改变的发病机制
上述研究证实了不育男性精浆中糖组学改变的存在。然而,这种改变背后的原因仍然不明确,被认为是男性生殖系统功能障碍的累积结果(图2)。以下列出了一些可能导致精液糖蛋白组恶化的潜在机制。
遗传性疾病
与导致单一糖蛋白异常的单基因突变不同,编码糖链修饰酶的基因突变会影响整个糖基化模式,破坏糖链的合成以及糖链的过度/低度糖基化。近年来,通过在小鼠中敲除相应基因,确定了与糖基化相关酶对精子生成的影响。对精子发育至关重要的最显著的N-糖链修饰酶包括由Man2a2编码的α-甘露糖苷酶IIx,该酶是修剪N-糖链中甘露糖的酶之一,与精子糖蛋白上高占有率的高甘露糖型N-糖链一致。然而,其他α-甘露糖苷酶II的缺失则无影响。此外,GlcNAc转移酶MGAT1(α1,3-甘露糖基-糖蛋白2-β-N-乙酰葡萄糖胺转移酶)和MGAT2(尿苷二磷酸,UDP-N-乙酰葡萄糖胺:α-6-D-甘露糖苷β1,2-N-乙酰-葡萄糖胺转移酶II)对于精子生成是必不可少的。与修饰N-糖链的酶相比,O-糖链的缺失,如在高尔基体中合成核心1和2 O-GalNAc糖链的一些糖基转移酶似乎不那么重要。然而,另一个GalNAc转移酶家族,名为GALNT,在顶体形成中导致精子生成障碍,导致畸形的圆头精子。同样,岩藻糖基化相关基因的过度激活可能导致重度岩藻糖基化,从而损害男性生育能力。
激素功能障碍
男性生殖系统中的许多糖蛋白是雄激素调节的蛋白质,特别是糖基修饰酶。抗雄激素疗法后,岩藻糖转移酶的活性显著降低,表明其表达与性激素相关。此外,精子中的α-半乳糖苷酶和β-半乳糖苷酶的活性与血清中促性腺激素的存在密切相关,无论是在生育能力正常的男性还是少精子症、畸形精子症、运动能力差精子症(OAT)患者中。除了调节糖蛋白的合成和修饰外,许多生殖激素本身是糖蛋白或由糖蛋白调节。人类绒毛膜促性腺激素(hCG)是在男性生殖道中高度存在的糖蛋白。精浆中hCG的替代糖基化谱在异常精子参数的患者中可能表明其在精子生成中的病理生理作用。性激素结合球蛋白携带雄激素和雌激素,在睾丸中表达,并参与精子生成过程中的顶体形成。性激素结合球蛋白的多态性已显示影响其血清水平,并与男性不育相关。
氧化应激和环境影响
糖链结构本身以及合成的酶对氧化应激敏感是合理的。例如,群集素是已知的氧化应激生物标志物。因此,不平衡的氧化还原环境可能导致糖基化改变。此外,最近的一项研究表明,暴露于环境污染物可能导致精浆N-糖链的改变。在那项研究中,与环境污染物暴露显著相关的10种N-糖链都是复杂结构,包括饮酒、吸烟、农药、空气污染和复印。众所周知,环境污染物改变糖基化。例如,在肺癌患者中,血清蛋白的N-糖基化改变与吸烟有关。其中一个潜在机制可能是许多污染物是内分泌干扰物,它们扰乱性激素,这对糖链相关酶有重大影响。上述发现扩展了我们对环境因素影响男性生殖的机制的理解,并揭示了男性不育的特定生物标志物。
过度糖化的可能影响
此外,糖化是糖和蛋白质之间的非酶反应,产生糖化终产物,已在人类精子和精浆中发现。糖化与糖基化不同,被认为是有害的。然而,糖化对男性不育的影响仍不清楚。一项体外研究调查了糖化对精子功能的影响,显示糖化终产物可以在整个精子细胞中形成,尤其是在头部区域。尽管对精子运动能力或透明质酸酶活性没有可观察到的损害,糖化增加了氧化DNA的水平,这与肥胖和糖尿病患者的男性不育有关。此外,过度糖化是否干扰糖蛋白的功能还需要进一步研究。
男性生殖器官感染
此外,男性生殖系统的传染性疾病被认为会导致糖基化模式的改变,并被认为是损害男性生育潜力的重要因素。泌尿道大肠杆菌感染导致小鼠附睾精子和上皮细胞的低唾液酸化。在附睾炎患者中,他们的精子也显示出较低水平的唾液酸化。内源性唾液酸酶的激活可能是此效应的原因。因此,这种病理性去唾液酸化对精子的抗吞噬作用和补体系统有不利影响。可以推断,其他与附睾相关的疾病也可能触发类似影响,损害精子的糖基化模式,这值得进一步调查。此外,几份报告展示了白细胞精液症患者的糖组发生变化,并报告了类似结果,显示糖基化减少,表明受损。在患有不育症的白细胞精液症男性中,两种糖蛋白,纤维蛋白和α(1)-酸性糖蛋白的岩藻糖基化和唾液酸化发生了改变。此外,在白细胞精液症患者中发现人类精浆免疫球蛋白G和A分泌成分的岩藻糖基化较低。免疫球蛋白A分泌成分的唾液酸化也在正常精子和白细胞精液症精浆中发现不同。应强调糖基化作为精浆中指示男性附属腺炎症的生物标志物的潜力。
精液糖基化作为男性不育的潜在生物标志物和治疗靶点
特定的精浆糖类、糖基化模式和糖蛋白的存在有可能成为男性不育,特别是目前精液分析无法指示的特发性不育的新型生物标志物。特别应强调在受精和怀孕期间促进女性生殖器官免疫特权的免疫调节作用。许多糖蛋白已被用作生物标志物。男性不育的潜在生物标志物(纤维连接蛋白(FN)、前列腺酸性磷酸酶(PAP)、β2-微球蛋白、催乳素可诱导蛋白(PIP)和半乳凝蛋白3结合蛋白)是糖基化的。在一项早期研究中,通过刀豆A琼脂糖从正常精子、少精子和无精子症男性的混合精液样本中分离出糖蛋白。这些作者建议,氨肽酶N、乳铁蛋白、PAP、Zn-a2糖蛋白、PSA、糖蛋白、Izumo精卵融合蛋白和PIP是不育男性中差异表达的蛋白质。然而,这些糖蛋白是基于它们的蛋白特性而非糖基化特性被选为生物标志物的,到目前为止还没有用于检测人类精液中受损糖基化模式的诊断策略。最近,考虑到簇蛋白寡糖化的变化可能是男性生育障碍的潜在生物标志物。研究报告显示,特定的精浆N-糖类峰与精子质量参数(包括DNA断裂和染色质成熟度)之间存在显著关联,尽管这种关联可能增加或减少。应该注意,基于异常糖基化的诊断缺乏临床价值,因为它仅用于区分弱精子症患者和正常精子症患者。在某些情况下,尽管在精子参数异常的患者中发现了改变的糖基化,但它是次要原因,不育男性中常见多种异常。因此,应专门关注正常精子症不育男性。此外,这些疾病可能不是生育的主要原因,但可能是值得考虑的机制。另外,育龄和不育男性精浆中的糖基化改变在整个糖组和选定糖蛋白的单一糖基化之间并不显著。精浆或精子的糖组学显示出相当大的个体间变异。考虑到质谱(MS)方法的相对高成本,使用凝集素结合测定仍然是筛查不育男性糖基化模式改变的可行策略。
前列腺和其他性腺疾病中的糖蛋白质组学
前列腺大量分泌糖蛋白。除了男性不育外,前列腺疾病被认为与蛋白质-碳水化合物相互作用的紊乱密切相关,近年来一直是密集研究的主题。研究人员调查了前列腺疾病患者的血清、尿液和精浆中的糖基化情况。首先,研究集中于PSA的不同糖型,以识别出用于区分良性前列腺增生、潜在前列腺癌和侵袭性前列腺癌的更具体的糖型作为生物标志物。例如,α2,3-唾液酸化的N-糖基化PSA在诊断侵袭性前列腺癌方面具有潜力,优于传统的基于PSA的策略[104]。之后,糖基化在前列腺癌的发生和发展中的作用被揭示。研究发现N-糖基化和O-糖基化的改变与前列腺癌的发展有关。在前列腺癌细胞中,观察到唾液酸化和岩藻糖化增加;GlcNAc的结合;存在隐蔽和高甘露糖N-糖链;以及蛋白聚糖的改变。还观察到截断的O-糖链(sTn,sT抗原)的存在。这些改变可能会影响癌症中许多重要的生物学过程。
另外两个主要的附属性腺,即附睾和精囊,受到的关注要少得多。附睾异常可能导致糖基修饰酶的减少和精子成熟受损。与精囊相关的疾病可能与特定糖链和糖蛋白的分泌有关。精浆中高甘露糖型糖链的数量和密度的减少可能反映了精囊中糖基化或分泌途径的异常。应进一步探索糖基化在精囊中的作用。

图 3. 人类精液糖蛋白组学方法和应用概览
从精液中分离出精子和精浆后,首先提取总蛋白,然后分离糖蛋白进行消化以获得糖肽。在糖肽富集前可能需要预分级。最重要的富集策略包括使用凝集素、亲水相互作用液相色谱(HILIC)和化学衍生化。然后使用LC-MS/MS结合不同的碎片化方法,如高能碰撞解离(HCD)、电子俘获解离(ECD)和电子转移/更高能量碰撞解离(EThcD),来表征糖肽结构。最后一步是数据分析,涉及使用不同的生物信息学工具。FASP,过滤辅助样品制备;SDS-PAGE,十二烷基硫酸钠聚丙烯酰胺凝胶电泳;HPLC,高效液相色谱;LC-MS/MS,液相色谱-串联质谱;LC,液相色谱;RP-LC,反相液相色谱;HILIC-LC,亲水相互作用液相色谱-液相色谱;PGC-LC,多孔石墨烯液相色谱;HILIC-CE,亲水相互作用液相色谱-毛细管电泳;FAIMS,场不对称离子迁移谱学;MS/MS:串联质谱;CID,碰撞诱导解离;ETD,电子俘获解离;sceHCD,阶梯能量高能碰撞解离;ETciD,电子转移碰撞诱导解离;HCD-pd-ET,高能量碰撞解离-产物依赖电子转移解离。
发展中的精液糖蛋白质组学
糖蛋白研究有几十年的历史。近年来,精液糖基化研究基于糖链与蛋白质(如抗体或凝集素)之间的特异性结合。然而,这些传统策略对于理解糖链的组成和结构、蛋白质糖基化位点的基本特性、结构-功能关系以及特定糖链在特定蛋白质上的功能是不满意的。近年来,随着蛋白质组学和糖组学技术的显著进步,已经鉴定并功能性地表征了男性生殖系统中多种糖链以及糖蛋白上的糖基化位点的组成和结构。这种“真正的糖蛋白组学”方法基于先进的质谱技术,用于研究带有其天然或近天然N/O-糖型的完整N/O-糖肽(装饰了糖链的糖肽),可以获得特定糖基化(糖蛋白、糖肽、糖基化位点和糖链)信息。然而,N/O-糖基化的微异质性、宏异质性和超异质性为糖蛋白组学分析带来了巨大挑战。为了克服这些困难,不断开发了许多方法和途径以便于完整N/O-糖肽的表征,这些方法可以分为四个主要方法:样本准备、糖肽富集、液相色谱-串联质谱(LC-MS/MS)和数据分析(图3)。其中一些方法已应用于人类精液糖蛋白组的绘制。此外,相关研究中出现的不当精液样本处理可能对糖蛋白组结果产生负面影响。我们相信,精液样本处理的严格质量保证结合新型糖蛋白组学技术的应用将显著促进人类精液糖蛋白组学研究。
糖蛋白组学技术及其在人类精液中的应用
尽管在糖蛋白组学方面取得了巨大进展,但这些新技术和方法很少应用于男性生殖领域。考虑到已经借助特定位点的完整糖肽方法建立了正常人类精液糖蛋白组,我们综述的一个目标是介绍最新的糖蛋白组学策略,这些策略有望揭示糖基化在男性生殖的生理和病理条件中的作用。因此,根据上述四个方面,我们回顾了先进的糖蛋白组学工作流程及其在人类精液中的应用(图3)。
当前的样本准备技术能够处理复杂的生物样本,如精子或精液等。主要过程包括蛋白质提取和变性、还原和烷基化、消化和预分级。需要为不同的样本建立标准的样本准备程序,以获得高效率的蛋白质提取和低蛋白质消化缺失切割率,以及确保糖蛋白组学研究的重复性。对于人类精液样本,我们之前的研究报告称,使用尿素缓冲液结合超声波处理可以实现深入的精子蛋白质覆盖。糖过滤辅助样本准备(glyco-FASP)方法用于鉴定人类精子糖蛋白组。然而,当我们需要验证特定的糖蛋白或深入研究一个糖蛋白时,由于糖蛋白浓度的巨大动态范围和复杂样本中糖基化的极大复杂性,需要进行糖蛋白的分离或纯化。可以选择许多方法,如重组糖蛋白表达、免疫沉淀、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和分子色谱。
为了实现深入的特异性位点糖基化分析,选择性完整糖肽富集是避免非糖基化肽干扰的最有效方法之一。许多研究回顾了这些富集材料和方法,包括凝集素、二氧化钛、亲水相互作用液相色谱(HILIC)、肼化学、还原胺化和硼酸(图3)。然而,每种富集方法或材料都有其适用范围。应根据实验目的做出最佳选择。
目前,质谱结合各种分离方法(反相液相色谱(RP-LC)、亲水相互作用液相色谱-液相色谱(HILIC-LC)、多孔石墨烯液相色谱(PGC-LC)、亲水相互作用液相色谱-毛细管电泳(HILIC-CE)、场不对称离子迁移谱(FAIMS)等)是一种强大的工具,用于通过不同的碎片化方法(碰撞诱导解离(CID)、高能量碰撞解离(HCD)、电子俘获解离(ECD)、电子转移解离(ETD)、分级碰撞能量高能量碰撞解离(sceHCD)、电子转移/高能量碰撞解离(EThcD)、分级碰撞能量高能量碰撞解离(ETciD)、EThcD-sceHCD、高能量碰撞解离-产物依赖性电子转移解离(HCD-pd-ETD)等)进行完整糖肽分析。例如,碰撞诱导解离-串联质谱(CID-MS/MS)用于分析人类精液N-糖蛋白组,其中只包含50种N-糖蛋白。LC-MS/MS的参数设置和片段模式选择是糖蛋白组学实验中的关键决策点。近年来,我们提出了一种名为EThcD-sceHCD的新型碎片化方法,以改善完整N/O-糖肽分析的性能。它已被证明在许多复杂临床样本的特异性位点糖基化分析中比其他方法(sceHCD、EThcD等)表现更好。最近,我们小组通过结合EThcD-sceHCD和sceHCD-MS/MS首次绘制了O-糖蛋白组图谱。
最后,生物信息学工具对于处理完整糖肽的鉴定和定量数据至关重要。近期在大规模糖蛋白组学方面的进展已被回顾。然而,这些工具存在一定的局限性。例如,某些软件程序缺乏多级假阳性率(FDR)评估功能,这将影响完整糖肽鉴定的准确性。大多数生物信息学工具(Byonic、pGlyco等)没有完整糖肽定量功能,这限制了它们在临床应用中的使用。
提高精液样本处理的质量保证
为了确保高质量的糖蛋白质组结果,需要适当处理精液样本,这可能会受到许多因素的影响,包括样本收集、精液检查和精子准备。然而,我们注意到,在精液糖蛋白质组研究中描述的上述步骤是模糊的甚至不恰当的,这可能导致质量保证不足。首先,一些研究没有报告关于精液收集的信息,如手淫、标本损失和禁欲时间。其次,精液参数和生育历史信息不完整;例如,缺乏有关精子形态和圆细胞的信息。第三,上述研究中精子或精浆分离方法之间存在显著差异,这可能导致结果中的污染和偏差。除了精子,精液还包含体细胞(免疫细胞、上皮细胞)、未成熟的生精细胞以及细胞碎片或其他固体成分。在这种情况下,应使用过滤来去除不液化的凝胶状颗粒和粘液丝。除非后续的糖蛋白质组分析能够消除非精子细胞的影响,否则需要使用上游或密度梯度离心(DGC)来纯化精子。此外,细胞碎片会干扰精浆糖蛋白质组,需要使用高速离心较长时间(> 10,000 g)来去除。经过仔细分析,我们发现,上述研究中的大多数精浆是通过低速离心获得的。即使进行高速离心,精浆中仍然存在EVs。因此,报告的糖蛋白的数量、组成和结构可能不准确。此外,这可能导致精子和精浆糖蛋白质组之间的高度重叠。迫切需要改进精液样本处理。
总之,我们建议为从男性收集精液样本进行糖蛋白质组学研究提供明确的指示,还应该由生殖医学实验室的经验丰富的技术人员进行详细的精液检查,以评估样本是否可以使用。之后,根据实验设计,将精液样本进行适当处理,如高速离心、上游或DGC,然后进行糖蛋白质组分析。考虑到世界卫生组织(WHO)标准可能在一些糖蛋白质组学实验室不容易获得,图4提供了一个简化的精液样本处理工作流程,以获得可靠和可信的结果。

图 4. 确保获得稳定可靠的精液样本糖蛋白组结果的简化分析工作流程
首先,检查表展示了在收集男性精液样本时需要遵循的重要点。液化后,样本必须由经验丰富的技术人员分析,以评估精子参数。为了纯化出质量好且完全去除非精子细胞的精子,可能需要使用上游法或密度梯度离心(DGC)。
展 望
建立整个男性生殖系统的糖蛋白组
健康人类精液精子和精浆中的精确N-糖蛋白组已被绘制。除了N-糖基化,O-糖基化在男性生殖道中也非常负责,涉及许多重要的生物学过程,特别是免疫调节。例如,精液中糖蛋白的截短O-糖链参与受精期间的母体免疫反应。精子中O-连糖链的较高含量对生育能力有益,可能归因于女性生殖道中中性粒细胞的免疫逃逸。上述研究揭示了O-糖基化的几个重要作用,但技术限制了建立人类精液O-糖基化谱图的能力。预计这一限制将基于我们团队开发的一种名为GlycoTCFM的新策略来克服,并使用这一策略,我们绘制了人类精液最全面的O-糖蛋白组图谱。此外,人类精液的O-糖蛋白组谱已经不断更新,并将在未来大大扩展人类精液糖蛋白组的临床应用。
精子的糖基化在其整个生命周期中持续进行。精子生育能力的关键事件可能在任何时期发生,而从体内排出的精子可能不会被捕获。显然,精液精子和精浆的糖蛋白组仅代表了冰山一角。许多研究已经说明了睾丸、附睾、射出和获能精子之间糖基化模式的变化。通过组织化学定量评估精子生成对于识别精子生成细胞类型和确定是否存在疾病很重要。然而,需要一个精确的精子生成、成熟、获能和受精的糖蛋白组,这将帮助我们详细了解男性生殖中糖基化的复杂、动态、时空调节。此外,应改善附属性腺分泌物的糖基化谱,这将加深我们对这些分泌物在男性生殖健康中作用的了解。同样,最近一篇总结人类母胎互动中蛋白质糖基化的综述强调了其在早期妊娠调节中的作用,这也证明了构建完整的男性生殖糖基化谱的重要性。
糖蛋白组学在男性生殖临床应用的潜力
开发男性生殖健康的新生物标志物和治疗靶点
临床实践中使用多种精子参数,如浓度、活力、形态、遗传损伤、线粒体功能和顶体反应。不可否认,这些实验室测试能够诊断并指导患有不育症的患者的治疗。然而,这些患者中的相当一部分表现为精子参数正常,通常被归类为特发性男性不育症。最近的研究揭示,尽管正常精子参数不育患者产生正常的睾丸精子,但他们可能表现出精子成熟、获能、免疫和卵子识别的异常,但缺乏有效的临床实验室测试。糖基化的异常变化与上述男性不育症有关,有可能成为新的生物标志物。尽管如此,无论是存在糖类还是糖蛋白,都很少有用于临床的糖生物标志物被开发。
糖基修饰酶作为诊断精子成熟受损的附睾功能生物标志物具有很大潜力。值得注意的是,一项研究从无精子症个体的精液中筛查了65种酶,发现α-葡萄糖苷酶是唯一显示变异的酶。进一步的研究证明,精液中的中性α-葡萄糖苷酶特异性地在附睾中表达,而不是前列腺中的其他酸性同工酶。因此,它已经成为临床上用于精浆生化检测超过30年的唯一与糖基化相关的酶。然而,尽管被认为是附睾功能的标志,中性α-葡萄糖苷酶在诊断梗阻性无精子症中的临床应用有限,中性α-葡萄糖苷酶的减少提示精子成熟受损。然而,它可能不是参与此过程的关键酶。此外,许多酸性糖苷酶的改变水平涉及男性不育症。不仅它们的减少,而且它们的增加可能在少弱畸精子症中的精子和精浆的可溶性和不溶性部分中发挥作用。除了使用来自精浆的糖类相关酶检测精子成熟受损外,精子和精浆中的糖类和糖蛋白异常被认为是精子获能、精卵结合、免疫相关不育症和性腺的生物标志物。值得注意的是,没有有效的生物标志物用于评估这些参数。例如,对于特定于精囊的生物标志物,尽管主要用于梗阻性无精子症,但临床中只检测到一个标志物,果糖。然而,一种对生育能力至关重要的糖蛋白,精囊素S,由精囊分泌并释放到精浆中。糖基化影响精子获能,可能影响精囊疾病。与精子头部相关的获能糖类和糖蛋白,如甘露糖化,可能成为评估精子获能的候选物。此外,精子和精浆中糖基化模式的变化对诊断免疫相关不育症很有希望。应该注意的是,许多单一糖类、糖蛋白和粗略的糖基化模式已被识别为潜在的生物标志物,但由于男性生殖中糖基化的高复杂性,它们可能相对无效。因此,最近建立的人类精液精确糖蛋白组使我们能够筛选最合适的生物标志物或构建一个面板以及模型,以便更准确和具体地诊断男性不育症。
帮助改进辅助生殖技术(ART)
绘制人类精子的精确糖蛋白组图谱将对ART产生有利影响,即使在卵细胞胞质内精子注射(ICSI)条件下也是如此。精子冷冻保存是接受ART的患者常用的策略,不可避免地对精子产生不利影响。对患者而言,预测精子耐冻性具有临床意义,而了解精子表面的糖基化可能会对这一主题提供见解。不同耐冻能力的精液的凝集素微阵列测试显示,双孢蘑菇凝集素(ABA)有可能成为耐冻性的生物标志物。此外,精子的糖基化程度可能影响ART期间的精子优选过程。在精子冷冻保存期间保护糖蛋白可改善解冻精子的质量。精液对冷冻保存精子的糖基化谱的影响应进一步研究。此外,在ICSI处理精子时,精子表面的糖基化可能会发生变化。例如,已显示L-肉碱和喷托维林处理会影响睾丸精子表面的糖结合物。总之,精子糖蛋白组提供了有助于确定ART策略并改进精子冷冻、精子优选和精子准备程序的信息。
结 论
虽然糖基化在男性生殖研究中有着悠久的历史,但直到最近才详细阐述了人类精液精子和精浆中特定位点糖基化的情况。精液包含几种独特的糖基化形式,特别是极高的岩藻糖化,这需要进一步深入研究。糖蛋白组在免疫调节、获能和精子-卵子结合中发挥着至关重要的作用。此外,睾丸、附睾和获能精子的糖基化谱的变化可能与糖基修饰酶和EVs密切相关。男性不育症通常与精子或精浆的变化有关,这可能导致上述过程的失调。糖基化异常可能源于遗传、内分泌、氧化应激或感染,且可能解释一些原因不明的男性不育症例。然而,将糖蛋白作为男性生殖疾病的生物标志物的研究仍然不足。本文还讨论了科学家可以用来解决男性生殖当前挑战的先进糖蛋白组学技术。在O-糖基化研究中的突破揭示了整个精子发展过程中复杂、动态和时空调控的情况。该综述明确了糖链、糖型和糖蛋白作为诊断男性生殖障碍的生物标志物的重要性,并强调了它们在辅助生殖技术中如精子冷冻保存和精子优选的价值。
引文格式:
Qingyuan Cheng, Mengqi Luo, Zihe Xu, Fuping Li, Yong Zhang. 2024. Developing glycoproteomics reveals the role of post-translational glycosylation in the physiological and pathological processes of male reproduction. iMetaOmics 1: e10. https://doi.org/10.1002/imo2.10
作者简介

程庆元(第一作者)
● 四川大学华西临床医学院博士研究生,四川大学华西第二医院生殖男科/四川省人类精子库技师。
● 研究方向为精子与精浆相关蛋白在男性不育疾病中的作用研究,以第一作者在Heliyon、New Journal of Chemistry、Journal of Ovarian Research等期刊发表论文。

罗盟錡(第一作者)
● 四川大学华西医院科研实验技师规培学员。
● 目前主要研究方向为代谢性疾病的分子生物学机制及临床蛋白质组学,相关学术成果已发表在iMetaOmics、Journal of Proteome Research、Frontiers in Immunology、Cells等期刊。

徐梓赫(第一作者)
● 四川大学预防医学本科生。
● 2023年开始在张勇老师指导下参加全国大学生创新创业大赛,项目名称“人类弱精症精液糖蛋白质组学研究”。

李福平(通讯作者)
● 四川大学教授,硕士生导师。
● 研究方向为男性生殖学,主持和参与多项国家自然科学基金、省科技厅重大项目和重点研发项目等,已在Nature Communication、Environmental Research、J Med Genet等杂志发表论文。获得国家级发明专利3项,实施专利产业转化1项,出版专家共识1个,担任《检验医学与临床》杂志编委。

张勇(通讯作者)
● 理学博士,四川大学华西医院副研究员,硕士研究生导师,国际组织COVID-19质谱联盟成员,四川省生物信息学学会理事。
● 研究方向为临床转化糖蛋白质组学。主要围绕蛋白质组及其翻译后修饰建立新材料、技术、方法和算法,并在重大疾病中进行基础应用转化研究。主持或主研国家重点研发计划、国家自然科学面上和青年基金、中国博士后基金、四川省科技厅以及卫健委基金等项目10余项。在Nature Methods、Advanced Materials、Biomaterials等领域杂志发表高水平论文60余篇。作为第一或主要发明人,申请中国发明专利7项,已授权3项。获得省部级科学进步一等奖1项。担任iMeta、Phenomics、Biomaterials、Journal of Chromatography A等杂志的审稿人或青年编委。
iMetaOmics
更多资讯
● iMeta姊妹刊iMetaOmics(定位IF>10)欢迎投稿!(2024.2.27)
● iMeta姊妹刊iMetaOmics编委招募 (定位IF>10) (2024.3.2)
● iMeta姊妹刊iMetaOmics电子版和印刷版ISSN申请获批(2024.4.1)
● iMeta姊妹刊iMetaOmics投稿系统正式上线(2024.4.17)
● iMeta姊妹刊iMetaOmics主编正式官宣(2024.4.22)
● 出版社iMetaOmics主页正式上线!(2024.4.28)
● iMetaOmics | 浙江大学宗鑫组揭示两猪种宿主-肠道菌群互作差异
● iMetaOmics | 罗鹏/袁硕峰/苗凯/程全发表STAGER: 生成式人工智能可靠性的标准化测试和评估推荐
● iMetaOmics | 徐州医科大杨欢组揭秘沙门氏菌-宿主-微生物群在免疫与代谢中的相互作
● iMetaOmics | 中科院动物所金坚石组综述16S rRNA基因扩增子测序技术的“前世今生”
更多推荐
(▼ 点击跳转)
iMeta | 引用7000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
2卷2期封底
2卷4期封底
3卷2期
3卷3期
3卷3期封底
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百千华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!发行后相继被Google Scholar、ESCI、PubMed、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.7,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,同学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,定位IF>10的高水平综合期刊,欢迎投稿!
联系我们
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science








































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








