点击蓝字 关注我们
通过分子机制解析肠道微生物组与癌症的双向调控关系及其临床转化潜力

iMeta主页:http://www.imeta.science
研究论文
● 原文: iMeta (IF 23.8)
● 原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/imt2.70017
● DOI: https://doi.org/10.1002/imt2.70017
● 2025年3月19日,浙江大学医学院附属第一医院北仑分院的肖维华和刘春姣、浙江大学生命科学研究院的陈琼和蒋超、海普洛斯/赣南医科大学LifeX研究所陈实富等在iMeta杂志上在线联合发表了一篇题为“Gut microbiota in cancer: From molecular mechanisms to precision medicine applications”的评论文章。
● 本研究中系统评述了当前肠道微生物与癌症关系的研究,深入探讨了肠道微生物在癌症发生、发展中的分子机制,评估了其作为癌症诊断生物标志物的可行性,以及在癌症治疗中的潜在应用。这些发现为癌症的早期诊断、精准治疗和预后评估提供了重要的理论依据和实践指导。
● 第一作者:肖维华、陈琼、刘春姣
● 通讯作者:肖维华(hua2577@126.com)、陈实富(chen@haplox.com)、蒋超(jiang_chao@zju.edu.cn)
● 合作作者:余月儿、刘天亮、金杨、马海芬
● 主要单位:浙江大学医学院附属第一医院北仑分院病理科、浙江大学生命科学研究院、浙江大学医学院附属第一医院传染病诊治国家重点实验室、浙江大学茶叶研究所、深圳海普洛斯生物科技有限公司、赣南医科大学-海普洛斯LifeX研究所、奥斯陆大学医院癌症遗传学与信息学研究所
亮 点

● 探讨了肠道微生物在癌症发生、发展中的分子机制;
● 评估了肠道微生物作为癌症诊断生物标志物的可行性,以及在癌症治疗中的潜在应用;
● 这些发现为癌症的早期诊断、精准治疗和预后评估提供了重要的理论依据和实践指导。
摘 要
肠道微生物群与癌症之间通过多通路复杂分子机制互作,构成了癌症诊断和治疗应用的基础。尽管目前存在挑战,整合多维数据分析、AI技术、个体化治疗方案等新技术和新方法推动推动该领域朝着精准医学方向发展。
视频解读
Bilibili:https://www.bilibili.com/video/BV1HyoqYoEgN/
Youtube:https://youtu.be/tu8ieFFbUb8
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
癌症是全球主要的健康挑战。近年来,肠道微生物群在癌症发展中的关键作用受到越来越多的关注,相关研究取得的显著进展为癌症诊断和治疗带来了新的思路。肠道微生物群参与人体代谢、营养吸收及多种生理过程,同时通过与宿主免疫系统的互作,显著影响癌症的发生、发展和治疗反应。鉴于其功能的多样性,了解其潜在机制对于推动癌症研究和治疗至关重要。
肠道微生物群在癌症发展中的作用机制
肠道微生物群作为“第二基因组”,以多种分子和细胞途径动态调控癌症发展过程,其在肿瘤学研究中的地位日益重要。药物、辐射、病原体和环境暴露等众多因素都会与微生物群互作,进而影响肿瘤形成。研究表明,肠道微生物群通过分子信号传导、细胞反应、免疫调节、代谢变化和微环境重塑等方式促进癌症发展(图1)。微生物群与宿主之间的这种双向互作为靶向干预提供了新的契机。
分子信号传导:细菌诱导的信号网络在癌症发展中的整合机制
幽门螺杆菌细胞毒素相关基因A(CagA)可激活多条平行途径,包括促进细胞增殖的磷脂酰肌醇3 - 激酶(PI3K)/蛋白激酶B(Akt)途径,以及驱动血管生成和侵袭的Janus激酶(JAK)/信号转导与转录激活因子3(STAT3)。具核梭杆菌(F. nucleatum)通过具核梭杆菌黏附素A(FadA)激活β-连环蛋白和Wnt信号通路。这些途径与糖原合酶激酶-3β(GSK-3β)的调节相互关联,并与更广泛的信号网络互作,其中核因子κB(NF-κB)可通过髓样分化因子88(MyD88)依赖途径等多种途径被激活。丝裂原活化蛋白激酶(MAPK)级联反应和IL-1β信号进一步参与形成这个复杂的分子网络。这些整合的信号通路共同调控细胞增殖、血管生成、侵袭和癌症发生。
细胞反应:微生物对细胞表型和遗传稳定性的直接调节
微生物因子可诱导多种细胞适应性变化。携带FadA的具核梭杆菌和丁酸可调节β-连环蛋白(β-catenin)和GSK-3β信号通路,进而影响细胞行为。同样,亚硝胺的暴露可直接诱导DNA突变和损伤,而次级多环芳烃(PAHs)通过产生活性氧(ROS)诱导细胞应激反应。这些细胞反应最终导致持续性DNA损伤和表型转变,通过多条平行途径驱动肿瘤发生。
免疫调节:细菌对先天免疫信号和炎症反应的激活
免疫反应涉及复杂的受体介导的信号级联反应。细菌成分,如脂多糖(LPS)和肽聚糖,可与Toll样受体4(TLR4)相互作用,激活MyD88依赖途径。这种激活随后会引发核苷酸结合寡聚化结构域2(NOD2)和受体相互作用蛋白2(RIP2)信号传导,导致NF-κB和MAPK途径激活。除了这些相互作用,微生物群还通过胆汁酸受体TGR5(Takeda G protein-coupled receptor 5)调控IL-1β的产生,共同协调促炎细胞因子的产生和炎症反应。
代谢变化:微生物代谢物对细胞命运和功能的调节
微生物代谢物通过多种途径发挥不同作用。脱氧胆酸(DCA)参与环磷酸腺苷(cAMP)信号传导,调节ROS水平并改变细胞代谢。丁酸作为组蛋白去乙酰化酶(HDAC)抑制剂,影响p21、细胞周期蛋白依赖性激酶4(CDK4)和细胞周期蛋白D途径,从而控制细胞周期进程。这些代谢变化通过自噬和凋亡机制导致多种细胞结局,包括细胞周期停滞、细胞分化和程序性细胞死亡。
微环境重塑:微生物对组织稳态和全身反应的影响
组织微环境通过多种代谢途径发生显著改变。色氨酸代谢可分支为吲哚和犬尿氨酸途径,影响胃肠道稳态和免疫反应。血清素途径则调控中枢神经系统功能。这些途径共同展示了微生物活动如何全面重塑局部组织环境和系统性生理反应,形成宿主-微生物互作的复杂网络。
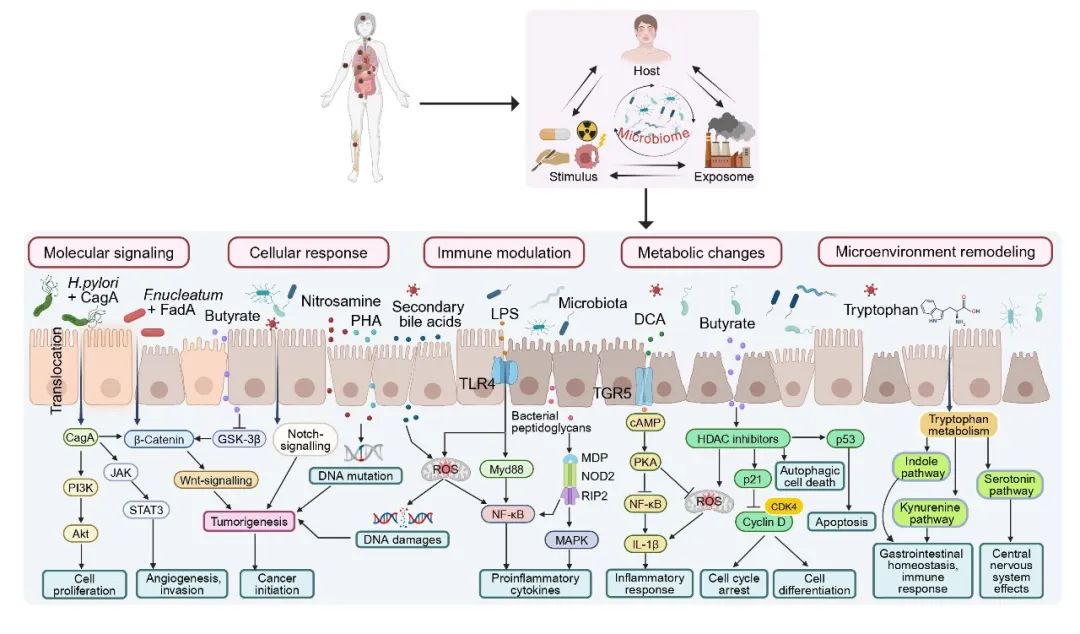
图1. 肠道微生物通过五种核心机制促进癌症进展
CA:胆酸,CDCA:鹅脱氧胆酸,HDCA:猪去氧胆酸,MDP:胞壁酰二肽,MUC1:黏蛋白1。
肠道微生物群在癌症诊断中的潜在影响
早期癌症诊断对于有效治疗至关重要。肠道微生物群已被视为一种潜在的癌症生物标志物。通过复杂的宿主-微生物互作(图2A),它能够影响肿瘤微环境,成为早期检测和诊断癌症的有前景的途径。
宿主来源的生物标志物:癌症发展的早期指标
肠道微生物群失衡可改变基因表达、免疫反应和代谢模式,引发癌症早期信号。例如,铜转运蛋白ATP酶铜转运α/β(ATP7A/B)蛋白的异常表达与结直肠癌(CRC)的化疗耐药性相关(图2A)。ATP7A调节铜稳态,其功能紊乱会导致铜失衡,进而引发氧化应激和癌症进展。虽然对这些基因标记的大规模研究有限,但小规模研究表明癌症患者与健康个体之间存在表达差异。新出现的证据表明,铜稳态机制相关可检测指标有成为新型诊断生物标志物的潜力,其临床应用值得进一步研究 。
以肿瘤坏死因子α(TNF-α)和NF-κB激活为特征的慢性炎症,促进多种癌症的发展。免疫反应标志物的变化,如CD4+T细胞减少、NK细胞功能受损,以及免疫检查点分子程序性细胞死亡蛋白1(PD-1)、程序性死亡配体1(PD-L1)和淋巴细胞活化基因3(LAG3)等的改变,均与癌症进展有关。这些标志物可作为早期诊断的非侵入性指标(图2A)。
宿主代谢变化也为早期癌症检测提供了有价值的信息。微生物代谢物(如DCA)水平升高,以及氧化应激标志物8-羟基-2'-脱氧鸟苷(8-OHdG)、丙二醛(MDA)和抗氧化指标(如超氧化物歧化酶和谷胱甘肽)等,正逐渐成为结直肠癌筛查和病情监测的有前景的生物标志物。这些代谢改变反映了细胞稳态变化和DNA损伤的变化,可用于早期诊断并有望成为潜在的治疗靶点。
微生物来源的生物标志物:揭示病理机制
微生物来源的生物标志物包括微生物产生的代谢物、蛋白质和基因,它们为了解癌症的发病机制和进展提供了重要信息。这些分子既反映了微生物群落的变化,也体现了特定病原体与宿主之间的互作,有助于早期检测和疾病监测。
具核梭杆菌和脆弱拟杆菌等特定病原体,通过微生物衍生因子(如FadA黏附素激活β-连环蛋白信号通路)促进结直肠癌进展。此外,微生物群落组成的变化,如α多样性(例如香农指数和Chao指数)降低,与胃癌相关。特定微生物基因(如编码胆汁酸水解酶的基因)的丰度,有助于区分肝癌患者和健康个体。
微生物代谢物在癌症调节中也发挥着重要作用。例如,丁酸可抑制肿瘤形成,但在结直肠癌中其调节异常会导致肿瘤抑制基因沉默。脱氧胆酸(DCA)和石胆酸(LCA)等次级胆汁酸也影响癌症进展;LCA可激活法尼酯X受体(FXR),促进肝癌细胞侵袭。具核梭杆菌的细胞致死膨胀毒素(CDT)、细菌素和吲哚等其他微生物代谢物,具有组织特异性分布和诊断潜力,进一步支持它们作为癌症生物标志物的应用价值。
宿主-微生物互作:肿瘤微环境中的协同效应
肠道微生物群失调会破坏黏膜屏障完整性,进而通过多种机制促进癌症发展。紧密连接蛋白闭合蛋白-1(ZO-1)作为黏膜屏障的关键组成部分,在结直肠癌中表达降低,且与转移潜能增强相关。此外,抗菌蛋白再生胰岛衍生蛋白3γ(REG3γ)水平降低,会促使微生物穿过屏障移位,导致慢性炎症,进而推动癌症进展。
异常的免疫-微生物互作在肿瘤发展中起重要作用。例如,Toll样受体2(TLR2)识别LPS可通过扩增髓源性抑制细胞(MDSCs)引发免疫抑制,降低抗肿瘤免疫反应。此外,细胞因子IL-22在平衡上皮修复和肿瘤生长方面具有双重功能,是肝癌潜在的治疗靶点。
共代谢产物,如氧化三甲胺(TMAO)和吲哚-3-乙酸(IAA),通过影响肿瘤血管生成和免疫调节来影响癌症进展。值得注意的是,胆碱代谢产物TMAO可促进结直肠癌的血管生成,但可能抑制乳腺癌的转移。此外,微生物群调节的胆汁酸结合,尤其是结合胆汁酸,会影响癌症干细胞的行为并重塑免疫微环境,促进癌症进展和免疫逃逸。
总之,肠道微生物群在癌症中的意义不仅限于基础病理学,这表明需要从生态学角度出发,注重微生物群干预与现有治疗方法之间的协同作用。
肠道微生物群在癌症诊断中的潜在影响
肠道微生物群在癌症治疗中通过三种主要方式提供多种治疗策略(图2B)。第一,生活方式干预,包括高纤维饮食和适度运动,有助于维持微生物多样性并提高治疗效果。第二,直接的微生物群调节策略,涵盖靶向抗菌治疗、益生菌、益生元和粪便微生物群移植(FMT)。值得注意的是,FMT已成为恢复化疗或免疫治疗患者微生物群多样性的有前景的方法,可改善治疗反应。
第三种方式是针对微生物群-宿主互作的药物干预,包括工程溶瘤细菌、噬菌体疗法和调节微生物代谢的小分子药物。近期研究表明,这些干预措施可显著影响免疫治疗和化疗的效果,尤其是通过增强免疫系统激活和降低治疗耐药性。生活方式改变、直接微生物群调节和药物干预这三种方法的结合,代表了一种改善癌症治疗效果的综合策略。
肠道微生物群在癌症诊断和治疗中的挑战与争议
目前,微生物群-癌症研究在技术、生物学和临床领域面临诸多挑战(图2C)。在技术层面,微生物群落的复杂性及其多样的代谢产物,使得识别癌症特异性特征变得困难。生物学挑战包括环境和遗传因素的影响,以及真菌作用研究不足,这些因素都会影响检测准确性。
在治疗应用方面,FMT在免疫功能低下患者中面临特定问题,包括供体-受体兼容性和病原体传播风险。移植微生物群的稳定性不确定以及长期随访数据有限,也给治疗效果预测带来了额外阻碍。
从临床前研究转化到临床应用面临多种障碍,包括物种特异性差异、伦理考量和标准化要求。未来的进展依赖于大规模纵向研究、聚焦于肠-脑-肿瘤轴的先进功能基因组学研究,以及标准化的实验方案。单细胞基因组学、单细胞转录组学和空间转录组学技术的整合,对于开发更安全、有效的临床应用至关重要。
肠道微生物群精准医学研究的前景
近期的技术突破和临床进展表明,将肠道微生物群标志物纳入早期癌症筛查和个性化治疗(尤其是结直肠癌)具有广阔前景(图2D)。目前的研究利用16S rRNA测序和宏基因组学等高通量方法来绘制微生物群组成图谱,但其分辨率有限,影响因果推断。先进技术,包括单细胞测序和代谢组学,正为深入了解微生物-宿主互作和代谢网络提供新的视角。
微生物群研究与精准医学的整合正通过多种途径加速发展:人工智能(AI)驱动的预测模型、实时微生物组监测和靶向治疗干预。益生菌和FMT的体外和体内功能研究,有助于阐明特定的微生物机制,从而制定更精确的治疗策略。
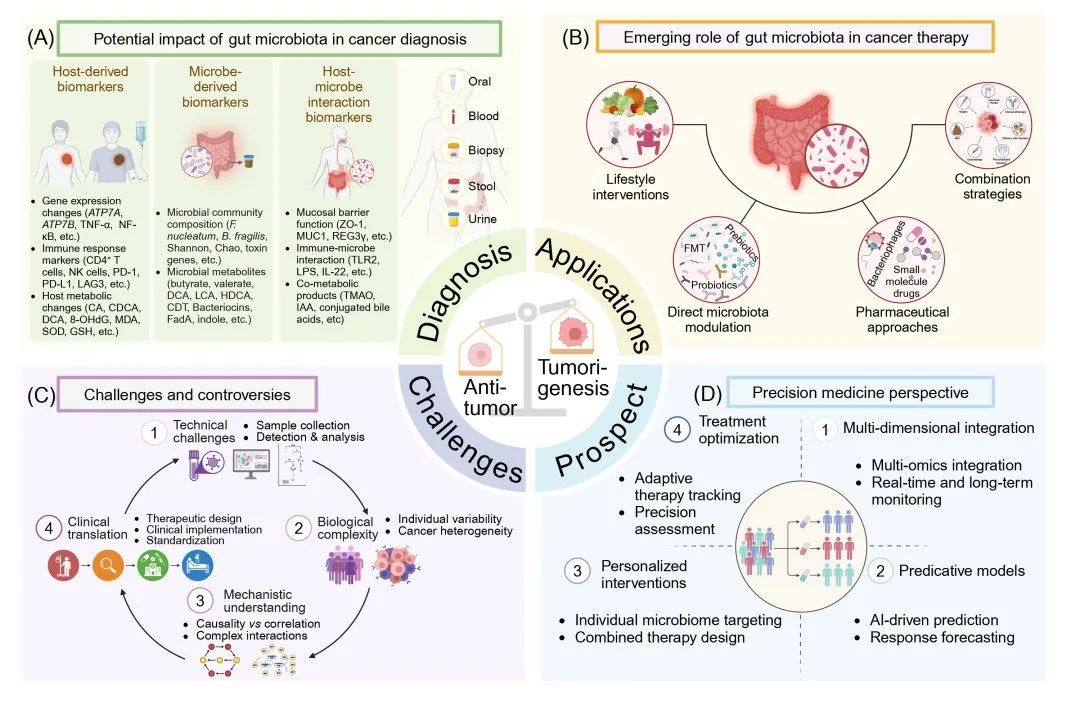
图2. 肠道微生物群在癌症中的应用、挑战及精准医学方法
(A) 用于癌症诊断的宿主来源、微生物来源以及宿主 - 微生物互作生物标志物。(B) 癌症治疗中调节微生物群的治疗策略。(C) 基于微生物群的癌症研究当前面临的挑战。(D) 精准医学视角:从多组学整合到个性化干预。
结 论
肠道微生物群通过多种分子和细胞机制影响癌症发展,为癌症诊断和治疗提供了机会。尽管在标准化和生物学复杂性方面仍存在挑战,但新兴技术和综合方法正推动我们对微生物群-宿主互作的理解。随着研究的不断深入,基于微生物群的策略可能会成为精准癌症医学的重要组成部分,有助于改善患者的治疗效果。
代码和数据可用性
本评论未使用新的数据和脚本。补充信息(图文摘要、幻灯片、视频、中文翻译版本和更新材料)可从在线DOI或iMeta Science(http://www.imeta.science/)上获取。
引文格式:
Xiao, Weihua, Qiong Chen, Chunjiao Liu, Yueer Yu, Tianliang Liu, Yang Jin, Haifen Ma, Shifu Chen, and Chao Jiang. 2025. “Gut Microbiota in Cancer: From Molecular Mechanisms to Precision Medicine Applications.” iMeta 4: e70017. https://doi.org/10.1002/imt2.70017.
作者简介

肖维华(第一/通讯作者)
● 浙江大学医学院附属第一医院北仑分院病理科主任医师,兼任中国抗癌协会肿瘤病理专业委员会多个亚专科学组委员。现任宁波市医学会第四届医学鉴定专家库成员,担任iMeta、iMetaOmics杂志副主编,为Trends in Cancer等多家 SCI 期刊审稿人。
● 主要研究方向为癌症与免疫细胞、肿瘤微环境,以及基于肠道微生物群的癌症精准诊疗策略。主持2项宁波市自然科学基金项目。已在OncoTargets and Therapy等外文期刊发表论文9篇,在国内中文期刊发表论文十余篇。参与编写4部中国抗癌协会专家共识/指南,如《软组织和骨肿瘤分子病理学检测专家共识(2022年版)》,并主编专著1部。

陈琼(第一作者)
● 浙江大学生命科学研究院博士后。
● 2019年博士毕业于浙江大学,研究方向为沙漠生态修复、微塑料暴露、环境空气暴露组、精准医学以及相关软件开发等。已在国际知名期刊Cell Discovery、Journal of Hazardous Materials、The Innovation Medicine、Nutrients、The Journal of Nutrition、Journal of Agricultural and Food Chemistry、Briefings in Bioinformatics等杂志发表多篇论文。长期担任Environmental Health Perspective、Current Microbiology、Journal of Health and Pollution等杂志审稿人,为Journal of Food Science编辑委员会成员。

刘春姣(第一作者)
● 浙江大学医学院附属第一医院北仑分院病理科主治医师。
● 主攻乳腺、淋巴造血等亚专业病理诊断。以第一作者身份在Oncology Letters发表论文1篇,同时作为第二作者于Frontiers in Oncology发表论文1篇 ,在相关学术研究方面取得一定成果。

陈实富(通讯作者)
● 博士毕业于中科院,现任海普洛斯创始人兼首席技术官,广东省肿瘤基因组学和肿瘤生物信息学工程技术中心主任,赣南医科大学-海普洛斯LifeX研究所负责人。
● 2019年深圳市青年科技奖获得者,以项目负责人获2022深圳科技进步奖获。开源项目组OpenGene的发起人,多款热门生物信息学软件的作者。发表国际期刊和会议论文60余篇,其中一作兼通讯最高单篇引用超过17000次。连续入选全球前2%顶尖科学家榜单,以及中国高被引学者榜单。

蒋超(通讯作者)
● 浙江大学生命科学研究院研究员、博导,兼聘浙江大学附属第一医院传染病重症诊治全国重点实验室。中国生物物理学会肠道菌群分会委员及中国环境诱变剂协会-环境流行病学专委会委员。
● 长期致力于环境空气暴露组、微生物介导的人环互作、微生物进化、精准医学研究以及相关的分子实验和生信分析方法开发及应用。暴露组学是一门新兴学科,主旨在同一健康的大框架下,解析联系环境、动植物及人类健康的全景环境暴露动态及其效应机制。蒋超博士以一作或通讯在Cell、Nature、Nature Communications、Nature Protocols、Cell Reports、iMeta、ES&T、Journal of Hazardous Materials、Briefings in Bioinformatics、Cell Discovery、mSystems等杂志发表论文。获得国内外专利若干。主持国自然病毒组专项、面上项目等,参与省领雁项目。任iMeta、iMetaOmics、Scientific Reports副主编、The Innovation Life编委、Phenomics青年编委。
更多推荐
(▼ 点击跳转)
iMeta | 引用16000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
iMeta | 兰大张东组:使用PhyloSuite进行分子系统发育及系统发育树的统计分析
iMeta | 唐海宝/张兴坦-用于比较基因组学分析的多功能分析套件JCVI
iMeta封面
1卷1期
1卷2期
1卷3期
1卷4期
2卷1期
2卷2期
2卷3期
2卷4期
3卷1期
3卷2期
3卷3期
3卷4期
3卷5期
3卷6期
4卷1期
iMetaOmics封面
1卷1期
1卷2期
2卷1期
期刊简介
“iMeta” 是由威立、宏科学和本领域数千名华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表所有领域高影响力的研究、方法和综述,重点关注微生物组、生物信息、大数据和多组学等前沿交叉学科。目标是发表前10%(IF > 20)的高影响力论文。期刊特色包括中英双语图文、双语视频、可重复分析、图片打磨、60万用户的社交媒体宣传等。2022年2月正式创刊!相继被Google Scholar、PubMed、SCIE、ESI、DOAJ、Scopus等数据库收录!2024年6月获得首个影响因子23.8,中科院分区生物学1区Top,位列全球SCI期刊前千分之五(107/21848),微生物学科2/161,仅低于Nature Reviews,学科研究类期刊全球第一,中国大陆11/514!
“iMetaOmics” 是“iMeta” 子刊,主编由中国科学院北京生命科学研究院赵方庆研究员和香港中文大学于君教授担任,是定位IF>10的高水平综合期刊,欢迎投稿!
iMeta主页:
http://www.imeta.science
姊妹刊iMetaOmics主页:
http://www.imeta.science/imetaomics/
出版社iMeta主页:
https://onlinelibrary.wiley.com/journal/2770596x
出版社iMetaOmics主页:
https://onlinelibrary.wiley.com/journal/29969514
iMeta投稿:
https://wiley.atyponrex.com/journal/IMT2
iMetaOmics投稿:
https://wiley.atyponrex.com/journal/IMO2
邮箱:
office@imeta.science












































 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








