原标题:欧盟GMP问答(二) ——计算机化系统及医用气体可追溯性

编译:冯霄婵
沈阳药科大学国际食品药品政策与法律研究中心
前言
上一篇文章中,我们介绍了欧盟GMP的一般规定以及无菌产品的相关问答,本期欧盟GMP问答,我们继续对计算机化系统的相关规定以及如何确保医用气体的可追溯性进行答疑解惑。

三、计算机化系统

欧盟GMP指南附录11:补充要求:计算机化系统
计算机化系统相关术语解释
用户需求
是指使用方对厂房、设施、设备或其他系统提出的要求及期望
电子签名
是指电子数据中以电子形式所含、所附用于识别签名人身份并表明签名人认可其中内容的数据
计算机化系统生命周期
指从提出用户需求到终止使用的过程,包括设计、设定标准、编程、测试、安装、运行、维护等阶段
1、附录中要求对电子文件(如模板)进行适当控制,那么对电子表格模板有何特定要求?
电子表格模板有助于避免错误计算之前剩余的数据进。应妥善检查模板的准确性和可靠性(附录11 第7.1条)。储存模板的方案应能够确保合理控制该版本的表格模板(第4章第4.1条)。
2、应对电子表格的使用进行何种类型的准确性检查(附录 第11 条)?
通过电子表格的正确使用以及风险评估的措施确保数据完整性,通过确保表格中的成分不会被意外覆盖保护计算结果和表格文件。应避免意外输入不当的数据类型或导致错误的信息(例如,数字字段中输入文本或整数字段中输入十进制格式)。鼓励进行所谓的“边界检查”(boundary checks)。
注:边界检查是计算机编程中检测变量在使用之前是否在某个范围内的任何方法。 边界通常能够确保数字符合给定类型(范围检查),或者用作数组索引的变量在数组的边界内(索引检查)。
3、验证电子表格需要考虑哪些具体因素?
至少应根据附录11第4段的要求,验证含有自定义代码的电子表格(例如Visual Basic应用程序)。应验证公式或其他类型的算法是否正确。
4、为确保数据库中数据的安全性应采取什么措施?
数据安全性包括数据完整性、可靠性以及可及性。在确认数据库或数据库系统期间,应考虑:
(1) 实施的程序和机制,确保数据安全性、保持数据具有意义并进行逻辑处理;
(2)负载测试、监测数据库的未来增长和数据库饱和度的工具;
(3)在系统生命周期结束时对数据的必要迁移采取预防措施(附录11 第17部分)。
5、建议在计算机化系统生命周期的哪个阶段,进行风险管理?
应对计算机化系统全生命周期进行风险管理。第一次风险评估应确定系统对GMP的重要性,即系统是否会对患者安全、产品质量或数据完整性产生影响。通常根据潜在风险制定用户需求标准,该标准构成了第一次正式风险评估的基础。为确定复杂系统的关键功能,应在更详细的风险评估中对其进行评估。这样有助于确保验证活动涵盖了所有关键功能。风险管理包括实施适当的控制措施并验证这些控制措施的实施效果。
6、用户需求是否作为传统系统(legacy systems)追溯验证的一部分被需要?
定义用户需求并进行偏差分析是检查计算机化系统是否符合其预期目的的方法,需要以用户需求确定追溯验证的验证工作。同时,定义的用户需求也应经过验证。
7、何时需要重新验证计算机化系统?
计算机化系统应定期审查,以确认其处于有效状态。定期审查包括审查当前计算机化系统的功能范围、偏差记录、变更记录、升级记录、性能、可靠性和安全性。应根据系统的重要性确定重新审查和验证的时间段。
8、对电子数据和文件的存储时间有哪些要求?
储存电子数据的要求与纸质文件的要求没有什么不同。应确保电子记录中的电子签名在文件的整个储存期内均有效。
9、应对小型设备进行哪些相关验证?
小型设备是被广泛使用的现有设备部件。在这种情况下,计算机化系统生命周期主要由供应商控制。客户应根据共同的质量标准合理评估供应商的软件研发能力。
评估供应商的同时应根据要求的预期用途对评估申请进行验证。从监管的角度看,使用这种设备是由计算机化系统的生命周期驱动的。因此,至少需要处理下列问题:
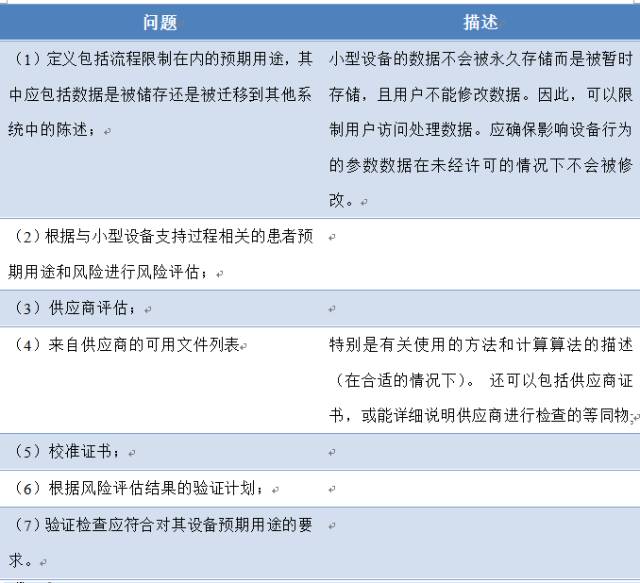
小型设备有时只能配备微处理器和固件,不具备高级管理功能。此外,在这些设备中,数据实质上是短暂的。因此不存在数据被无意修改的风险,不必进行审计跟踪。可以限制用户访问参数控制功能。
10、如果系统无法生成指示数据原始条目是否更改的打印输出,则应接受哪些替代控制措施?
如果供应商不支持这种功能,在程序中可以描述这样一种事实——生成了关于审计跟踪报告的打印输出并将其链接到支持批量发行的记录中。
发起人应确保保存第8章所列的文件,即GCP指南——《临床试验的基本文件》,且应确保审查部门能够审查这些文件。
确保数据完整性是计算机化系统的重要组成部分,想了解更多关于数据完整性的文章?请看:

三、医用气体生产的可追溯性

1、可追溯性是什么?
可追溯性是指检索某批次医疗产品的生产和分配操作情况的能力。通过追溯系统记录的数据在发生意外情况下应允许进行有效调查,并应允许召回(潜在)缺陷产品。包装医用气体时,包装部件(外壳和阀门)可重复使用。因此,有必要记录附加信息,尤其是关于使用和维护这些部件的信息。
2、在气缸装满医用气体的情况下应记录哪些条目以供追溯?
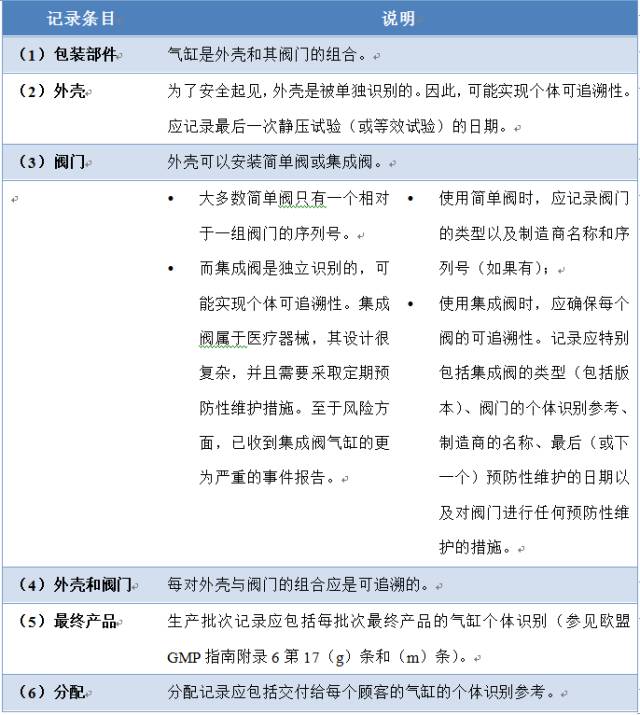
3、为确保可追溯性应采取哪些措施?
实际上,由于操作范围限制,在没有计算机化系统的情况下,难以确保有效的可追溯性。在气缸上使用条形码或电子芯片可能会促进其可追溯性。任何为确保可追溯性的计算机化系统应符合欧盟GMP指南附录11的要求。
4、可追溯系统可以实现什么
医用气体生产商收到对其医用气体本身或包装部件的严重投诉时,实施可追溯系统能够识别受影响的气缸,在必要情况下,也可以从市场中召回受影响的气缸。
有关包装部件的缺陷可能需要在一个最终或大量最终产品批次中识别出特定的气缸,从而确定需要召回的程度。例如,一个有效的可追溯性系统应根据特定型号、版本或生产商的阀门批次,以及特定时间段内对阀门进行维护和校准操作有效召回装有缺陷阀门的气缸。
转载此版本请保留出处,并注明转载自“国际药政通”(SYPHU-IFDPL)。
责任编辑:冯霄婵
责任编辑:





















 633
633











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








