研究目的:睡眠慢波活动,通过脑电图δ功率(<4hz)测量,在整个发育过程中经历了显著的变化,反映了大脑功能和解剖结构的变化。然而,个体慢波特征的年龄依赖性变化尚未得到彻底的研究。在这里,我们的目标是表征个体慢波特性,如起源、同步和皮层传播在童年和成年之间的过渡。
方法:对正常发育的健康儿童(N = 21, 10.3±1.5岁)和健康青年(N = 18, 31.1±4.4岁)通宵高密度(256个电极)脑电记录进行分析。所有记录都经过预处理以减少伪影,并使用经过验证的算法检测和表征NREM慢波。统计学显著性阈值设为p = 0.05。
结果:儿童慢波更大、更陡,但分布范围小于成人。此外,它们往往主要起源于并扩散到更多的大脑后部区域。与成年人相比,儿童的
慢波也显示出更强烈地涉及和源自右脑的趋势,而不是左脑。对同步效率高和低的慢波的单独分析表明,这些波的成熟模式部分不同,这与它们可能依赖于不同的产生和同步机制一致。
结论:儿童期到成年期的慢波起源、同步和传播的变化与已知的皮质-皮质和皮质下-皮质脑连通性的改变是一致的。从这个角度来看,慢波特性的变化可能为评估、跟踪和解释生理和病理发展提供了有价值的尺度。
1. 简介
在儿童和青少年时期,人类大脑经历了几次重要的结构和功能适应。根据特定区域的轨迹,白质体积随着年龄的增长而增加,直到成年。反之亦然,从7岁以后开始,灰质体积大规模且不同步下降,特别是在额-顶联合区域,遵循后-前轨迹。这种下降似乎是选择性突触修剪、程序性细胞死亡和进行性皮质内髓鞘形成共同作用的结果。重要的是,这种微妙而复杂的过程的紊乱被认为是青春期出现的几种精神疾病的基础。睡眠脑电图(EEG)被认为是一种可靠的工具,可以追踪从婴儿期到青年期发生的成熟依赖的大脑适应。事实上,在睡眠状态下记录的大脑活动只受到与动机、注意力和环境影响相关的混杂因素的轻微影响,从而允许对大脑活动进行公正的评估。此外,非快速眼动慢波(4Hz)和纺锤波(10-16Hz)等睡眠特征似乎直接反映了大脑组织和连通性,因此可能允许跟踪生理和病理的成熟变化。
睡眠慢波在这方面特别有趣,因为它们依赖于短期和长期连接。具体来说,突触强度和效率的局部变化被认为会影响神经元的同步,从而影响慢波特性,如振幅、斜率和负峰的数量。不同的是,远距离(例如,经胼胝体)连接似乎会影响皮层水平上的远距离慢波传播。根据这些考虑,慢波活动(SWA)——表示为δ范围内(<4hz)的平均脑电图信号功率——随着年龄的增长而逐渐下降,而其地形分布显示从头皮后部到前部的转变。这些变化与区域髓鞘形成和皮层体积的(微观)结构变化以及区域特定技能的获得同时发生。此外,纵向和半球间纤维髓鞘形成的变化与慢波传播速度和距离的增加有关。
有趣的是,之前的研究表明,至少存在两种慢波亚型,可能是由不同的同步过程产生的: 1)一个可能的皮层下-皮层觉醒相关过程(I型)可能导致广泛、大、陡的慢波的出现,这些慢波在入睡早期占主导地位,往往起源于中央额叶区;2)皮质-皮质过程可能是产生更有限、更小、更浅的慢波(II型)的基础,这种慢波在稳定的非快速眼动睡眠中占主导地位,可能起源于皮层的任何地方。在发育过程中对这些慢波亚型的研究可以为研究参与睡眠和慢波调节的皮层和皮层下结构的成熟提供一个重要的窗口。
虽然上述观察结果暗示了慢波作为脑成熟标志的潜在价值,但从未对地形慢波特征和不同慢波亚型如何从儿童期到成年期变化进行过详细而全面的分析。值得注意的是,更好地理解与发育过程相关的慢波调节机制,可能对使用慢波作为神经发育障碍的标志具有更广泛的意义。事实上,在青春期或青年期出现的特定精神病理被认为源于典型成熟过程的异常或夸大,这可能反映在慢波表达模式的改变中。因此,我们分析并比较了健康儿童和年轻人的夜间睡眠高密度脑电图数据(256个电极),以研究地形慢波特征的潜在成熟依赖性变化。特别是,我们使用自动化方法来检测单个慢波,并分析它们的起源,区域同步和传播模式。以下假设是基于已知的大脑发育适应和先前观察到的慢波特性而提出的。首先,慢波的起源和分布(介入)都从后脑区转移到前脑区,从而反映了额叶区产生和被行进慢波到达的能力的变化。其次,儿童的慢波在两个半球之间的分布更少,更不对称,这可能是半球间白质束发育不完全的结果。第三,不同慢波亚型的可解离特性和成熟模式与其主要依赖于不同的同步机制和大脑结构(分别为皮层下和皮层)一致。
2. 方法简述
2.1 被试
在这项观察性横断面调查中,我们研究了使用相同脑电图系统和类似程序记录的健康儿童和年轻人一个晚上的情况。在卢加诺市立医院睡眠科招募儿童作为对照参与者,参与一项关于注意力缺陷/多动障碍(ADHD)患者睡眠改变的研究,而在威斯康星大学麦迪逊分校睡眠实验室进行的一项研究中,年轻人被作为一项评估冥想对睡眠影响的研究的对照对象。经过睡眠医学委员会认证的医生彻底采访了儿童和成人,以筛查任何已知的睡眠障碍或任何影响睡眠的医学状况。选定的受试者随后被送到睡眠实验室进行睡眠视频PSG和扩展脑电图监测,以筛查阻塞性睡眠呼吸暂停综合征(OSAS)和周期性肢体运动(PLM)的存在。
儿童组21例(年龄10.3±1.5岁,女性9例),成人组18例(年龄31.1±4.4例,女性11例)。
2.2 夜晚记录
所有参与者都在实验室进行了夜间高清脑电图记录(256通道;electric Geodesics Inc., Eugene, OR), 250 Hz或500 Hz采样率,再加上传统的videoPSG。在数据预处理和分析之前,在500 Hz下采样到250 Hz。熄灯时间在参与者最一致的就寝时间一小时内,所有参与者的起床时间都在早上6点到7点之间。睡眠阶段和睡眠事件由经过专业认证的睡眠医生使用Embla®Remlogic软件(Neurolite)根据标准标准进行评分,基于6个双极重新参考脑电图通道(F3/M2、F4/M1、C3/M2、C4/M1、O1/M2、O2/M1)、眼电图(EOG)和脑下肌电图(EMG)的30秒epoch。补充表S1报告了儿童和成人的睡眠宏观结构。
2.3 EEG数据预处理
在进行频谱分析之前,我们按照hd-EEG的标准程序对数据进行预处理。我们导入所有脑电图信号和其他相关信息(包括睡眠评分),提取NREM睡眠(N2和N3阶段)时期,并使用EEGLAB工具箱在MATLAB (The MathWorks Inc., Natick, MA)中进行分析。我们在0.1 Hz下进行一阶高通滤波(IIR滤波器再现单个电阻容量),随后对EEG信号进行带通滤波(0.5 - 45 Hz,基于Kaiser窗的FIR,相位失真为零)。使用一个交互式的开源数据可视化和数据清洗工具(https://github.com/CSC-UW/csc-eeg-tools.git)在MATLAB中可视化地检查数据,并标记坏通道和伪信号。包含唤醒或运动相关伪像的数据段影响了所有通道的大多数(>50%),被标记为“坏”,不考虑后续分析(即,在坏段期间发生的慢波被丢弃)。平均而言,不良片段短于30秒,总体上不到记录的NREM信号的20%。此外,我们通过检查功率谱和地形功率图,移除了相对于相邻通道明显更大的功率通道。使用EEGLAB程序分别对N2和N3数据进行独立成分分析(ICA),以去除眼部(如眼球转动)、心电图、出汗和肌肉伪影。基于组件的地形和时间序列,我们只排除了具有特定活动模式的ICA组件和具有人工活动特征的组件地图。最后,我们使用非线性球面插值恢复了去除的坏通道。
2.4 非快速眼动睡眠的脑电图信号功率
使用无伪影的6秒周期对平均参考信号进行频谱分析(带有Hamming窗口的Welch平均修正周期图,8段,50%重叠)。对于地形分析,我们计算了各时期的平均δ功率(SWA);1 ~ 4 Hz),并检查绝对功率和归一化功率(跨通道的zscore,使用公式z = (x-μ)/ φ计算,其中x为特定电极的原始值,μ和φ分别为跨电极计算的平均值和标准差)。
2.5 慢波探测
EEG信号参考链接乳突(右乳突:通道190,左乳突:通道94),并使用经过验证的方法自动检测慢波。首先,我们通过在191个“内部”电极(即排除放置在面部和颈部的通道后)中为每个时间点选择第五大负性样本来计算信号负包络。这种方法最大限度地降低了包络线中包含人为起源的潜在残余高振幅振荡的风险。然后,我们应用了基于零均值中心信号包络上连续过零的识别的负半波检测程序。只有持续时间在0.25到1.0秒之间的半波被保留下来供进一步分析。未应用幅度阈值。对于所有检测到的慢波,我们计算并存储了以下感兴趣的参数:持续时间(以秒为单位的过零时间;s),最大负峰振幅(μV),下坡(第一个过零点到最大负峰之间);μV/s)、上坡(最大负峰与第二次过零之间);μV/s),介入(以波峰为中心的40 ms窗口内所有电极的平均脑电图信号;μV)。
2.6 慢波的起源和传播
对于每个检测到的慢波,我们通过确定每个局部最大负峰相对延迟的地形分布来计算其传播模式。我们使用“相似约束”方法来丢弃负波与“原型”慢波过于不同的通道,“原型”慢波定义为在信号负包络上检测到的最大波峰时具有最大负峰的波。该方法基于原型波的瞬时相位(使用希尔伯特变换估计)与每个脑电图信号的瞬时相位(在对称的300 ms时间窗内)之间的相互关联。超过最大相互关联值分布的第25百分位数的事件被保留以创建头皮延迟图。然后,我们应用时空聚类过程来排除潜在的传播间隙。根据这一过程,我们认为两个相邻电极的局部峰间隔小于10 ms作为同一传播簇的一部分。最后,我们识别了包含原型波的传播簇,提取了最终的延迟映射,并将最小延迟设置为零。得到的延迟映射用于计算慢波密度、全局性、概率起始和终止。具体来说,每个信道的慢波密度定义为所考虑的信道每分钟参与慢波的次数。在排除人工或非生理活动后,在每个睡眠时期计算该指数,然后在各个时期平均。慢波全局是指从延迟图中提取的单个慢波所涉及的信道数。慢波起始和终止分别被定义为每个慢波显示最低(即0 ms)或最高传播延迟的通道。因此,概率起源/终止是慢波在每个电极中起源/终止的百分比。为了研究慢波是否以不同的发生率在两个半球起源,如果75%的起源通道位于左(或右)半球,我们将单个慢波分类为具有左(或右)半球起源。然后,我们确定了在左半球或右半球有明确起源的慢波的总体比例,相对于检测到的慢波总数。最后,我们计算了“通道招募对称指数”,定义为半球中较少参与电极的通道数除以参与通道总数(%)。50%表示对称分布,0%表示单侧波动。
2.7 慢波卷入的主成分分析
先前的工作使用主成分分析(PCA)来研究可能存在的少量(刻板的)头皮介入模式,解释地形慢波分布的大部分差异。在成人中,与慢波头皮介入相关的95%的方差可以用3个主成分(PCs)来解释,其中最大值在中央额叶区域(占总方差的70%)、前部或后部区域(20%)以及左半球或右半脑(5%)。这些PC可能反映不同的慢波表达模式,这取决于不同的波源或传播模式的参与。事实上,I型慢波似乎主要落在第一个(中央-额叶)PC上,而II型慢波在三个PC上的分布更为相似。为了研究成熟过程如何影响这些慢波表达模式,我们使用主成分分析(PCA)分析了所有慢波的卷入分布(跨通道),如先前的研究所述。首先,我们通过目视检查确认,在我们的年轻人和儿童样本中发现了与之前工作中观察到的相同的3个主要PC。然后,使用Procrustes变换将每个受试者的PC空间旋转到一个共同的PC空间。Procrustes变换是一个正交变换,它使两组成对向量之间的欧氏距离最小化。通过对被试对进行变换迭代选择参考空间,然后确定相对于所有被试的坐标系距离最小的坐标系(即被试)。最后,我们应用Procrustes变换将每个受试者(成人和儿童受试者)的原始PC空间重新映射到新的参考PC空间中。这一过程使我们能够比较个体间PC的解释差异。
此外,我们对每台PC上重量最大的前100个慢波进行了源建模。为此,我们选择了适合年龄的MRI模板,使用SPM12/CAT12 MATLAB工具箱进行分割。头部的对称边界元模型(BEM)具有3个逼真层(头皮,内颅骨,外颅骨)和一组标准的共配准电极位置用于构建正向模型。逆矩阵使用sLORETA最小范数计算,源被限制为垂直于皮质表面,仅保留噪声协方差矩阵的对角元素。
2.8 慢波同步
先前的研究表明,在成人中,慢波亚型具有不同的特性和调节,并且可能反映不同的同步机制(I/II型),可以根据其同步效率进行启发式区分。具体来说,计算每个波的“同步分数”,即显示负平均电流值为<−5μV的通道百分比乘以波的平均斜率(即下行斜率和上行斜率的平均值)。根据来自动物和计算模型的证据,该指数可能取决于产生慢波的区域/神经元的数量及其同步的速度。这里,我们使用同样的方法来计算每个检测到的慢波的同步得分。然后,为了允许在儿童和成人之间进行可解释的比较,我们为每个参与者选择了相同数量的具有高和中等同步效率的慢波,分别假设为代表I型和II型慢波。从同步得分的整个分布中,我们确定了那些落在第90到100百分位之间的(前10% -推定的I型),以及那些落在第45到55百分位之间的(中10% -推定的II型)。然后我们计算了慢波的起源和头皮介入程度,这些慢波被分类为中10%或前10%。每个慢波的卷入值通过跨电极的z得分转换进行归一化,以解释慢波亚型之间不可避免的振幅差异。本分析仅针对第一个NREM周期的数据进行,以避免与慢波同步的稳态变化相关的可能混淆。睡眠周期是根据Feinberg和Floyd提出的标准来定义的。
3. 结果
3.1 慢波活动
在整个头皮上,儿童组的NREM SWA绝对值高于成人组。归一化后,SWA高于中后验区,额叶区更低,儿童组与成年组比较。我们在另外的探索性分析中分别关注N2或N3(补充图S1)和第一个睡眠周期(数据未显示),得到了类似的结果。
3.2 慢波密度和介入
绝对慢波密度和介入,儿童明显高于成人(图1,补充图S2)。在电极间归一化后,我们发现后部区域的密度和介入值明显更高,额叶区域的值更低。此外,我们发现慢波负振幅,下坡,以及上坡趋势显著高于成人(图1)。另一方面,儿童慢波全局度低于成人。鉴于慢波斜率和全球性被认为分别反映了短期和长期同步效率,我们进一步探讨了两个年龄组中这些属性之间的关系。经年龄调整后,成人慢波下坡与整体度呈正相关,儿童无显著正相关,组间相关系数差异显著。

图1 慢波密度,介入,全球性,振幅和斜率
3.3 慢波卷入的主成分分析
在儿童和成人中,大多数与慢波介入相关的差异都可以用3个PC来解释,其中最大的是在中央额叶区,前部或后部,以及左半球或右半球 (图2,补充图S4)。所有PCs均以额下区和颞下区慢波表达最大为特征,尽管它们在总体范围和相对分布上有所不同(也见补充图)。在儿童组中,与成人组相比,我们观察到第二个和第三PC可解释方差显著增加,以牺牲第一PC为代价(图2)。此外,在儿童中,由第一和第二PC解释的方差分别与年龄呈正相关和负相关。第三PC与年龄无相关性。在成年组中,所有PC均与年龄无关(图2)。

图2 基于PC的慢波介入分析
3.4 募集对称指数
左右对称(通道招募对称指数)在儿童和成人之间存在显著差异(图3)此外,在两组中,前通道计算的对称指数显著高于后通道计算的对称指数。交互作用显著。事实上,成人计算的前通道对称性指数比儿童高,后通道对称指数计算差异无统计学意义(图3)因此,相对于成人,儿童的前部慢波更不对称,而两组之间的后部半球不对称程度相似。

图3 慢波通道募集对称指数
3.5 慢波的起始和终止
而慢波终端的地形分布在儿童和成人之间没有显著差异,相对于儿童,慢波似乎更常起源于成人的额叶区(图4,附图S9-10)。在后侧电极中也观察到互补的统计趋势,显示儿童的起源概率高于成人。根据这些观察,我们发现儿童儿童和成人在前后轴上的概率起源峰的坐标有显著差异(图4)。各组(儿童、成人)与半球起源概率(左、右)存在显著交互作用。事实上,在儿童中,来自右半球的脑电波的百分比比来自左半球的脑电波的百分比略高,而在成人中则没有。源自右半球的慢波百分比在儿童中高于成人,而组间左半球慢波发生率无统计学差异(图4)。

图4 慢波的起源和终止
3.6 同步效率高低的慢波
对于每个慢波,根据平均斜率和参与电极的比例计算同步分数,作为慢波同步效率的衡量标准。两组的同步得分分布均为非高斯分布且右偏(图5)。然而,平均而言,儿童的同步得分高于成人。同步得分分布在NREM周期中保持相似,但也显示出明显的左移,与慢波振幅和全局的自稳态变化的影响相一致(图5)。因此,为了避免与自稳态变化相关的可能混淆,我们仅将进一步分析重点放在第一个NREM周期上。然后,我们对同步效率高(前10%)和中等(中10%)的慢波进行了分类和分别分析。考虑到慢波是根据其坡度和全局度进行分类的,我们首先分析了这两个参数对同步效率的相对贡献(补充图S11)。我们发现组(儿童,成人)和慢波亚型(中10%,前10%)之间没有显著的相互作用。然而,我们发现了显著的波的亚型主效应。这表明,与儿童相比,成人的慢波总体上更具全局性,并且波亚型的主要影响是两组的前10%慢波比中10%慢波更具全局性。
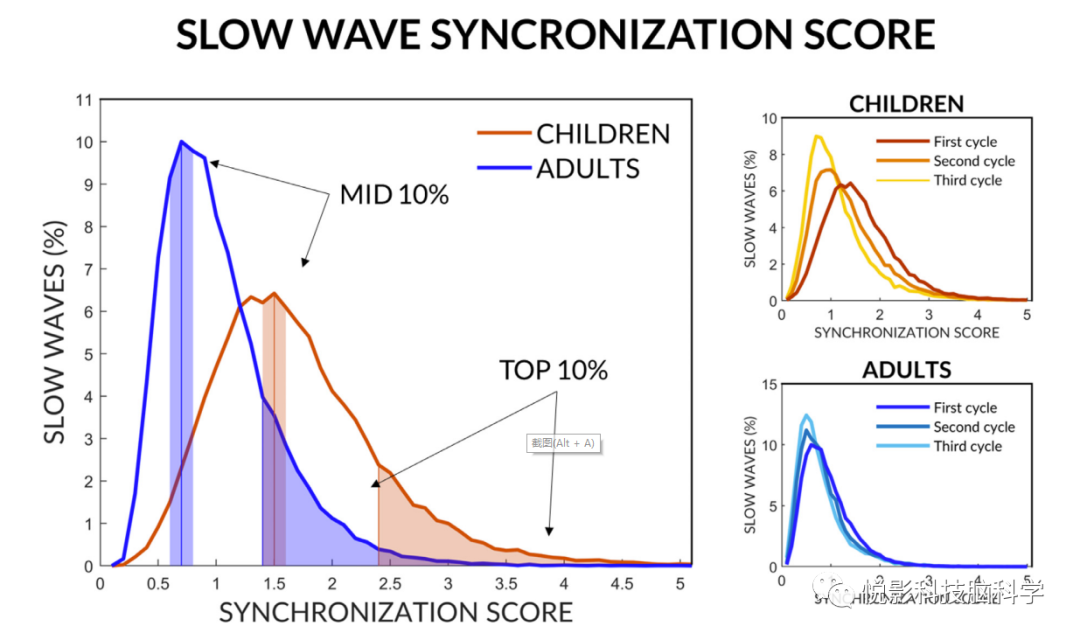
图5 慢波同步评分
然后,我们分析了慢波下坡,发现了显著的相互作用。我们还发现组的主效应,表明儿童慢波总体上比成人更陡峭,慢波亚型的主效应组显示前10%慢波比中10%慢波陡。然后分析和比较具有高同步效率和中等同步效率的慢波的概率起源和标准化头皮介入(图6)。在儿童中,中10%和前10%的慢波都比成人有更多的后侧介入。我们发现组(儿童,成人)和波类型(中10%,前10%)在额叶和顶枕簇有显著的交互。具体而言,在前10%的额叶集群中,成年人的介入值都高于儿童。此外,在同一簇内,成人的前10%慢波参与值明显高于中10%慢波参与值,而儿童的慢波参与值无统计学差异(图6C)。
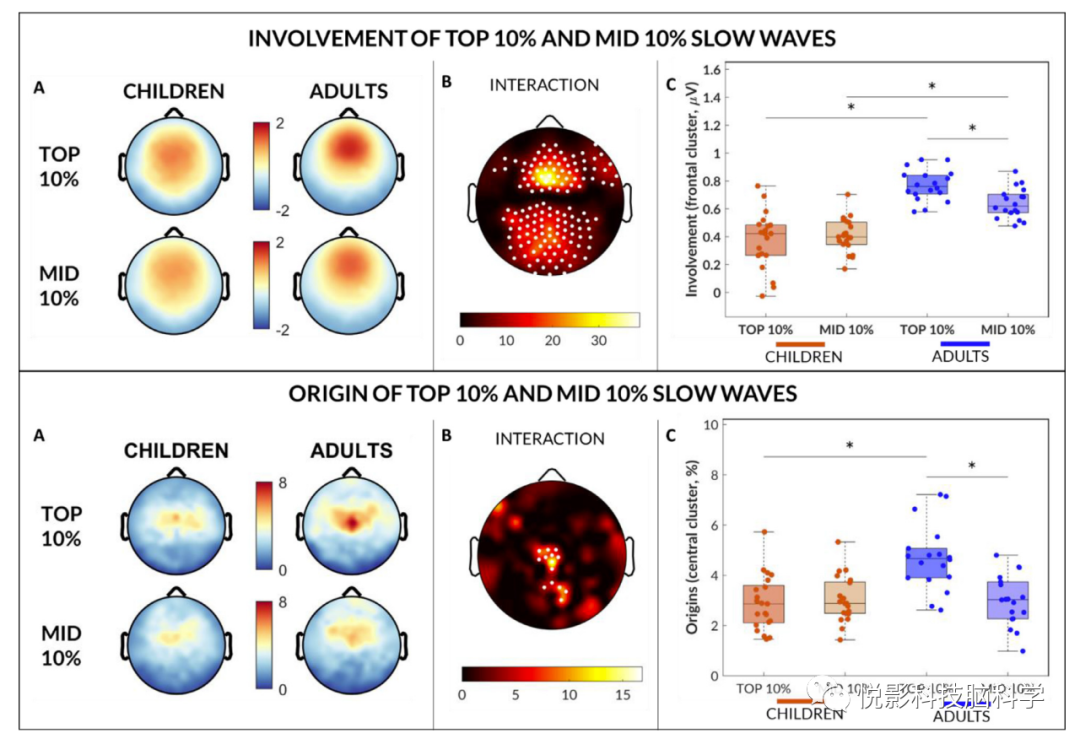
图6 具有高同步效率和中等同步效率的慢波的起源和参与
4. 讨论
在本研究中,我们使用睡眠hd-EEG检查了从童年到成年早期的慢波起源、同步和传播的变化。我们发现,从童年到成年:i)慢波的起源和地形分布都向更多的大脑前侧区域移动;Ii)慢波在半球间变得更加全局和对称;iii)以中高同步效率为特征的慢波(假定的I型和II型慢波)表现出部分解离的成熟变化。
4.1 从儿童期到成人期,慢波的起源和介入逐渐向前发展
先前的研究表明,在正常发育期间,SWA (δ功率)峰值会逐渐恶化。这种变化被认为反映了与额叶脑区成熟及其连通性相关的区域间慢波同步/传播的相对变化。最近,初步观察表明,产生慢波的区域倾向也可能随着儿童期到成年期的后-前梯度而变化。与以前的数据一致,我们目前的结果表明,与儿童相比,年轻人的大脑前部慢波分布(受累)和产生慢波的倾向(起源)都更强。此外,我们基于PCA的分析显示,慢波头皮地形倾向于遵循一组特定的模式,这对儿童和成人都是常见的,并且这些模式的相对“重量”在发育过程中会发生变化。事实上,无论年龄如何,与慢波受累相关的95%的方差都可以用3个PC来解释,其中最大值位于中央额叶区、前部或后部区域以及左半球或右半球。然而,从童年到成年,中央额叶PC的相关性似乎在增加,而牺牲了其他两个PC。这些观察结果表明,虽然大多数儿童和成人的慢波可能涉及特定的、部分重叠的大脑网络,但在发育过程中,他们“到达”更多前部区域的相对倾向会发生变化。
综上所述,我们的研究结果表明,与成年人相比,儿童额叶区产生和被来自其他地方的慢波穿过的倾向更低。这些变化可以部分反映不同的成熟过程,例如微观结构组织的局部变化和远程连通性的变化。
4.2 慢波半球间不对称在儿童中比在成人中更为明显
基于PCA的分析和半球间介入分析显示,与成人相比,儿童慢波的特点是更倾向于保持单侧或至少在左轴上更不对称。此外,介入不对称性在前区比后区更强。先前的研究表明,跨半球慢波传播的程度直接取决于半球间(胼胝体)连接的存在和完整性。事实上,胼胝体切除的成年癫痫患者的慢波(而不是纺锤波)通常仍然局限于它们起源的大脑半球,而这在未胼胝体切除的个体中相对罕见。基于这一观察,我们目前的结果可以用儿童胼胝体不完全成熟来解释。事实上,众所周知,胼胝体的大小在整个青春期直到20多岁中期都在增加,随着成熟的后-前梯度。
4.3 与成人相比,儿童的慢波更大,但不那么普遍
研究结果表明,儿童的慢波往往比成人的慢波更不对称,甚至是单半球的,与此一致的是,我们发现每个慢波(即全局)所涉及的通道数量在儿童中平均较小。因此,虽然儿童的慢波通常比成人的慢波更大、更陡,但它们也不那么普遍。此外,我们发现坡度和全局在成人中呈正相关,但在儿童中没有,这表明在发育早期,这些慢波特性之间存在分离。
4.4 儿童期到成年期慢波同步过程的成熟
先前的研究表明,成人向睡眠的过渡至少有两个主要阶段:i)早期阶段以大而广泛的(i型)慢波(可能包括经典定义的k -复合物)为主,这些慢波起源于躯体感觉运动区周围,并在额叶区域达到峰值;ii)晚期阶段以浅的、局部的(ii型)慢波为主,其起源和分布各不相同。这种时间分离被认为反映了不同同步过程的存在——一个高效的皮层下-皮层过程和一个低效的皮层-皮层过程——在清醒-睡眠转换的不同时刻起作用。然而,重要的是,最近的研究表明,儿童在睡眠开始时同步过程I和II之间的时间分离是不存在的。与此一致,这里我们发现以高同步效率(假定的I型)为特征的慢波在儿童中不存在与成人相同的起源和分布。具体来说,假定的儿童I型慢波在成人中通常观察到的中央额叶电极中没有明确的起源热点,并且主要是后部而不是前部受累。换句话说,虽然比大多数慢波更大、更陡、更全面,但儿童的高度同步慢波在起源和参与方面与大多数其他(II型)慢波几乎没有区别。
5. 结论
综上所述,目前的研究结果表明,对慢波特性的详细描述可能为儿童期和青春期大脑形态功能适应提供有价值的信息,这些信息可以扩展和补充从简单的SWA (δ功率)评估中得出的结果。此外,我们提供的证据支持至少存在两种慢波亚型,其特征是不同水平的同步效率,并表明这些波经历部分不同的成熟变化。鉴于先前的观察表明,这些慢波亚型的产生可能分别取决于皮质下-皮质和皮质-皮质同步机制,我们目前的结果表明,它们的单独评估可以提供关于不同解剖功能脑网络成熟的有价值的解读。总的来说,目前的数据支持这样一种观点,即睡眠构成了观察和跟踪大脑生理适应及其中断的独特窗口,有助于为临床人群的病理发展提供准确的衡量标准。事实上,例如,不同慢波亚型的特定变化可以与病理状态下特定大脑结构或网络的变化联系起来(从而跟踪)。在这方面,I型波成熟的改变,这应该反映了上升,觉醒相关系统的参与,可能特别发生在这些结构出现功能改变的情况下。
参考文献:Origin, synchronization, and propagation of sleep slow waves in children.







 研究通过高密度脑电图分析发现,儿童的睡眠慢波活动在起源、同步和传播方面与成人存在显著差异,表现为儿童的慢波更大、更陡,但分布范围较小,且更倾向于后脑区起源。随着年龄增长,慢波活动从前至后的分布变化反映了大脑的成熟过程,包括皮质-皮质和皮质下-皮质连接的发展。同步效率高的慢波在儿童中表现出不同于成人的模式,这可能与大脑的不同同步机制和发育阶段相关。这些发现为评估和理解生理及病理发育提供了新视角。
研究通过高密度脑电图分析发现,儿童的睡眠慢波活动在起源、同步和传播方面与成人存在显著差异,表现为儿童的慢波更大、更陡,但分布范围较小,且更倾向于后脑区起源。随着年龄增长,慢波活动从前至后的分布变化反映了大脑的成熟过程,包括皮质-皮质和皮质下-皮质连接的发展。同步效率高的慢波在儿童中表现出不同于成人的模式,这可能与大脑的不同同步机制和发育阶段相关。这些发现为评估和理解生理及病理发育提供了新视角。

















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








