文献介绍

文献题目: 产后猪肝脏发育的单细胞动力学
研究团队: 黄路生(江西农业大学)
发表时间: 2023-11-15
发表期刊: Science Bulletin
影响因子: 18.9(2023年)
DOI: 10.1016/j.scib.2023.09.021
摘要
作为代谢和免疫的重要器官,肝脏的出生后发育在单细胞分辨率下的特征仍然不明确。本研究通过生成 84,824 个猪肝细胞在四个出生后时间点(第 30 天、42 天、150 天和 730 天)的单核和单细胞转录组数据,揭示了 23 种细胞类型,其中包括三种稀有细胞类型:浆细胞样树突状细胞、CAVIN3+IGF2+内皮细胞和EBF1+成纤维细胞。后两种细胞通过多重免疫组化技术得到验证。轨迹和基因调控分析揭示了 33 个与肝细胞发育和功能相关的转录因子编码基因,其中包括参与调控肝脏代谢的 NFIL3。作者表征了肝脏内皮细胞的时空异质性,并鉴定并验证了亮氨酸拉链蛋白 2(LUZP2)作为一种新型成年肝窦内皮细胞特异性转录因子。从第 30 天起,淋巴样细胞(NK 细胞和 T 细胞)主导了猪肝脏的免疫系统。此外,作者发现了一群组织驻留的 NK 细胞,它们表现出病毒防御功能,在第 730 天仍保持增殖特征,并且在人类肝脏中表现出比小鼠肝脏更高的保守转录因子表达模式。本研究提供了最全面的出生后肝脏发育单细胞图谱,并展示了四个年龄阶段的代谢和免疫变化。
前言
肝脏执行多种与代谢和免疫相关的重要功能,包括脂质和脂肪酸代谢、蛋白质合成、胆汁生成以及免疫防御和耐受。肝脏的基本解剖单位是六边形的肝小叶,其特征是每个角落都有一个由肝门静脉(PV)、肝动脉和胆管组成的门管三联体,以及每个中心有一条中央静脉(CV)。来自肝动脉的富氧血液与来自 PV 的富含营养的血液混合,通过窦状毛细血管流向 CV,形成梯度化的肝小叶微环境,从而促进肝脏的分区化。肝细胞约占肝脏质量的 80%,而非实质细胞(NPCs)如内皮细胞、肝星状细胞(HSCs)和免疫细胞在空间上具有异质性,并沿肝小叶的 CV-PV 轴分区化。
在胚胎小鼠中,肝脏从胚胎第 10.5 天(E10.5)到 E16.5 期间成为主要的造血部位,随后在成年期转变为关键的代谢和免疫器官。小鼠肝脏从出生后第 0 天到成年期的免疫细胞组成和代谢基因表达谱在整体水平上发生了变化。然而,在单细胞水平上,出生后肝脏代谢成熟和免疫系统的广泛变化以适应外部环境的过程仍不明确。
单细胞 RNA 测序(scRNA-seq)技术已被广泛应用于构建细胞图谱以及研究发育、生理和疾病。关于肝脏发育,scRNA-seq 已被广泛用于研究胚胎期间实质细胞和非实质细胞谱系的出现以及不同细胞类型之间的通讯。目前只有两项研究在小鼠中以单细胞分辨率报道了出生后肝脏发育。此外,单核 RNA 测序(snRNA-seq)在检测肝脏中大型、脆弱和稀有的细胞类型(如肝细胞、胆管细胞和 HSCs)方面具有其独特的优势。同时,scRNA-seq 能够识别组织驻留的免疫细胞。因此,结合 snRNA-seq 和 scRNA-seq 有助于构建发育过程中全面的肝脏图谱。
猪肝脏由六个叶组成:右外侧叶(RLL)、右内侧叶(RML)、左外侧叶(LLL)、左内侧叶、方叶和尾状叶。在本研究中,作者采用 snRNA-seq 和 scRNA-seq 对来自七只健康猪的 11 个肝脏 RLL 样本在四个时间点(哺乳期:第 30 天,D30;断奶后:D42;快速生长期:D150;成年期:D730)的 84,824 个核/细胞进行了分析,并鉴定了 23 种细胞类型,揭示了所有肝脏细胞类型。作者观察到高度异质性的肝细胞,构建了肝细胞发育轨迹,并通过基因调控网络分析鉴定了 33 个参与调控肝细胞发育的转录因子(TFs)。作者鉴定出亮氨酸拉链蛋白 2(LUZP2)作为一种新型成年肝窦内皮细胞特异性 TF,并在六项额外的生物学试验中进行了验证,进一步通过多重免疫组化(mIHC)实验支持了这一发现。作者还研究了肝脏内皮细胞的时空异质性。随后,作者表征了广泛的免疫细胞群体,其中淋巴样细胞从 D30 起主导了肝脏免疫系统。此外,通过细胞间通讯分析,作者发现肝细胞与其他 NPCs(包括肝窦内皮细胞(LSECs)、HSCs和库普弗细胞)协同调控肝脏发育。本研究提供了出生后肝脏发育的全面单细胞分辨率图谱。
研究结果
1. 整合发育中的肝脏的 scRNA-seq 和 snRNA-seq 图谱
为了表征发育中猪肝脏的细胞景观,作者从四个时间点(D30、D42、D150、D730)生成了单核和单细胞转录组数据(Fig. 1a)。经过严格的质量控制,作者保留了使用 10× Chromium 平台捕获的 32,131 个核(每个核中位基因数为 1,389)的表达数据,以及使用 SeekOne 平台捕获的 52,693 个细胞(每个细胞中位基因数为 696)的表达数据(Table S1)。首先,作者在平台内进行了标准化、聚类、降维和注释(Fig. S1a, b)。然后,作者使用 MNN 批次校正整合了两个平台的数据(Fig. 1b and S1c, d),并保留了平台内的注释。基于经典标记基因,作者鉴定了 23 种细胞类型(Fig. 1c),包括肝细胞、胆管细胞、内皮细胞、间充质细胞、髓样细胞、淋巴样细胞和红细胞。同一细胞类型在不同年龄阶段表现出相似的标记基因表达,例如肝细胞中的肝细胞核因子 4α(HNF4A)、肝窦内皮细胞中的 STAB2 以及肝星状细胞(HSCs)中的凝集素亚家族成员11(COLEC11)(Fig. S1e)。此外,snRNA-seq 数据涵盖了肝脏中的主要细胞类型,而 scRNA-seq 数据则捕获了大多数免疫细胞类型。随后,作者利用 snRNA-seq 数据探索了发育过程中细胞组成的变化,这些数据被认为最能反映体内观察到的细胞比例。每种细胞类型的比例在不同时间点有所变化(Fig. 1d)。此外,作者观察到肝细胞比例随时间呈下降趋势,而肝窦内皮细胞比例呈上升趋势,这与小鼠肝脏的研究结果一致。
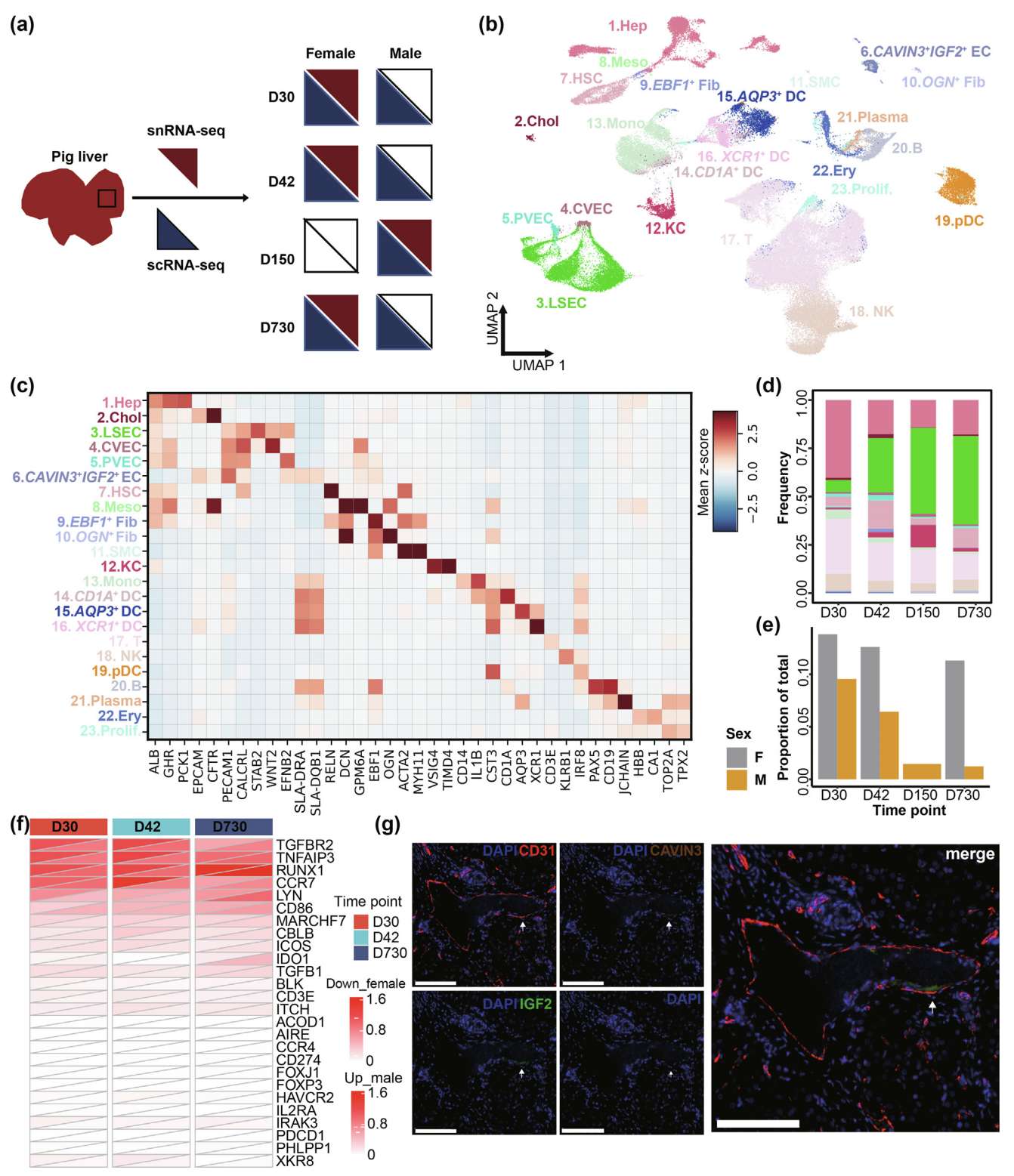
Fig. 1. scRNA-seq 和 snRNA-seq 在发育中的肝脏中识别出肝细胞类型
(a) 实验设计示意图。
(b) 84,824 个细胞/核的 UMAP 可视化,按 23 种细胞类型着色。
(c) 热图展示所有鉴定细胞类型的手动选择标记基因。
(d) 使用 snRNA-seq 数据按时间点展示的细胞类型组成。细胞类型颜色编码与 Fig. 1b 中的 UMAP 一致。
(e) 条形图展示 pDC 在不同性别和时间点中的比例分布。
(f) 热图展示 pDC 在不同时间点和性别中与耐受诱导(GO: 0002507)相关基因的表达。
(g) 出生后第 243 天(D243)猪肝脏 RLL 的多重免疫组化(mIHC)染色,使用 CD31(红色)、IGF2(绿色)、CAVIN3(棕色)和DAPI(蓝色)抗体。比例尺为100 μm。
作者观察到两种稀有细胞类型。第一种是从 scRNA-seq 数据中发现的肝脏中罕见的先天免疫细胞群,即浆细胞样树突状细胞(pDCs,4222 个细胞),通过高表达的 B 细胞连接蛋白(BLNK)得以确认(Fig. S1f, g)。pDCs 在所有时间点中雌性比例均高于雄性,并且在两性中均呈现随时间下降的趋势(Fig. 1e)。pDCs 与性别偏倚的自身免疫性疾病相关的肝脏耐受性特性有关;因此,作者进一步探索了耐受诱导(GO: 0002507)相关基因在不同性别和时间点的表达特征。作者观察到在第 30 天和第 42 天,雄性中与耐受诱导相关的基因(TGFBR2、CCR7 和 LYN)表达水平高于雌性;然而,在第 730 天观察到相反的模式(Fig. 1f),这可能为自身免疫性疾病的研究提供线索。第二种是一小群特殊的肝内皮细胞(856 个细胞),主要分布在 D150 和 D730,特异性存在于 scRNA-seq 数据中,其特征是高表达血小板和内皮细胞粘附分子1(PECAM1)、小窝相关蛋白3(CAVIN3)和胰岛素样生长因子2(IGF2)(Fig. S1f, g),并通过多重免疫组化(mIHC)实验验证(Fig. g)。通路富集分析显示,这些细胞参与内皮发育、迁移和分化(Fig. S1h)。此外,这些细胞高表达主要组织相容性复合体II类分子(SLA-DRA 和 SLA-DQB1)(Fig. 1c),表明其具有抗原呈递功能。本研究通过结合 scRNA-seq 和 snRNA-seq,提供了出生后肝脏发育的全面图谱。
2. 鉴定细胞类型特异性转录因子在调节肝脏发育中的作用
为了识别负责出生后肝脏发育过程的关键调控因子(regulators),作者使用 snRNA-seq 数据计算了 1839 个TF 编码基因的细胞类型特异性 tau 评分,并鉴定出 190 个评分 >0.85 的 TFs,表明这些 TFs 对肝脏中的主要细胞类型具有高度特异性(Fig. 2a, Table S2)。在这些 TF 编码基因中,涵盖了已知的调控因子:对肝细胞分化和形态至关重要的 HNF4A、对胆管细胞重要的 HNF1B、对肝窦内皮细胞(LSECs)重要的核受体亚家族5组成员2(NR5A2)、对肝星状细胞(HSCs)重要的心脏和神经嵴衍生物表达2(HAND2),以及对间皮细胞重要的LIM同源盒9(LHX9),以及许多未表征的 TFs,如 LSECs 特异性的 LUZP2。作者的数据允许研究不同时间点的 TF 表达。关于 LSECs 特异性 TF 编码基因,NR5A2 和 ERG 随时间表现出相对较高的表达,而 LUZP2 在第 30 天和第 42 天表达非常低,但在第 150 天和第 730 天表达较高(Fig. 2b),表明它们在肝脏发育过程中功能不同。为了验证 LUZP2 的表达模式,作者对来自不同时间点和解剖区域的六个独立样本进行了 snRNA-seq 分析:E30 的全肝脏、E110 的 RLL 和 RML、D240 的 RLL 和 LLL,以及 D488 的 RML。这些细胞类型基于经典标记基因进行注释(Fig. S2a)。结果显示,胚胎期的 LSECs 表现出低表达,而成体期的 LSECs 无论解剖区域如何均表现出高表达的 LUZP2(Fig. 2c)。此外,作者从 D240 肝脏生成了 snATAC-seq 数据,并基于标记基因活性评分进行注释(Fig. S3a)。在先前鉴定的细胞类型特异性 TF 编码基因中,作者观察到肝细胞中 PPARA 和 AR 位点、库普弗细胞中 CUX1 位点、HSCs 中 HAND2 和 LHX2 位点的开放染色质峰(Fig. S3b)。结果还显示 LSECs 中 LUZP2 位点的开放染色质峰(Fig. 2d)。此外,D243 猪肝脏中 LUZP2 和 CD31 的多重免疫组化(mIHC)实验证实了这两种基因在成年 LSECs 中的共表达,但在其他细胞类型中几乎没有表达,为作者的 snRNA-seq 结果提供了正交验证(Fig. 2e)。综上所述,单细胞多组学数据分析和 mIHC 实验结果揭示了一种先前未表征的成年 LSECs 特异性 TF LUZP2。
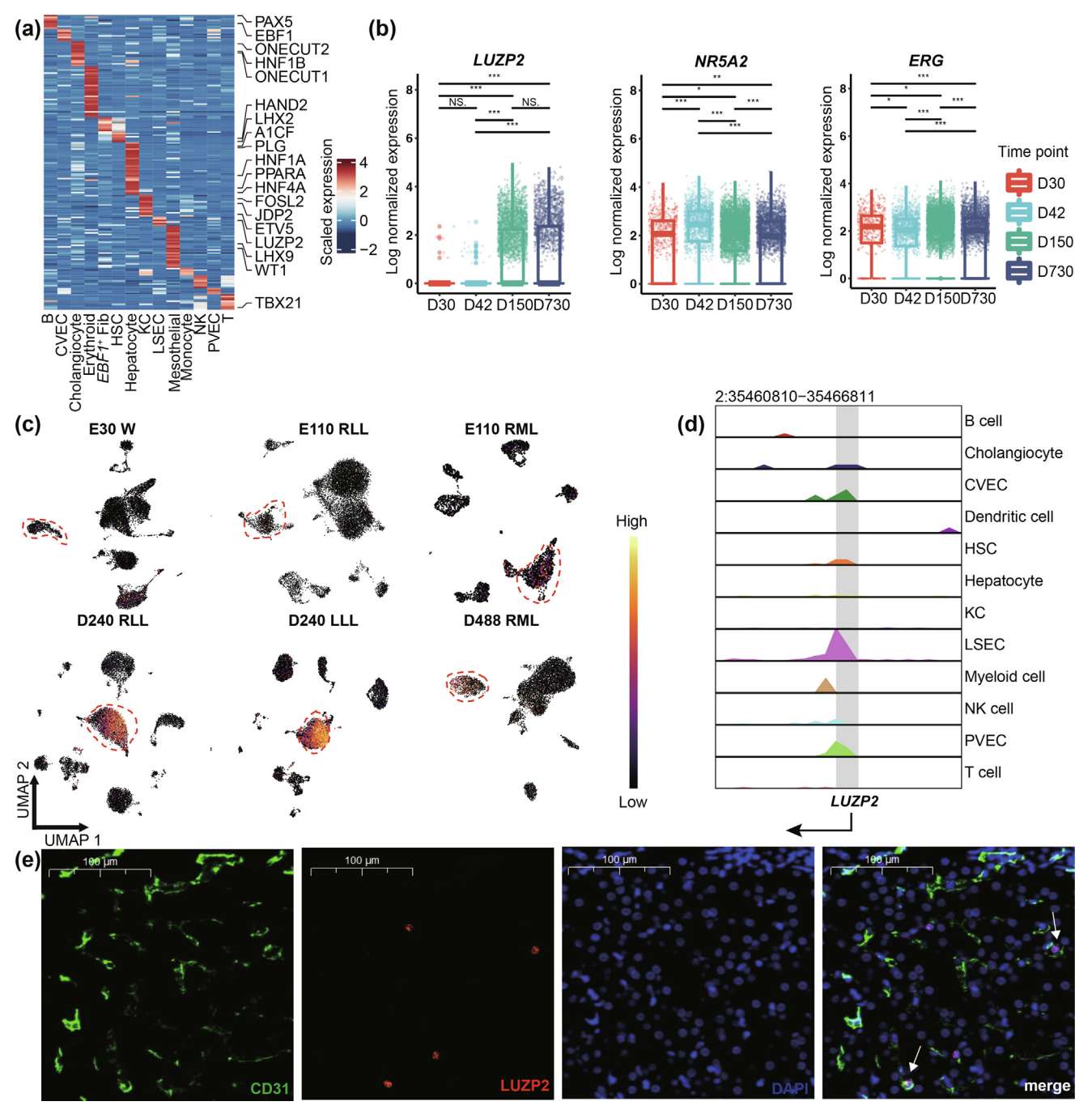
Fig. 2. 主要肝细胞类型的细胞类型特异性 TFs
(a) 热图展示通过 snRNA-seq 鉴定的每种细胞类型特异性 TF 编码基因的标准化表达。文献中报道的 TFs 已高亮显示。
(b) 箱线图展示三种 LSEC 特异性 TF 编码基因(LUZP2、NR5A2、ERG)在不同时间点的对数标准化表达水平。星号表示基于 Student's t 检验的统计显著性。∗ P < 0.05;∗∗ P < 0.01;∗∗∗ P < 0.001;NS.,P > 0.05。
(c) 六个额外样本中 LSEC 的 LUZP2 表达概况,涵盖四个时间点和四个解剖部位。红色虚线框内为 LSEC。W,全肝脏;RLL,右外侧叶;RML,右内侧叶;LLL,左外侧叶。
(d) ArchR 轨迹可视化展示 D240 LLL 中每种细胞类型在 LUZP2 位点的 snATAC-seq 信号聚合情况。
(e) 出生后第 243 天(D243)猪肝脏 RLL 的多重免疫组化(mIHC)染色,使用 CD31(绿色)、LUZP2(红色)和 DAPI(蓝色)抗体。比例尺为 100 μm。
除了基于表达的细胞类型特异性 TFs 外,作者还使用 pySCENIC 对相同数据进行了基因调控网络分析。作者通过计算 Suo et al. 提出的 RSS 来评估与每种主要细胞类型相关的活性。基于默认阈值,作者捕获了 39 个细胞类型特异性调控子(Fig. S3c)。在肝细胞中,作者的分析鉴定出了 PPARGC1A 的调控子,这是糖异生的关键调控因子。在 LSECs 中,作者的分析预测了 LUZP2 的调控子,其多个靶基因(包括 CDH7、PLCB4 和 KIT)参与了 Hippo 信号通路(Fig. S3d),这是一种进化上保守的信号通路,因其通过调控细胞增殖和凋亡来调节器官大小的显著能力而受到广泛关注。此外,先前的研究表明,小鼠肝脏重量在出生后早期增加,并在出生后第八周趋于稳定。结合 LUZP2 在早期和成年阶段表达模式的显著对比(Fig. 2b),作者提出 LUZP2 可能与出生后肝脏大小和生长的调控有关,为肝脏发育生物学中的基本问题提供了新的见解。
3. 发育过程中的肝细胞异质性
肝细胞在出生后期间执行多种代谢功能。为了阐明肝细胞在出生后发育过程中的异质性,作者检查了从 D30 到 D730 的所有肝细胞。这些细胞主要按时间点聚类(Fig. S4a)。作者鉴定了九个亚型,并用具有不同功能的特定标记基因进行注释(Fig. 3a)。首先,作者观察到主要来自 D30 的 Hep1 表现出高表达水平的去饱和酶脂肪酸去饱和酶1(FADS1)和脂肪酸去饱和酶2(FADS2),这些酶参与长链多不饱和脂肪酸(LC-PUFAs)的生物合成过程(Fig. 3b)。此外,作者鉴定出两个主要来自 D730 的细胞群(Hep5 和 Hep6),它们参与催化长链饱和脂肪酸(LC-SFAs)的生物合成,并特异性高表达脂肪酸合成酶(FASN)(Fig. 3b)。Hep6 通过特异性表达热休克蛋白 DNAJC12 增强了其功能(Fig. 3b)。因此,哺乳期和成年期的猪在能量需求和生长状态上存在差异,导致脂肪酸合成的不同。
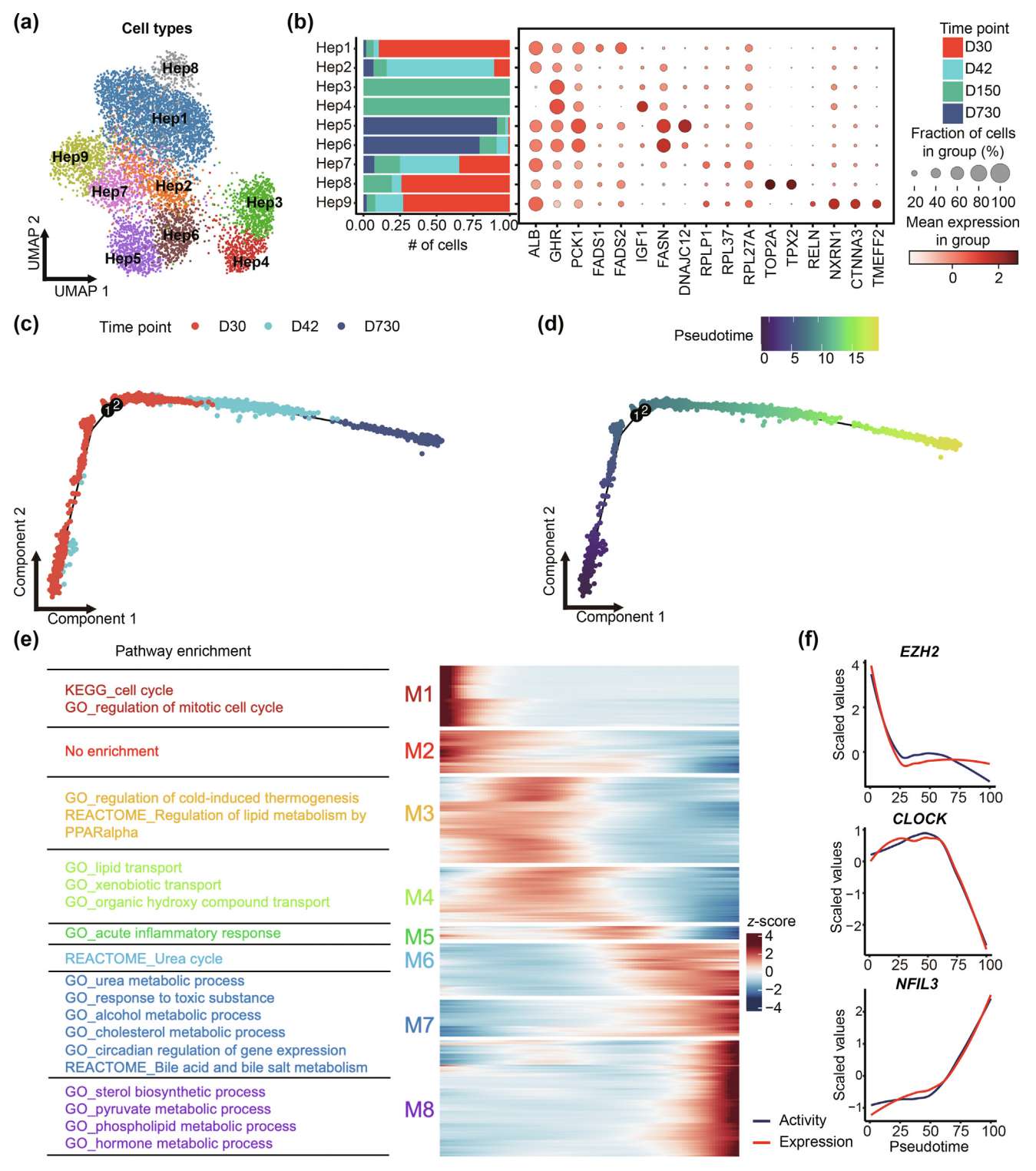
Fig. 3. 发育过程中明显的肝细胞异质性和动态 TF 活动
(a) 所有肝细胞的 UMAP 嵌入图,按注释的亚型着色,包括Hep1、Hep2、Hep3、Hep4、Hep5、Hep6、Hep7、Hep8、Hep9。
(b) 左侧面板展示每个肝细胞亚型的时间点组成条形图。右侧面板展示每个亚型选定基因的点图。点的大小表示检测到基因的细胞比例,点的颜色表示基因表达水平。
(c, d) 肝细胞发育轨迹,按时间点(c)和伪时序(d)着色。
(e) 热图展示显著基因作为从(d)推断的伪时序函数的趋势。基因根据表达谱分为八个模块。左侧显示每个模块的富集通路。
(f) 沿伪时序的指定 TFs(包括 EZH2、CLOCK 和 NFIL3)的标准化表达和活性值的拟合曲线。从(d)推断的伪时序从 0 拉伸到 100。
作者鉴定出一种罕见的肝细胞亚型(Hep9),主要分布在 D30 和 D42。Hep9 细胞共表达静止 HSC 标记基因 reelin(RELN)、neurexin 1(NRXN1),并且高表达钙粘蛋白相关蛋白 catenin alpha 3(CTNNA3)和跨膜蛋白 TMEFF2(Fig. 3b)。此外,每个细胞表达的基因数量低于其他肝细胞亚型,且每个细胞的预测双细胞评分低于 0.1(Fig. S4b),表明这是一个转录组学上独特的中间亚型,而不是肝细胞和 HSCs 的双细胞。基因功能富集分析显示,Hep9 细胞的差异表达基因在发育过程和细胞迁移调控中富集(Fig. S4c)。
来自 D150 雄性猪的 Hep3 和 Hep4 细胞与来自雌性的其他亚型相距较远(Fig. 3b)。它们还表现出比其他肝细胞亚型更低的 Albumin(ALB,肝细胞的标志物)表达(Fig. 3b),可能是由于性别偏倚的基因表达。此外,Hep4 特异性表达参与支持生长和代谢的胰岛素样生长因子1(IGF1)(Fig. 3b)。此外,作者在D30、D42,尤其是 D150 检测到增殖的肝细胞(TOP2A 和 TPX2)(Hep8)(Fig. 3b),反映了一小部分肝细胞在成年阶段保留了增殖能力。作者还鉴定了具有活跃蛋白质翻译功能的肝细胞亚型(Hep7)(Fig. 3b)以及参与内质网应激反应的肝细胞亚型(Hep2)(Fig. S4d)。这些结果揭示了高度异质性的肝细胞,揭示了发育中肝脏的中间状态。
为了理解出生后猪肝脏发育过程中肝细胞的转录组动态,作者对来自 D30、D42 和 D730 的肝细胞进行了轨迹分析,将性别因素考虑在内以重建肝细胞发育轨迹。作者利用 2000 个高变基因作为排序基因进行降维和轨迹分析。作者定义了轨迹的根,其中来自早期发育阶段(D30)的肝细胞富集(Fig. 3c, Fig. S4e)。此外,D30 的肝细胞在肝脏质量增长期间高度增殖,而在健康成年肝脏中则处于静止状态,增殖率极低(Fig. S4f)。推断的肝细胞伪时序与相应个体的年龄高度一致(Fig. 3d and Fig. S4g, h)。基于肝细胞的发育轨迹,作者进行了差异基因表达分析,鉴定出 5693 个基因,其表达随伪时序显著变化(Table S3)。选定的基因根据伪时序表达模式分为八个模块(Fig. 3e)。作者使用 clusterProfiler 对每个模块进行了通路富集分析,利用 GO、KEGG 和 Reactome 数据库。在轨迹末端高表达的基因在多个代谢相关通路中富集,包括尿素循环、酒精代谢过程和激素代谢过程(Fig. 3e),表明肝细胞的代谢功能逐渐成熟。
为了进一步识别调控肝细胞发育的 TFs,作者对上述肝细胞进行了基因调控网络分析。33 个 TFs 表现出与伪时序显著相关的表达和调控子活性(Fig. S3i, j),包括参与调控小鼠出生后肝细胞成熟时间的 EZH2,其在起始阶段表现出较高的表达和活性(Fig. 3f)。Clock circadian regulator(CLOCK)与昼夜节律的调控相关,其表达和活性在早期阶段增加,然后在晚期阶段减少(Fig. 3f)。此外,NFIL3 参与调控脂质和葡萄糖稳态、胆汁代谢和外源物质代谢,其表达和活性在晚期阶段显著增加(Fig. 3f)。这些结果反映了这些 TFs 在肝细胞发育过程中的动态作用。
4. 时空分析揭示了 LSEC 沿发育的肝内皮分区模式和功能变化
肝脏内皮细胞在空间上具有异质性,并沿肝小叶的 CV-PV 轴功能分区化。作者将 11,086 个由 PECAM1 和降钙素受体样受体(CALCRL)标记的内皮细胞聚类为八个不同的亚型(Fig. 4a),并根据标记基因表达对细胞 cluster 进行注释(Fig. 4b):门静脉内皮细胞(PVEC)通过表达 CD34、von Willebrand 因子(VWF)、间隙连接蛋白α5(GJA5);中央静脉内皮细胞(CVEC)通过表达 VWF、Wnt家族成员2(WNT2)、Wnt家族成员9B(WNT9B)、R-Spondin 3(RSPO3);肝窦内皮细胞(LSECs),包括 LSEC1、LSEC2、LSEC3、LSEC4,表达 STAB2、stabilin 1(STAB1)、甘露糖受体C型1(MRC1)、Fcγ受体IIb(FCGR2B)和C型凝集素结构域家族4成员G(CLEC4G);增殖细胞(Prolif)通过表达 TPX2 和TOP2A,主要来自 D30 和 D42;以及一个 APOE 高表达(APOE+ LSEC)类群,表达参与凝血调控的APOE(Fig. S5a),其比例从 D30 到 D730 增加(Fig. 4b)。LSECs 占整个肝脏内皮细胞群体的主要比例(Fig. 4a),与先前的研究一致。此外,在肝脏发育过程中,LSECs 是转录组上最多样化的内皮亚型,与 PVEC 和 CVEC 相比。因此,为了阐明 LSECs 在发育过程中的功能变化,作者对 D30 和 D42 之间以及 D42 和 D730 之间的 LSECs 进行了差异基因表达分析。基因功能分析显示,D42 LSECs 中上调的基因在防御反应、免疫系统过程调控和白细胞激活中富集(Fig. 4c)。此外,D730 LSECs 中上调的基因参与脂质生物合成过程、血管通透性调控和 N-乙酰神经氨酸代谢过程(Fig. 4d)。这些结果揭示了断奶后仔猪 LSECs 的活跃免疫反应以及 LSECs 在成年肝脏代谢中的关键作用。
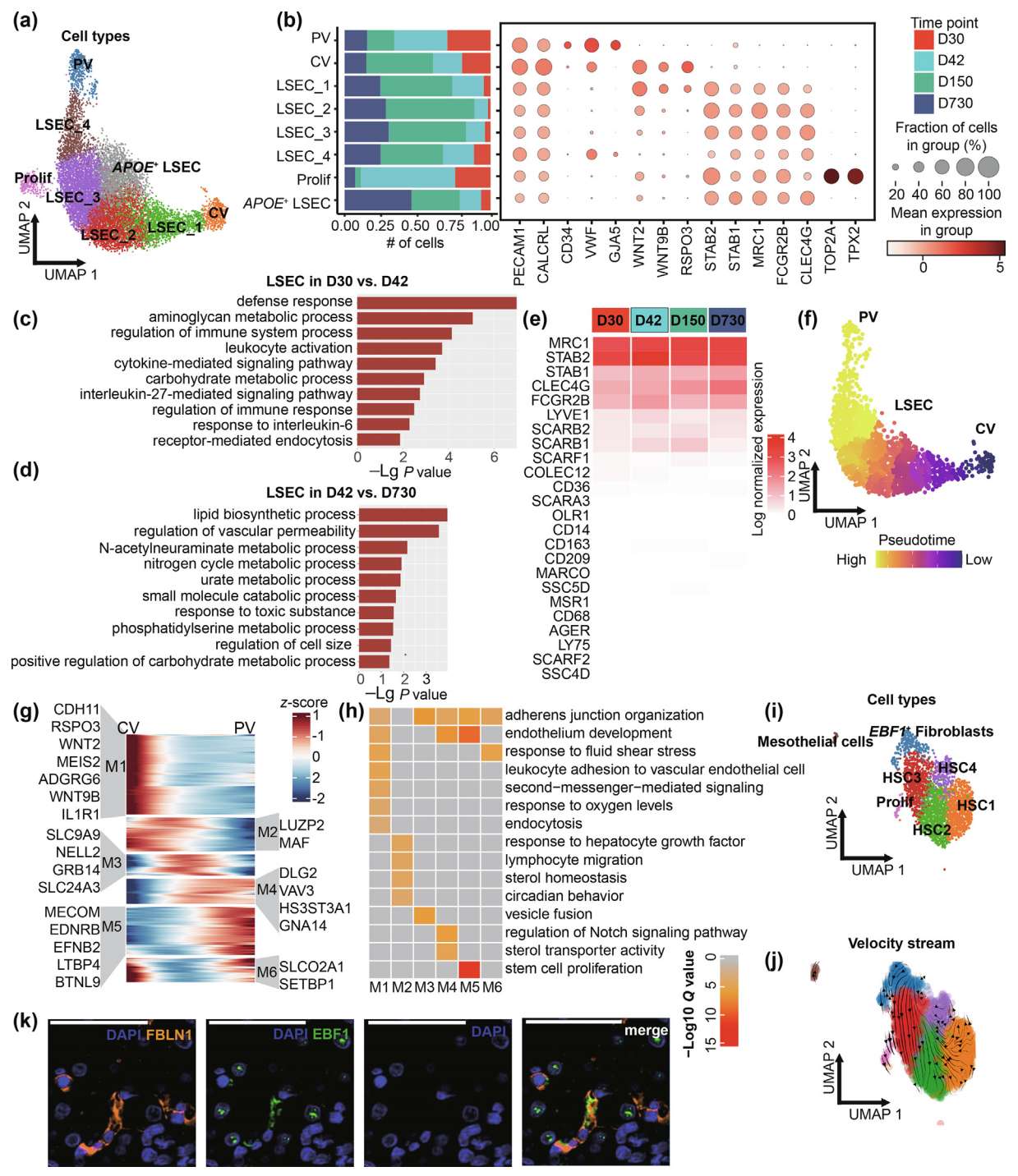
Fig. 4. 发育中的肝脏和间质细胞多样性中内皮细胞的时空异质性
(a) 所有内皮细胞的 UMAP 嵌入图,按注释的亚型着色,包括 CV、PV、LSECs(包括 LSEC1、LSEC2、LSEC3、LSEC4)、APOE+ LSEC 和增殖细胞(Prolif)。
(b) 左侧面板展示每个内皮亚型的时间点组成条形图。颜色表示时间点。右侧面板展示每个亚型选定标记基因的点图。点的大小表示检测到标记基因的细胞比例,点的颜色表示平均基因表达水平。
(c, d) D30 和 D42 之间以及 D42 和 D730 之间前 200 个差异表达基因的基因功能分析。(c)中高亮显示 D42 上调的通路,(d)中高亮显示 D730 上调的通路。
(e) 热图展示 LSECs 在不同时间点的显著受体基因平均表达。
(f) 来自 D730 的内皮细胞的 UMAP 嵌入图,按沿 CV-PV 轴的分区分析推断的伪时序着色。
(g) 热图展示 1831 个沿 CV-PV 轴梯度表达的基因。基因分为六个模块。
(h) (g)中每个模块的富集通路。
(i) 所有间充质细胞的 UMAP 嵌入图,按注释的亚型着色,包括 EBF1+ 成纤维细胞、肝星状细胞(HSC1、HSC2、HSC3、HSC4)、间皮细胞和增殖细胞(Prolif)。
(j) 间充质亚型的 RNA 速率分析。
(k) 出生后第 243 天(D243)猪肝脏 RLL 的多重免疫组化(mIHC)染色,使用 EBF1(绿色)、FBLN1(橙色)和 DAPI(蓝色)抗体。比例尺为50 μm。
作者探索了 LSECs 中 24 个显著受体基因的表达水平,以进一步研究 LSECs 在发育过程中的清除功能。作者观察到 MRC1、STAB2、STAB1、CLEC4G、FCGR2B 是猪 LSECs 中显著的内吞受体基因,而其他受体基因表达非常低(Fig. 4e)。作者发现,与清除变性胶原相关的 MRC1 和参与氧化低密度脂蛋白摄取的 STAB2 在不同时间点均高表达,从而维持肝脏稳态。此外,负责清除免疫复合物的 FCGR2B 在 D42 表现出更高的表达,这与之前在 D42 上调的通路富集结果一致。CD36 是人类肝窦内皮细胞的可靠标记基因,负责识别特定的氧化磷脂和脂蛋白,但在猪 LSECs 中未检测到表达。然而,CD36 在猪 Kupffer 细胞中在不同时间点表现出相对较高的表达水平(Fig. S5b),符合脊椎动物废物清除的双细胞原则。这些结果表明,猪 LSECs 在发育过程中保留了显著的清除功能,并且猪 LSECs 和 Kupffer 细胞可能具有互补的清除功能。
认识到肝脏生理和病理生理可能具有区域特异性,作者分析了内皮分子分区特征,特别关注具有功能分区窦状结构的 D730。作者通过伪时序(代表伪空间)对 D730 的肝脏内皮细胞沿 CV-PV 轴进行排序(Fig. 4f)。作者鉴定了 1831 个沿 CV-PV 轴梯度表达的显著基因,包括 127 个 TFs 和 41 个转运蛋白(Table S4)。随后,作者将相同的流程应用于最近报道的健康人类肝脏数据集,发现了 1752 个显著基因,包括 183 个 TFs 和 52 个转运蛋白(Fig. S5c, d and Table S4)。肝脏内皮分区模式在猪和人类之间是保守的。然而,分区基因高度分化,只有一小部分分区基因在物种间保守(约15%)(Fig. S5e)。作者观察到猪和人类门静脉周围区域的标记基因(EFNB2、BTNL9、LTBP4、EDNRB)是保守的(Fig. 4g)。作者还在中央静脉周围区域观察到粘附 G 蛋白偶联受体G6(ADGRG6)和白细胞介素1受体类型1(IL1R1)。在已知调控 LSECs 分化的TFs中,MAF 和 Meis homeobox 2 (MEIS2) 在猪和人类中均位于中央静脉周围区域。此外,新鉴定的成年 LSEC 特异性 TF 编码基因 LUZP2 也位于中央静脉周围区域。此外,基因功能分析显示,中央静脉周围内皮模块(M1 和 M2)富集了参与白细胞粘附于血管内皮细胞、对肝细胞生长因子的反应以及对氧水平反应的基因,这与中央静脉周围区域的缺氧微环境一致(Fig. 4h)。门静脉周围内皮模块(M4 和 M5)富集了参与 Notch 信号通路调控的基因,这与 Notch 信号在协调单核细胞募集和 Kupffer 细胞分化中的核心作用一致。因此,作者的分析表明,尽管内皮分区模式是跨物种的共同特征,但人类和猪之间功能分区基因表达谱的进化保守性有限。
5. 鉴定发育中的肝脏中 EBF1+ 成纤维细胞
间充质细胞在肝脏生理和纤维化过程中发挥重要作用,尤其是肝星状细胞(HSCs),它们在生理条件下储存维生素 A 并调节窦状循环。作者重新聚类了来自四个时间点的间充质细胞,将其分为七个亚型,以表征间充质细胞的异质性(Fig. 4i)。HSCs 占肝脏间充质细胞的主要部分,分布在所有时间点,并高表达 RELN、肝细胞生长因子(HGF)、甲状旁腺激素1受体(PTH1R)和视黄醇结合蛋白2(RBP2)(Fig. S5f )。在 HSC 群体中,HSC1 高表达与 HSC 激活相关的基因,如 R-Spondin 2(RSPO2)和 RSPO3(Fig. S5f)。HSC3 特异性表达参与细胞外基质重塑的 COL6A5(Fig. S5f)。作者检测到一小群 HSCs(Prolif),主要来自 D30 和 D42,高表达增殖标记物 TOP2A 和 TPX2(Fig. S5f)。作者还鉴定出一小群间皮细胞,在 D30 和 D42 高表达糖蛋白M6A(GPM6A)和尿皮素1B(UPK1B)(Fig. S5f)。覆盖肝脏表面的间皮细胞对肝脏发育有贡献。值得注意的是,一群成纤维细胞(FBLN1、COL1A1、COL12A1)主要分布在 D30 和 D42,高表达细胞表面蛋白聚糖GPC6。这些成纤维细胞通过 COSG 程序鉴定的 top 标记基因 EBF1 被定义为 EBF1+ 成纤维细胞(Fig. S5g)。作者的 RNA 速率分析结果表明,EBF1+ 成纤维细胞可能是 HSCs 的祖细胞(Fig. 4j, Fig. S5h)。这一稀有细胞类型的存在通过多重免疫组化(mIHC)实验得到验证(Fig. 4k)。
6. 出生后肝脏发育中免疫细胞多样性的表征
肝脏含有大量的先天性和适应性免疫细胞,在宿主免疫反应中发挥重要作用。scRNA-seq 数据展示了多种免疫细胞群体(Fig. S1a),使作者能够描绘出生后发育过程中免疫细胞的变化。T 细胞和 NK 细胞是随时间推移占主导地位的免疫细胞群体,这一点通过 snRNA-seq 数据得到证实(Fig. 5a and Fig. S1d),与肝脏作为淋巴器官的作用一致。

Fig. 5. 出生后发育期间不同的免疫细胞群
(a) 使用 scRNA-seq 数据按样本身份展示的细胞类型组成。细胞类型颜色与 Fig. 1b 对应。F,雌性;M,雄性。
(b) 所有 NK/T 细胞的 UMAP 嵌入图,按注释的亚型着色。
(c) 条形图展示每个 NK/T 亚型的时间点(左)和技术(右)组成。
(d) 热图展示每个亚型的选定标记基因。
(e) 热图展示人类和猪 trNKs 的代表性基因和 TF pseudo-bulk 表达,以及小鼠 trNKs 的 bulk 表达。
为了描述发育中猪肝脏中高度异质的 NK 和 T 细胞,作者从 scRNA-seq 和 snRNA-seq 中分离出 38,167 个 T 和 NK 细胞,通过结合基于趋化因子受体的新分类系统和文献中的标记基因进行整合和注释,获得了四个CD8+ T 细胞亚型、一个 CD4+ T 细胞亚型、一个 γδ T 细胞亚型、一个 CD4+CD8+ T 细胞亚型以及两个 NK 亚型,共九个亚型(Fig. 5b)。每个亚型包含来自四个时间点的细胞(Fig. 5c)。第一个 CD8+ T 细胞亚型,即增殖性 CD8T,主要分布在 D30 和 D42,并高表达增殖标记基因,包括 stathmin 1(STMN1)、高迁移率族蛋白2(HMGB2)、微管蛋白β类I(TUBB)、PCNA钳相关因子(PCLAF)、脱氧尿苷三磷酸酶(DUT)、TOP2A 和 TPX2(Fig. 5d)。第二个亚型,CRTAM+ CD8T,高表达参与调控 CD8T 增殖的 CRTAM 和促进调节性 T 细胞发育的 XCL1,被鉴定为调节样 CD8+ T 细胞。第三个亚型,GNLY+ CD8T,表现出细胞毒性表型,其特征是高表达细胞毒性分子 GNLY 和 GZMH。CX3CR1+ CD8T 被定义为效应 CD8+ T 细胞,其特征是高表达 CX3CR1 和 ZEB2,这些基因对 CD8+ 效应 T 细胞分化至关重要。CX3CR1+ CD8T 还高表达Rho GTPase激活蛋白26(ARHGAP26)和Rho GTPase激活蛋白31(ARHGAP31),表明其具有特定功能,需进一步研究。
同样,作者鉴定了一个 CD4+ T 细胞亚型,即 Naïve/CM CD4T,其高表达MYC、LEF1、TCF7和CCR7,这些基因参与介导记忆 T 细胞的迁移。此外,作者从 scRNA-seq 和 snRNA-seq 中鉴定出一群 γδ T 细胞,主要分布在 D30 和 D42,高表达对 γδ T 细胞发育重要的 SOX13 和 BLK。通过高表达 CD4 和 CD8A,作者鉴定出一个双阳性 T 细胞亚型,即 CD4CD8T,其高表达参与调控 T 细胞发育的 THEMIS 和 BCL11B。
作者鉴定出两个 NK 细胞亚型,高表达 KLRB1、NCR1 和功能尚不明确的 ENSSSCG00000000639。一个是常规 NK 细胞,额外特异性表达血小板衍生生长因子D(PDGFD),其在人类中增强 NK 细胞效应功能。另一个代表组织驻留 NK 细胞(trNKs),并富集了eomesodermin(EOMES)、FCER1G、TYROBP、CXCR6和GZMK(Fig. 5d),与报道的人类 trNKs 的关键特征一致。这些细胞还特异性高表达参与病毒防御反应调控的纤维蛋白原样2(FGL2)、干扰素-γ细胞反应中的干扰素调节因子8(IRF8)以及趋化作用正向调控中的C-C基序趋化因子配体4(CCL4)。作者还观察到 trNKs 在 D150 和 D730 的 scRNA-seq 数据中含量丰富(Fig. 5c)。此外,trNKs 高表达增殖标记物STMN1、HMGB2 和 TUBA1B,表明这些细胞具有自我更新的增殖能力,与先前报道一致。作者下载了人类肝脏 trNK scRNA-seq 和小鼠肝脏 trNK RNA-seq 的公共数据进行跨物种比较,因为 trNKs 在肝脏中表现出显著的物种特异性特征。在对人类和猪的 scRNA-seq 数据进行 pseudo-bulk 分析后,作者探索了人类、猪和小鼠肝脏 trNKs 的代表性表面标记基因和 TF 表达模式。作者观察到跨物种的 CD69+CXCR6+ 表达模式以及人类中 NCAM1bright 的表达(Fig. 5e),与先前报道的肝脏 trNK 特征一致。人类和猪肝脏 trNKs 均高表达 EOMES,低表达 T-Box 转录因子21(TBX21),而小鼠肝脏 trNKs 高表达 TBX21,低表达 EOMES(Fig. 5e),表明从 TF 表达的角度来看,猪肝脏 trNKs 与人类具有高度相似性。
7. 出生后发育期间,肝细胞与 NPCs 之间的保守细胞间相互作用
肝细胞与非实质细胞(NPCs)之间的细胞间通讯在生理和病理条件下对肝脏功能起着重要作用。作者应用 CellChat 研究了出生后发育阶段肝细胞与 NPCs 之间的通讯,使用 snRNA-seq 数据。作者分别推断了四个时间点的细胞间通讯。作者预测肝细胞将通过 19 对和 22 对配体-受体对接收和分泌信号(Fig. 6a, b)。首先,从肝细胞作为信号靶点的功能角度来看,中央静脉内皮细胞(CVECs)和肝细胞之间在不同时间点鉴定出四对相互作用,即 WNT9B-(FZD5 + LRP5)、WNT9B-(FZD5 + LRP6)、WNT2-(FZD5 + LRP5) 和 WNT2-(FZD5 + LRP6)。WNT9B 和 WNT2 是 CVECs 的标记物。WNT 配体与受体 FZD5 及其共受体 LRP5/6 的结合激活了经典的 Wnt 通路,该通路调节肝脏代谢分区。此外,作者在不同时间点鉴定出肝星状细胞(HSCs)和肝细胞之间的 HGF-MET 相互作用。HGF-Met 信号通路是肝脏再生和常规修复所必需的。这一重要事件也在肝窦内皮细胞(LSECs)和肝细胞之间随时间推移被鉴定出来。此外,作者观察到 LSECs 和肝细胞之间在不同时间点的 BMP6-(BMPR1A + BMPR2) 和 BMP6-(ACVR1 + BMPR2) 配体-受体对,这与 LSECs 分泌的 BMP6 可以与肝细胞上的 BMPR1A 或 ACVR1 结合以激活下游 SMAD-hepcidin 通路从而调节铁的报告一致。作者预测 HSCs 上的 PTN 在不同时间点与肝细胞上的 SDC2 相互作用显著富集。PTN 是一种分泌型肝素结合生长因子,在细胞生长、存活和迁移中起重要作用。作者在 D42 猪肝脏中原位证实了 HSCs 和肝细胞之间的这种相互作用(**Fig. 6c)。

Fig. 6. 肝细胞和非实质细胞之间跨时间点的细胞间通信
(a-b) 点图展示非实质细胞(EBF1+ Fib、HSC、KC、LSEC、CVEC 和 PVEC)与肝细胞在不同时间点之间的显著配体-受体相互作用,分别从肝细胞作为信号靶点(a)和信号源(b)的角度展示。箭头表示正文中描述的配体-受体对。点的颜色表示通讯概率,点的大小反映 P 值。方块颜色表示时间点。
(c) 出生后第 42 天(D42)猪肝脏 RLL 的多重免疫组化(mIHC)染色,使用 ALB(黄色)、RELN(粉色)、SDC2(红色)、PTN(绿色)和 DAPI(蓝色)抗体。比例尺为20 μm。
其次,从肝细胞作为信号源的角度来看,作者揭示了两对配体-受体对,即 PLG-PARD3 和 F2-PARD3,这些对先前未被提及。PARD3 是一种蛋白酶激活受体,调节丝氨酸蛋白酶(许多与凝血相关)的细胞效应。PLG编码纤溶酶原(一种丝氨酸蛋白酶),是纤维蛋白溶解的关键成分。F2 编码凝血因子II或凝血酶原,对生命至关重要。凝血和纤维蛋白溶解是止血过程的两个重要阶段,其异常与肝硬化等肝脏疾病密切相关。这两个重要事件在肝细胞与 CVECs、肝细胞与 HSCs、肝细胞与 EBF1+ 成纤维细胞之间在不同时间点被鉴定出来。作者的数据从单细胞角度提供了对凝血和纤维蛋白溶解过程的见解。此外,这些肝细胞与 NPCs 之间的配体-受体对在 D240 RLL 和 D240 RML 的两个独立样本中也保守存在(Fig. S6a)。这些结果表明,肝脏发育是一个高度协调的过程,肝细胞与 CVECs、LSECs 和 HSCs 等其他 NPCs 协同调节肝脏代谢、常规修复和肝脏微环境,并维持铁稳态。
讨论
通过单细胞和单核转录组学,作者绘制了猪肝脏在四个出生后发育阶段中高度异质性的肝细胞、内皮细胞、间充质细胞和 NK/T 细胞的图谱。轨迹和基因调控分析揭示了肝细胞出生后的代谢成熟过程。作者鉴定了一种成年 LSEC 特异性 TF——LUZP2,并通过单细胞组学分析和多重免疫组化(mIHC)实验在六项额外的生物学试验中验证了这一发现,尽管其在肝脏中的功能尚不明确。此外,作者观察到从 D30 起淋巴样细胞主导了肝脏免疫系统,并详细表征了 trNKs。作者的数据揭示了肝细胞与其他 NPCs 通过复杂的相互作用协调肝脏发育的过程。
与先前报道一致,肝细胞在发育中的肝脏中表现出出乎意料的高度异质性,作者鉴定出一群主要来自 D30 的肝细胞,其功能是合成长链多不饱和脂肪酸(LC-PUFAs),而主要来自 D730 的两群肝细胞则参与长链饱和脂肪酸(LC-SFAs)的合成。在哺乳期,仔猪从母猪乳汁中摄取大量 LC-PUFAs,这对调节免疫系统以及大脑和视网膜的最佳发育至关重要。然而,为了支持仔猪的生长发育,需要通过一系列去饱和酶从亚油酸和α-亚麻酸前体额外合成 LC-PUFAs。此外,据报道,FADS2 的活性在老年动物中显著降低。相比之下,成年猪已经停止生长,能量需求和代谢率较低。成年猪需要更稳定的能量来源,并更倾向于合成 LC-SFAs 以进行长期能量储存和利用。此外,成年猪的消化系统和代谢已经成熟,能够更有效地利用 LC-SFAs。随后,作者进行了肝细胞发育轨迹分析,并观察到在晚期阶段富集的代谢相关通路,如尿素代谢过程、酒精代谢过程和胆固醇代谢过程。结合基因调控网络分析,作者鉴定出 33 个 TFs,其表达和活性随伪时间显著变化;其中,作者暗示了最不为人知的 PAR TF——NFIL3 在调控肝脏代谢中起重要作用。肝脏发育过程是一个高度协调的过程。成年阶段的 LSECs 也富集了代谢通路,包括氮循环代谢过程和尿酸代谢过程。此外,CVECs 通过配体-受体对(包括 WNT9B-(FZD5 + LRP5)、WNT9B-(FZD5 + LRP6)、WNT2-(FZD5 + LRP5)和WNT2-(FZD5 + LRP6))在不同时间点与肝细胞相互作用以调节肝脏代谢分区。总的来说,出生后肝脏代谢成熟是一个复杂的过程,涉及肝细胞、LSECs、CVECs 和其他 NPCs 之间的协调。
尽管对胎儿肝脏中细胞变化的广泛描述已有报道,但对出生后肝脏发育过程中免疫细胞动态的广泛表征仍然有限。先前的研究表明,髓样细胞在新生儿中主导肝脏免疫系统。在这里,作者发现从 D30 起,淋巴样细胞在 snRNA-seq 和 scRNA-seq 数据中主导了肝脏免疫系统。因此,肝脏免疫细胞群体从髓样细胞向淋巴样细胞的转变表明,肝脏在出生后阶段适应免疫系统以应对来自胃肠道的抗原和微生物产物等挑战。组织驻留免疫细胞决定了肝脏的免疫特性。在这里,作者鉴定出在成年阶段丰富的 trNKs。作者的数据进一步揭示,trNKs 在成年阶段保留了自我更新的增殖能力,表达增殖标记物 STMN1、HMGB2 和 TUBA1B,与先前报道一致。在过去十年中,长寿命的肝脏驻留 NK 细胞因其在防御病毒感染和癌症发展中的重要作用以及其与常规 NKs 的显著差异而引起了广泛关注。特别是,trNKs 表现出显著的物种特异性特征,人类 trNKs 高表达 EOMES,低表达 TBX21,而小鼠 trNKs 则相反。随后,作者研究了不同物种中代表性基因和 TF 的表达模式。猪 trNKs 与人类的相似性高于小鼠,表现为高表达 EOMES 和低表达 TBX21,这一结果也得到了整合素亚单位α1(ITGA1)、整合素亚单位α2(ITGA2)和整合素亚单位α5(ITGA5)表达模式的支持(Fig. 5e)。因此,作者的数据支持猪是研究 trNKs 在健康和疾病中功能和特征的理想动物模型的观点,与先前报道一致。此外,trNKs 群体仅通过 scRNA-seq 检测到。因此,scRNA-seq 在挖掘肝脏驻留免疫微环境动态中起着重要作用。
LSECs 占内皮细胞群体的主要部分,并作为防御血液中细菌和病毒的第一道屏障。作者的数据表明,LUZP2 是一种成年 LSEC 特异性 TF,在早期阶段表达较低,而在成年阶段表达较高,这一发现通过单细胞多组学和 mIHC 实验得到验证。LUZP2 编码亮氨酸拉链蛋白。LUZP2 在肝脏中的具体功能研究较少,大多数研究与其在脑神经系统发育中的作用相关,仅在脑和脊髓中观察到正常表达水平。在研究 LUZP2 在肝脏中的功能时,作者发现 LUZP2 的预测靶基因参与了 Hippo 信号通路,该通路通过负调控细胞生长来控制器官大小。此外,分区分析显示 LUZP2 在中央静脉周围区域高表达,其基因模块参与对肝细胞生长因子的反应。作者推测 LUZP2 与肝脏大小增长相关,并可能在生长过程中充当“刹车”。同时,作者还发现 LSEC 特异性 TF 编码基因 NR5A2 和 ERG 的表达模式与 LUZP2 不同,它们在发育阶段始终保持高表达水平,从而以不同的方式促进出生后肝脏发育。
总之,作者的单细胞和单核转录组分析揭示了出生后阶段肝脏代谢和免疫的动态变化。然而,为了理解出生后肝脏发育的一致性,还需要进一步剖析成年 LSEC 特异性 TF LUZP2 和 EBF1+ 成纤维细胞的功能。
--------------- 结束 ---------------
注:本文为个人学习笔记,仅供大家参考学习,不得用于任何商业目的。如有侵权,请联系作者删除。



























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










