作者,Evil Genius
果然了,说了一声单细胞数据关于call snp的事情,很多人过来咨询这个怎么做。
单细胞数据call snp早就不是什么新鲜事情,大家可以参考一下文章
10X单细胞空间数据分析之SNP检测篇
cellsnp-lite
运行示例
cellsnp-lite -s $BAM -b $BARCODE -O $OUT_DIR -R $REGION_VCF -p 20 --minMAF 0.1 --minCOUNT 20 --gzip
可以拿到单细胞级别的突变信息,下面是整理的单细胞 X 基因位置突变的矩阵(以单细胞3'数据为例),row是基因 + 染色体 + 位置 + ref +alt,column是barcode。

还是那句话,3‘数据是几乎不能call snp的,唯有5'在某些情况下是可以的,例如KRAS的G12D突变。
还有就是单细胞空间联合分析的软件cytospace,CytoSPACE是一种通过全局优化调整单细胞和空间转录组的工具。与其他方法不同,CytoSPACE根据基于相关性的成本函数和每个点的细胞数量,确保全局最优的单细胞/点对齐。此外,它可以容易地扩展以适应额外的限制,例如每个点的每种细胞类型的分数组成(例如由RCTD或cell2location 推断)。
GitHub - digitalcytometry/cytospace: CytoSPACE: Optimal mapping of scRNA-seq data to spatial transcriptomics data

CytoSPACE_overview

n_cells_per_spot

CRC_cell_type_assignments_by_spot_single_cell
再来分享多组学的时候,我们重复一点,基因表达只是表象、基因突变是根本,空间排布是微环境、VDJ是免疫反应。
今天参考的文献在A cellular and spatial atlas of TP53-associated tissue remodeling in lung adenocarcinoma,最近的文章都在朝着多组学的方向发展,其中无论是单细胞空间还是科服,TP53这个基因应该都不陌生。
TP53是许多癌症中最常见的突变基因,并且与肺腺癌(LUAD)的较短生存期相关。为了确定TP53突变如何影响LUAD肿瘤微环境(TME),文章构建了23例treatment-naïve人肺肿瘤的多组学细胞和空间肿瘤图谱。
非小细胞肺癌(NSCLC)是一种异质性疾病,通常被分为不同的组织学亚型。最近,基因组改变已被用于表征非小细胞肺癌的分子亚型,可用于选择具有特定基因组变化的患者的治疗方法。酪氨酸激酶抑制剂(TKIs)和其他针对致癌突变和染色体重排的靶向治疗(如EGFR、KRAS-G12C、ALK)最近已导致NSCLC患者生存率的改善。免疫检查点抑制剂(ICIs)治疗(例如,抗PD -1/PD-L1)联合化疗或不联合化疗已被证明对一部分患者有效,目前是一些IV期非小细胞肺癌患者一线治疗的一部分。然而,由于癌症的高复发率,迫切需要更有效的患者分层和精确治疗方法。
肿瘤蛋白p53 (TP53)是NSCLC中最常见的突变基因(约50%)以及许多其他癌症。TP53突变在吸烟者中更为常见,并且与肿瘤进展和转移相关,导致NSCLC患者的生存期较短。尽管TP53是研究最广泛的肿瘤抑制因子,但由于报道的突变多样性及其参与广泛的调控途径,TP53的靶向治疗一直具有挑战性。在小鼠模型中,已知TP53在肿瘤发展过程中对肿瘤微环境(TME)有影响。突变型TP53还与人肺腺癌(LUAD)患者PD-L1表达增加和抗PD1治疗反应改善相关,这促使研究TP53突变型(TP53mut)与TP53野生型(TP53WT) LUAD患者的TME差异。
多个treatment-naïve可切除的NSCLC患者肿瘤的单细胞和空间分析可以促进对TP53突变癌细胞及其与TME的关系的基本理解,并提供可能产生新的治疗机会的见解,但是,先前的研究尚未解决这个问题。单细胞rna测序(scRNA-seq)先前已被用于表征可切除的非小细胞肺癌中的恶性细胞和TME,重点关注原发肿瘤与邻近正常组织、肿瘤进展期间或转移部位之间的基因表达差异。研究还利用TME特征将NSCLC患者分层为临床相关亚组,可以预测对免疫治疗的反应。一项研究侧重于表征EGFRmut LUAD的TME和肿瘤内异质性,但这些先前的scRNA-seq研究并没有确定肿瘤中TP53的突变状态,也没有研究其对TME中所有细胞区域的影响.
文章生成了迄今为止最全面的NSCLC多组图谱,结合匹配的TP53mut和TP53WT人类肿瘤的全外显子组测序、scRNA-seq、空间转录组学和多重免疫荧光,以确定恶性细胞和TME中TP53突变相关的变化。整合图谱能够识别空间验证的细胞-细胞相互作用,这些相互作用可能有助于塑造NSCLC的肿瘤结构。在此过程中,发现了TP53mut LUAD中的缺氧表达生态位,并确定了恶性肿瘤细胞限制TME中血管生长的可能机制。进一步发现,在TP53mut与TP53WTLUAD中,T细胞区域具有高度耗损的特征,并伴随着恶性细胞、T细胞和髓细胞之间多重免疫检查点相互作用的富集。最后,利用系统的方法检测空间转录组学数据中的细胞标志,观察到一个潜在的促转移组织生态位,由表达spp1的肿瘤相关巨噬细胞(tam)和表达胶原的癌症相关成纤维细胞(CAFs)组成,这些细胞与TP53mut LUAD TME中的缺氧有关。
非小细胞肺癌的多基因组图谱
为了表征NSCLC的分子、细胞和空间异质性,进行了全外显子组测序(WES)、scRNA-seq、空间转录组学(ST;10X Visium)和多重免疫荧光(mIF)对23例NSCLC患者的原发肿瘤切除进行了检测,其中18例诊断为LUAD。23例患者中有21例有吸烟史(中位数40,范围12-100包/年),所有患者在肿瘤切除术前均确认为treatment-naïve。使用WES分析来确定非小细胞肺癌中常见的突变基因(包括TP53、EGFR、KRAS、STK11、KEAP1、RBM10和PTPRD)的总肿瘤突变负担、拷贝数改变(CNAs)和突变状态。从肿瘤匹配的WES预测的CNA谱与从scRNA-seq数据推断的CNA谱之间存在高度一致性,其中许多与LUAD8中常见的缺失(如CDKN2A、PTPRD、B2M)和扩增(如NKX2-1、TERT、MCL1、EGFR)基因重叠。经过筛选,总共获得了167,193个高质量的细胞图谱,并使用CNA推断来区分恶性和非恶性上皮细胞,然后根据已知标记基因的一致表达将它们整合、聚类并注释为11个广泛的细胞类别。通过TP53突变状态来区分肿瘤,不同的TP53突变相对于TP53WT LUAD肿瘤,在下调恶性细胞中TP53靶基因的平均表达方面具有相当的效果。其余5例肿瘤包括鳞状、黏液状和胶体状组织学,未用于TP53mut和TP53WT肿瘤的比较,因为已发现TP53突变对患者预后具有组织学依赖性.
TP53mutLUAD与不同的TME组成有关
TP53mut和TP53WT LUAD肿瘤TME中的细胞亚群具有可区分的细胞内在表达谱和细胞组成。特别是,在TP53mut和TP53WT的LUAD肿瘤中,内皮细胞和周细胞的比例明显下降,通过对来自癌症基因组图谱(TCGA)的510份原发性LUAD肿瘤的大量RNA-seq谱进行相应的细胞类型特征评分,证实了这一点。内皮细胞异常与肿瘤细胞进展和转移有关,周细胞耗竭与乳腺癌中136例缺氧相关的上皮细胞向间充质转化(EMT)有关。
来自6个肿瘤的14个组织切片的空间转录组分析也支持了TP53mut和TP53WT LUAD之间的这些组成差异(2个TP53mut和4个TP53WT LUAD)。另外2个肿瘤(6张幻灯片)的空间数据由于非LUAD组织学或恶性细胞数量不足而被排除在下游分析之外。使用深度学习框架Tangram将肿瘤匹配的scRNA-seq图谱映射到相应的ST数据,并为每个空间测量生成细胞组成的概率测量。空间细胞组成推断与肺病理学家对相应的苏木精和伊红(H&E)染色的独立手工注释高度一致。与scRNA-seq一致,在TP53mut和TP53WT肿瘤样本中,内皮细胞和周细胞在ST点上的比例也有所下降。

Spatially resolved, multi-omic atlas of NSCLC

Dichotomous activity of malignant cell programs in LUAD associates with survival
虽然来自一个肿瘤的恶性细胞可以占据表达状态的梯度,而不是离散的细胞亚群,但在单细胞分辨率的LUAD中,还没有全面定义不同的癌症表达程序及其在细胞和肿瘤中的使用。为了识别肿瘤之间的共享细胞状态,尽管恶性细胞存在显著的患者特异性差异,使用典型相关分析(CCA)将恶性细胞整合并聚类到18个跨肿瘤共享的亚群中,并使用基因集富集分析注释细胞亚群,突出代表性标记。这些亚群富含与标志性癌症过程相关的基因(例如,细胞周期、缺氧、糖酵解、部分EMT (pEMT)、干扰素γ (IFNG)和TNFA信号传导)和与肺上皮细胞(例如,肺泡2型(at2样)、纤毛、分泌型)。其他恶性细胞亚群表现出抗原呈递(MHCII)、应激反应、金属硫蛋白和衰老相关基因的显著表达.
在将所有恶性细胞和肿瘤样本相关联后,聚集成两组:一组由细胞周期、缺氧、pmt和糖酵解程序组成,另一组由肺泡样、抗原呈递和应激反应程序组成。这两组的恶性program评分呈强烈的反相关,表明它们受到两种截然不同的相反途径的调节。这与先前的LUAD研究一致,其中来自患者来源的异种移植物的细胞由两个不同的肿瘤内亚组组成,由主要由细胞周期基因组成的基因模块区分。在TCGA的LUAD患者肿瘤中,几种恶性program(如ppt、缺氧、细胞周期、金属硫蛋白、糖酵解)的高表达与较短的生存期相关。相反,抗原呈递MHCII程序的高表达与延长生存期有关。
为了确定TP53mut和TP53WTLUAD恶性细胞之间的细胞内在差异,比较了两组患者之间不同恶性program的平均活性评分,发现在与较短生存期相关的几个程序(如细胞周期、糖酵解、pEMT)中,TP53mut比TP53WT LUAD的表达更高,而AT2样程序和TP53靶点的表达降低,这与TP53mut肿瘤在LUAD TCGA中较短生存期的观察结果一致。在数据中,TP53mut和TP53WT肿瘤的单核苷酸改变(SNAs)或CNAs的数量没有统计学上的显著差异。来自TCGA的263例TP53mut和247例TP53WT LUAD原发肿瘤的bulk RNA-seq数据证实了恶性程序的差异。
TP53mut LUAD中AT2样程序表达的降低与AT2细胞身份的丧失是一致的。对肿瘤中每个恶性细胞谱的正常肺上皮细胞特征进行评分,TP53WT LUAD恶性细胞的AT2标记得分很高,而来自鳞状、神经内分泌或粘液/胶体亚型肿瘤的细胞则表达预期的相应基底、神经内分泌或杯状特征。注意,TP53mut LUAD恶性细胞的AT2评分明显低于TP53WT LUAD,但与非腺癌亚型肿瘤的AT2评分相当,这表明肺泡细胞身份的丧失与LUAD的肿瘤进展有关。
在不同的TP53变异和共突变类别中观察到一致的癌症内在变化
为了了解EGFR和KRAS共突变对观察到的TP53mut LUAD癌症内在变化的潜在联合影响,将TCGA队列(n=506)分为6个亚组,这些亚组对这三个基因具有不同的突变状态。与TP53WTKRASWTEGFRWT肿瘤相比,具有或不具有EGFR或KRAS共突变的TP53mut肿瘤的TP53靶和AT2样评分显著降低,CC.G2/M评分显著升高,而具有EGFR或KRAS突变的TP53WT肿瘤与具有TP53WTKRASWTEGFRWT的肿瘤相比,在这些特征上没有显著差异。注意,单独发生TP53突变或与KRAS联合而不与EGFR联合的肿瘤糖酵解显著增加。与TP53WTKRASWTEGFRWT肿瘤相比,缺氧和pEMT评分表明EGFR突变抵消了TP53诱导的对这些恶性表达程序的影响,这与最近的一篇报道一致。多元回归分析还显示,即使在剔除EGFR、KRAS (G12C、G12D、G12V以及所有KRAS突变一起)、STK11、KEAP1、RBM10和PTPRD突变的影响后,与TP53突变状态相关的癌症内在变化也是一致的。值得注意的是,在对模型输出进行方差分析后,TP53与KRAS或TP53与EGFR的突变状态之间没有显著的相互作用。
为了研究不同TP53突变变体对恶性基因程序表达变化的潜在影响,根据先前在TP53WTA549 LUAD细胞系中过表达不同TP53mut变体的功能研究定义的显性阴性(DNE)、功能丧失(LOF)和有效TP53突变类别对TCGA肿瘤样本进行了划分。与肿瘤scRNA-seq分析一致,TP53靶标和AT2样评分降低,CC.G2/M,糖酵解升高。低氧和pEMT评分与TP53 DNE和LOF突变或TP53影响突变亚类不同亚类的TCGA LUAD肿瘤相关。DNE,LOF和impful II突变引起了最明显的差异,where Glycolysis.hypoxia and pEMT programs are significantly increased only in DNE,LOF and Impactful II variant categories in TCGA。此外,恶性细胞的许多内在变化也在体外的A549 LUAD细胞(TP53WT)中被观察到,这些细胞过表达了广泛的TP53突变变体,并通过Perturb-seq进行了分析。这些趋势在所有突变类别中都存在,包括在患者肿瘤中发现的所有四种TP53变体,以及在scRNA-seq验证中发现的一种变体。与TCGA一样,在impact II突变中,恶性表达程序的变化最为明显,而在过表达不同KRAS突变的A549 LUAD细胞中则不存在。由于在广泛的TP53突变中看到了恶性表达程序的一致变化,推断这些表型变化与TP53WT活性的丧失有关,而不是由任何特定突变引起的特定功能的获得。
最后,在蛋白水平上观察到与TP53突变相关的表达变化。临床蛋白质组学肿瘤分析联盟(CPTAC)的蛋白质组学数据显示,TP53靶和AT2样特征评分持续下降,而CC.G2M在蛋白质水平上的特征评分增加,其中DNE,LOF和impful II突变类别的影响再次最为明显。
在TP53mut人类肿瘤和小鼠模型中信号熵和恶性程序的保守变化
在具有致癌基因KRAS-G12D体细胞激活的小鼠的LUAD进展过程中,肺泡细胞身份的丧失和向祖细胞样高度可塑性细胞状态(HPCS)的逆转,在p53缺失的小鼠的肿瘤中(KP模型)比具有野生型p53的小鼠(K模型)的情况更严重。与我们在人类肿瘤中的发现一致,AT2样程序评分显著降低,CC.S、缺氧、糖酵解、 pEMT显著升高。此外,关键缺氧转录因子Hif1a在KP与K恶性细胞中的表达更高。其中,我们没有观察到缺氧、糖酵解的显著增加。在体外TP53mut和TP53WT A549 LUAD细胞之间的缺氧或ppt程序,表明肿瘤微环境对体内形成这些恶性程序很重要。
在TP53mut LUAD人类肿瘤、细胞系和小鼠模型中,肺泡II型细胞身份的持续丧失促使探索这种丧失对信号熵的影响,`信号熵是衡量细胞可塑性的一个代表性指标·。分析发现,数据中,TP53mut与TP53WT在单细胞水平上的LUAD恶性细胞的信号熵增加,在更大的队列中以及KP与K小鼠模型中通过bulk RNA-seq和蛋白质组学谱证实了这一点。这种熵的增加在TCGA的DNE、LOF和impful II TP53mut肿瘤中最为显著,在TP53-only突变体和TP53-KRAS共突变体中显著,而在TCGA的TP53-EGFR共突变体中不显著,这与恶性程序活性变化的趋势一致。
细胞周期和pEMT程序在人类恶性亚群中显示出最高的熵,与KP小鼠模型中描述的HPCS细胞状态最相似。此外,在过表达突变型TP53的A549细胞中,携带impact I和impact II TP53突变的细胞(包括在scRNA-seq和验证队列中发现的变体)的熵显著增加。相反,在过表达不同类型KRAS突变的相同细胞中,熵没有显著变化,这表明观察到的熵增加与TP53突变直接相关。总之,来自TP53WT LUAD肿瘤的恶性细胞具有抗原呈递和AT2样细胞程序,而来自TP53mut LUAD肿瘤的恶性细胞具有高度熵、可塑性,并与预测不良预后的程序相关,包括细胞周期、糖酵解、缺氧和pEMT.



TP53mut LUAD的特点是恶性和间质细胞之间的空间相互作用,已知会抑制血管化并促进EMT
接下来关注的是TP53mut LUAD中内皮细胞比例的下降。在TCGA LUAD的TP53突变体肿瘤中也观察到这种关联,无论是否存在KRAS和EGFR共突变,并且在DNE,LOF TP53突变体中最为显著.
为了研究血管化减少的潜在机制,根据正常肺中内皮细胞亚群的既定标记表达注释了9个内皮细胞亚群。这些细胞包括:aerocytes,一种专门负责肺泡气体交换的毛细血管细胞(表达HPGD、EDNRB和SOSTDC1);动脉细胞(GJA5、ENPP2);毛细血管细胞(CA4、FCN3);血管内皮细胞(VEC),包括COL4A1+ VEC (VEC.COL4A1)、循环(VEC. cycling)和干扰素刺激(VEC. ifn)亚群;淋巴细胞;肺静脉细胞;以及全身静脉细胞。在TP53mut 与TP53WT LUAD中,所有内皮细胞中空气细胞(以及较小程度上的动脉细胞)的比例下降,这进一步得到了使用scrna -seq衍生标记物进行反卷积的bulk RNA-seq数据的支持。这表明TP53mut LUAD中的气体交换相应减少,从而导致肿瘤部位肺泡周围区域的氧气扩散减少,为肿瘤细胞存活提供了选择性优势。
通过对配体-受体对的分析,发现在TP53mut LUAD中,恶性细胞和内皮细胞之间的几种已知抑制内皮细胞生长和功能的相互作用富集,包括SEMA3A-NRP1和EPHB2-EFNB1。匹配肿瘤样本的空间转录组学支持这些观察结果,显示在TP53mut和TP53WT LUAD切片中,SEMA3A-NRP1和EPHB2-EFNB1配体受体对的表达具有显著更高的空间相关性。综上所述,分析观察到TP53mut LUAD中恶性细胞和内皮细胞之间已知抑制相互作用的空间相关表达,这可能解释了这些亚群和血管化的伴随减少。
在非小细胞肺癌中,间充质细胞的异质性及其在更快的肿瘤进展和更短的患者生存期中的潜在作用已被证实。肿瘤的间充质细胞被划分为13个亚群。两个亚群与正常肺肌成纤维细胞最相似:CAF。COLs表达高水平的胶原(COL1A2, COL3A1, COL1A1),它们与最近描述的LRRC15+肌成纤维细胞和肌成纤维细胞共享标记,表达成纤维细胞和平滑肌细胞标记。还注释了两个周细胞样亚群,一个表达典型周细胞标记物(HIGD1B, 331 COX4I2),一个表达COL4A2和EMT相关基因;气道和血管平滑肌亚群,肺泡(cafa . adh1b)和外膜(cafa . adventitial)成纤维细胞,与最近描述的人肺泡和外膜成纤维细胞相对应;以及表达更高水平脂质代谢(caf1 . apoe)、核糖体(caf1 . ribo)、补体和趋化性(caf1 . complement)和干扰素刺激(caf1 . isgs)基因的成纤维细胞亚群。值得注意的是,没有观察到CAF亚群类似于正常的肺纤维肌细胞或脂肪成纤维细胞。通过pySCENIC推断,不同的间质亚群与不同的活性调控子相关,具有高的调控特异性。正如预期的那样,循环CAFs具有活跃的E2F1调节因子,这是一种细胞周期调节因子;CAF.ISGs激活IRF7和STAT1调控,控制干扰素应答基因;和CAF.COLs激活了一个TWIST1调控子,该调控子先前与癌症中的EMT有关
根据推断的CAF亚群在横断面空间转录组学spot的组成,周细胞与内皮细胞的CAF在空间上显著相关。CAF_COLs与血管平滑肌和CAF_ADH1B, CAF_Complement与CAF_Adventitial,周细胞与CAF_ISGs,气道平滑肌细胞与CAF_APO和CAF_Ribo。在空间上,大多数间充质亚群与恶性细胞呈负相关,表明成纤维细胞与肿瘤核心闭塞。比较TP53mut与TP53WT之间LUAD、周细胞和CAF间充质细胞亚群(在所有间充质细胞中)的相对比例。ADH1B在TP53mut LUAD中减少(在广泛的细胞类别中观察到),也得到了反卷积bulk rna测序的支持。与内皮细胞评分类似,无论是否存在KRAS和EGFR共突变,TCGA LUAD中TP53突变肿瘤的周细胞评分均显著降低,且这种降低在TCGA中DNE、LOF类TP53突变中最为显著.
TGFB2-TGFBR2在TP53mut与TP53WT LUAD中具有显著更高的空间相关性,间质细胞与恶性细胞之间的TGFB2-TGFBR2和TGFBR2-TGFB3相互作用在TP53mut与TP53WT LUAD中富集,但富集不显著。在TP53mut和TP53WT LUAD中,VEGFA在肌成纤维细胞中的表达更高,这与先前的报道一致,即肌成纤维细胞可以在缺氧的情况下调节血管生成。总的来说,TP53mut LUAD中基质细胞组成和空间组织的变化都伴随着已知的抑制脉管系统和诱导上皮-间质转化的相互作用的富集。


在TP53mut LUAD骨髓细胞中增加SPP1表达和免疫调节相互作用
髓系细胞在肿瘤进展中起着重要作用,可能是癌症的一个令人信服的治疗靶点。虽然非小细胞肺癌髓系细胞群具有普遍特征,但TP53突变对髓系细胞的影响及其与TME中恶性、间质和免疫区室的相互作用尚未在人类中进行详细研究。
髓系细胞分为14个亚群,与之前的NSCLC图谱基本一致,但TP53mut和TP53WT LUAD在组成上存在显著差异。其中包括TP53mut - LUAD在TAM-FABP4细胞(类似于组织内肺泡巨噬细胞(tam))中的比例显著降低,以及表达spp1的tam (TAM.SPP1)的比例增加。与此一致的是,在TCGA bulk RNA-seq数据中,SPP1的表达显著增加,在TP53mut和TP53WT LUAD肿瘤的骨髓伪散装比较中,SPP1的表达更为显著。CXCL9/10/11在TP53mut块状TCGA LUAD肿瘤中的表达也升高。在scRNA-seq数据和TCGA bulk RNA-seq数据的反卷积分析中,TP53mut LUAD肿瘤中表达tam的CXCL9/10/11比例(TAM.CXCLs)也更高。值得注意的是,SPP1和CXCL9/10/11在EGFR或KRAS中没有共突变的TP53突变肿瘤中,以及TCGA中DNE、LOF和impactii类TP53突变肿瘤中升高最为显著。
TP53mut和TP53WT LUAD的髓系细胞亚群也与不同的细胞内在基因程序相关,因此TP53mut和TP53WT肿瘤的髓系亚群之间差异表达的基因在EMT、缺氧和干扰素反应途径中富集,尤其是在TAM中。SPP1细胞。SPP1的表达先前与EMT、LUAD的早期淋巴结转移以及TCGA LUAD中独立于TP53突变状态的较短生存期有关。值得注意的是,在单个髓细胞中,与SPP1表达最相关的基因在EMT、缺氧和糖酵解功能上富集,包括VEGF受体NRP1和FLT1。为了支持这一观察结果,最近发表的scRNA-seq研究摘要显示,SPP1+巨噬细胞在纤维化肺疾病、COVID-19肺和胰腺导管腺癌(PDAC)中一致存在,这表明这些纤维化相关的SPP1+巨噬细胞在肺损伤和ECM重塑中的作用。总之,发现SPP1在TP53mut LUAD髓系细胞中的表达增加,这与EMT和缺氧程序相关基因的诱导密切相关。
为了确定可能导致TP53mut LUAD中不同髓系的配体-受体相互作用,进行了差异配体-受体相互作用分析。据推测,TP53mut LUAD中富集的相互作用包括VEGF- FLT1和NRP1-SEMA3A,它们参与髓系细胞向肿瘤部位的募集,以及恶性细胞和髓系细胞之间的TGFB2-TGFBR1相互作用,已知这些相互作用可促进单核细胞向tam分化,这可能有助于解释TP53mut LUAD中单核-巨噬细胞数量的相对增加。此外,在TP53mutmut LUAD中诱导的髓细胞和间充质细胞之间的NRP1-VEGFA、NRP1-VEGFB、FLT1-VEGFB和FLT1-PGF相互作用表明,间充质细胞可能有助于单核细胞向TME募集.
此外,骨髓细胞和B/T细胞之间的CXCL11-CXCR3相互作用在TP53mut LUAD中富集,CXCR3由NK、B和T细胞特异性表达,CXCL11在TP53mut LUAD的多髓细胞亚群中诱导,其中TAM_CXCLs中表达最多,TAM_CXCLs在TP53mut LUAD中占髓细胞比例较高。因此,骨髓细胞可能会增强TP53mut LUAD中表达cxcr3的T细胞的募集。最后,在TP53mut LUAD中,SPP1介导的髓细胞和内皮细胞或周细胞之间的相互作用显著增加,这也得到了TP53mut肿瘤中SPP1和CD44表达空间相关性增加的支持。因此,TP53mut LUAD增加了通过SPP1、CXCL11和其他TAM相关免疫调节剂参与单核细胞和淋巴细胞募集、TAM分化、缺氧、EMT和其他下游效应功能的推定相互作用的表达。


TP53mut LUAD中T细胞耗竭程序的富集和假定的免疫检查点相互作用
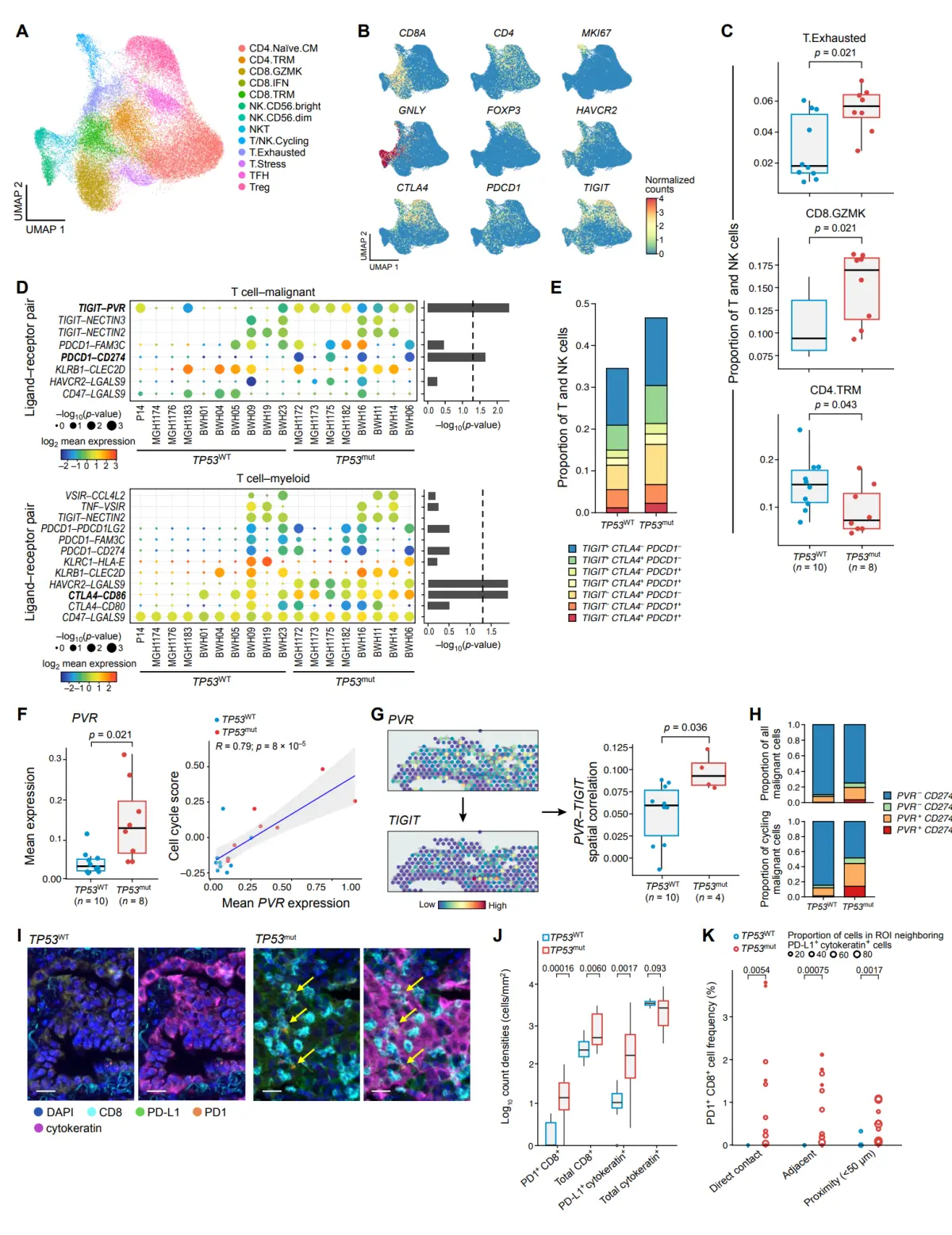
scRNA-seq数据中的淋巴样细胞分为T和NK细胞、滤泡和边缘带B细胞、IgA和IgG浆细胞、浆细胞样dc和肥大细胞等13个亚群。虽然B细胞组成没有显著差异,但TP53mut LUAD的CD4+组织记忆T细胞(CD4- trm)比例降低,在所有T细胞和NK细胞中,表达gzmk的CD8+ (CD8- gzmk)和431个耗尽样(T. exhausted) T细胞群增加,这得到了scRNA-seq验证和来自TCGA原发肿瘤的反卷积 bulk RNA-seq数据的支持。耗竭T细胞的高丰度可能是通过CXCL11-CXCR3相互作用增加趋化性介导的,其中CXCR3在TP53mut耗竭T细胞中上调.
在scRNA-seq中,还观察到TP53mut和TP53WT肿瘤中TFH细胞相对于所有T细胞和NK细胞的比例更高,当合并所有样本时,这具有统计学意义。作为检查点抑制治疗应答的主要预测因子,CXCL13的表达在耗尽样亚群和TFH亚群中表达最高,并在TP53mut肿瘤中显著升高。此外,TP53mut肿瘤中免疫检查点分子PDCD1、CTLA4、HAVCR2和TIGIT的表达在多个T细胞亚群中显著高于TP53WT肿瘤,而癌症预后良好的标志物KLRB1的表达则下调。综上所述,CXCL13和免疫检查点分子(PDCD1、CTLA4、HAVCR2和TIGIT)的表达增加,TFH、GZMK表达CD8+和耗竭样T细胞的比例增加,都表明TP53mut LUAD TME的免疫原性潜力增强,这可能有助于更有利的ICI免疫治疗反应.
对T细胞、髓细胞和恶性细胞之间假定的免疫检查点相互作用的配体受体分析显示,TP53mut与TP53WT LUAD中假定的T细胞与恶性细胞之间的相互作用中PDCD1-CD274和TIGIT-PVR的富集,以及T细胞与髓细胞之间假定的相互作用中CTLA4-CD86和HAVCR2-LGALS9的富集。事实上,分析发现来自TCGA的TP53mut bulk RNA-seq LUAD肿瘤样本中CD274、CD86、PVR、PDCD1、CTLA4和TIGIT的表达较高,来自CPTAC的TP53mut蛋白质组学LUAD肿瘤样本中PVR和CD274的表达较高,以及在scRNA-seq数据中多个T细胞亚群中PDCD1、CTLA4和TIGIT的表达较高,其中与CTLA4和PDCD1相比,TIGIT在T细胞中表达最频繁。TP53mut与TP53WT肿瘤scRNA-seq数据显示,PVR在恶性细胞中的表达也更高,且与恶性细胞中细胞周期程序的表达高度相关,提示PVR可能在癌细胞增殖过程中被激活。此外,与TP53WT相比,TP53mut的LUAD中TIGIT和PVR表达的空间共定位明显更高。与此一致的是,PVR+恶性细胞在TP53mut肿瘤中比TP53WT肿瘤中所占比例更高,在循环恶性细胞中更为显著。
为了在单细胞分辨率下研究PD-L1 (CD274)和PD1 (PDCD1)相互作用中TP53mut的富集,对患者匹配的TP53mut和TP53WT福尔马林固定石蜡包埋(FFPE)载玻片应用了多重免疫荧光(mIF)。与TP53WT相比,TP53mut肿瘤样本中PD-L1+细胞角蛋白+细胞以及PD1+CD8+细胞的对数计数密度(细胞/mm2)显著增加,并且,与scRNA-seq细胞-细胞相互作用推断一致,TP53mut肿瘤样本中PD-L1+细胞角蛋白+细胞和PD1+CD8+细胞之间的共定位增加,通过多个空间分析测量直接接触,邻接性(由6个最近邻居内的细胞定义)和邻近性(<50µm)。综上所述,在TP53mut LUAD中,PVR、TIGIT、CD274和PDCD1的表达增加,同时配体和相应受体之间的共定位增加。


在TP53mut LUAD中,空间定义的成纤维细胞-巨噬细胞生态位在缺氧和EMT程序中富集
为了利用空间数据全面绘制室间细胞共定位图,对所有空间转录组学点上的细胞亚群比例进行了反卷积,并计算了所有LUAD切片上细胞类型比例的平均相关性,以及它们在TP53<sup>mut</sup>和TP53<sup>WT</sup> LUAD肿瘤之间的差异,有趣的是,在TP53mut与TP53WT LUAD中,内皮细胞与间充质细胞和髓系细胞的共定位(即更多的负相关)明显降低,这与TP53mut肿瘤中间充质和髓系亚群缺氧相关基因表达增加一致。此外,在TP53mut LUAD中,B细胞、血浆细胞和恶性细胞的空间共定位增加。B细胞浸润与非小细胞肺癌中PD1/PD-L1表达增加、TMB增加和生存期延长有关,并可能导致TP53mut LUAD肿瘤免疫原性增强。
通过基于NMF的方法进一步确定了多细胞类群,得出了15个不同细胞亚群参与的因素。因子7 (NMF7)含有已知在肿瘤进展中具有重要意义的多髓细胞和间充质亚群,包括TAM,SPP1, CAF.COLs和肌成纤维细胞,它们彼此高度共定位,以及具有标志性的缺氧和EMT程序表达。NMF7高表达点在恶性细胞中比例低,在髓细胞和间充质细胞中比例高。在TP53mut和TP53WT LUAD中,NMF7与肿瘤周围(恶性细胞≤50%的斑点)的标志性缺氧和EMT程序表达呈正相关,与所有斑点的内皮细胞负相关。由于CAFs和巨噬细胞都被认为在肿瘤中诱导EMT, NMF7可能代表一个位于肿瘤核心周围的缺氧成纤维细胞-巨噬细胞生态位,可能有助于TP53mut LUAD恶性细胞的早期EMT表型.


























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








