医疗器械软件监控、维持着人体的各项生理指标,稍有偏差就会造成不可逆的严重后果,因此世界各国对医疗器械都会进行严格监管,必须获得监管机构的认可才可以上市销售。所以医疗器械软件与其他行业软件不同之处在于必须符合监管要求,必须符合监管法规。
医疗器械监管体系以美国的FDA和欧盟的CE具有代表性,其他各国或参照、或直接认可这两个体系。本文将以CFDA(China Food and Drug Administration国家食品药品监督管理总局)进行说明,从监管逻辑、上市流程、研发过程、和遵循的法规四个方面进行介绍。CFDA现已更名为NMPA:National Medical Products Administration,国家药品监督管理局。
1、监管逻辑
NMPA会从“注册检验”、“临床试验”、“体系考核”、“专家评审”、“飞行检查”五个环节对医疗器械全生命周期进行监管。
注册检验环节主要考察生产企业向NMPA申请注册的产品是否能达到自己宣称的安全、功能、性能指标,NMPA会交由具有专业资质的机构进行检测。
注册样机满足了宣称的安全、功能、性能要求是否就一定对人体健康有帮助呢?不一定,比如开发一个防尘口罩用于医用。所以需要将满足安全、功能、性能的设备交给临床医生,由他们观察临床结果,来证明设备的功能对临床用途是否有效。
注册样机既满足了安全、功能、性能要求,又满足了临床用途,是不是就可以发放注册证了呢?还不够。注册的样品满足了各项要求,但并不能保证所有生产的产品都能达到注册样品的同等质量。因此NMPA会考察生产企业的体系流程,看看注册样品是如何制造出来的,批量生产的流程是否能保证生产出同等质量的产品,以及生产企业的实际生产过程是否严格执行了体系流程。从而确保批量生产的产品能达到注册样机的质量。
注册样机满足了安全、功能、性能、临床要求,且企业体系流程符合要求就可以发放注册证了吗?还不够,对于一些非常前沿的技术, NMPA自己、临床医生也可能无法把握是否对人类生命健康有益。比如开发一个用于克隆人的机器。NMPA会交给由国内各行业专家组成的专家团进行专家评审,如无问题,则对生产企业发放注册证。
企业拿到注册证就可以上市销售了,NMPA还会在没有事先任何通知的情况下进行飞行检查,包括去生产企业抽查体系执行情况,以及在生产企业、经销商、医院对产品进行抽查,从而保证医疗企业产品全生存周期都是安全、有效的。

2、上市流程
1)注册申请:医疗器械生产企业向NMPA提交注册申请资料,包括申请注册的样机,样机的功能、性能说明,样机的检测方法。NMPA审核企业资质,资料的符合性后指定符合资质的检测机构进行检验。
2)注册检验:检测机构拿到注册样机和样机的功能、性能、检测方法后,先审核检测方法是否科学,然后进行测试,测试通过后,会出具EMC报告、安规报告、功能性能报告。
3)临床试验:医疗生产企业拿到检测机构出具的EMC报告、安规报告、功能性能报告后,就可以找有资质的临床医院,进行临床测试,临床医院会先进行伦理审核,然后进行临床试验,试验完成后会出具临床报告。
4)专家评审:医疗生产企业拿到检测机构出具的EMC报告、安规报告、功能性能报告、临床报告后,交给NMPA,NMPA进行审核,如果是新产品(国内没有注册过的,或技术非常前沿的),则会召集专家进行专家评审,评审通过后会去生产企业考察体系流程。
5)体系考核:NMPA会派出审核员到企业检查体系文件,抽查体系过程执行情况。审核通过后为产品发放注册证。
7)飞行检查:NMPA会对已获得注册证的企业进行事先没有任何通知的检查,包括去生产企业抽查体系执行情况,以及在生产企业、经销商、医院对产品进行抽查。

3、研发过程
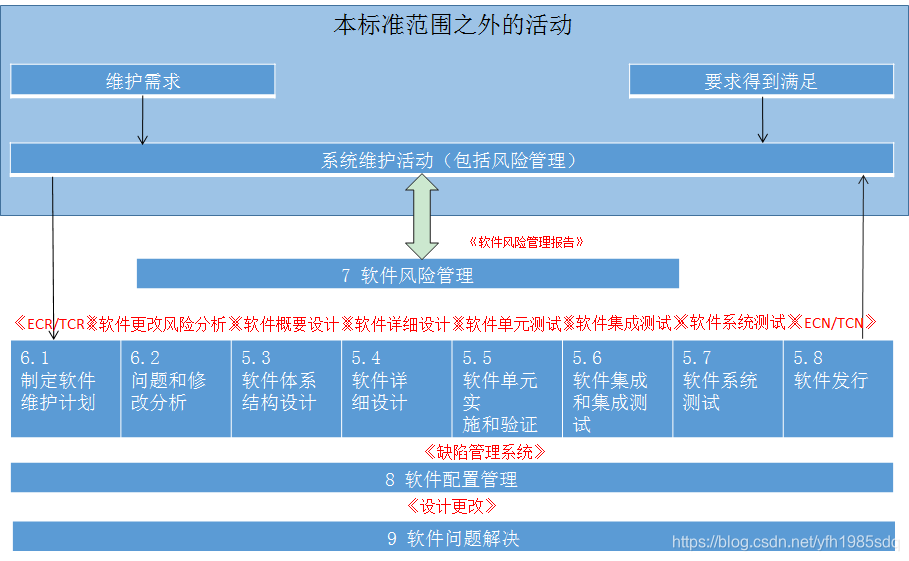
软件研发过程必须遵循《YYT 0664-2008 医疗器械软件 软件生存周期过程》,主要流程及输出物如下图

4、遵守的法规
法规及标准如下:









 本文介绍医疗器械软件的监管逻辑、上市流程、研发过程及遵循的法规。NMPA从注册检验、临床试验等五个方面进行全面监管,确保医疗器械软件安全有效。
本文介绍医疗器械软件的监管逻辑、上市流程、研发过程及遵循的法规。NMPA从注册检验、临床试验等五个方面进行全面监管,确保医疗器械软件安全有效。
















 1806
1806

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








