
AbMole(奥默生物)是ChemBridge在中国的唯一官方指定合作伙伴。
近日由来自中国科学院生物物理研究所的Lin Jing,北京科学技术研究院的YunHe An,以及中国科学院的TanXi Cai等多名研究人员在Cell Mol Immunol期刊(IF=24.1)上,共同发表了题为“A subpopulation of CD146+ macrophages enhances antitumor immunity by activating the NLRP3 inflammasome”的文章。在该文章中,研究人员使用了AbMole的BayK8644(M5073)与Stattic(M3032)两种产品,揭示了CD146+TAMs的抗肿瘤作用,并为开发癌症免疫治疗的方法提出了新的策略。

肿瘤相关巨噬细胞(TAMs)决定着免疫疗法的疗效。然而,由于对其表型和功能异质性的了解有限,限制了其在肿瘤免疫治疗中的应用。据报道,分化簇146 (CD146)与癌症和慢性炎症疾病等病理状况有关,并且具有调节免疫细胞(如T细胞和巨噬细胞)的功能。
通过对小鼠和人类肿瘤组织中的CD146+巨噬细胞进行染色,发现CD146+巨噬细胞主要存在于肿瘤邻近组织(图1A)。之后通过Western(图1B)在肿瘤细胞条件培养基(TCM)刺激的巨噬细胞中检测到了强烈的STAT3活化,且STAT3的活化随着TCM刺激时间的延长而增加(图1C)。而经转录因子(TF)敲除分析表明,CD146受STAT3负调控(图1D)。因此可说明,随着肿瘤的生长,CD146通过肿瘤微环境(TME)诱导的STAT3激活而下调。
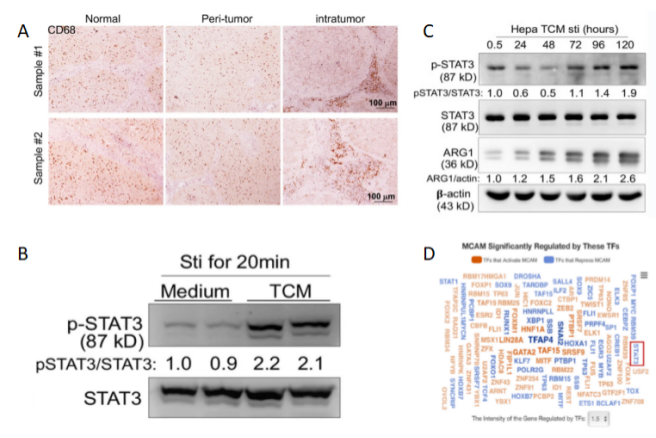
图 1 A. 人肝脏样本中CD68的免疫染色。B. WB检测用或不用TCM刺激20分钟后,BMDMs中p-STAT3和STAT3的表达水平。C. WB检测使用TCM刺激后,BMDMs中p-STAT3、STAT3和ARG1蛋白的表达水平。ARG1作为巨噬细胞M2极化标记,β-Actin作为上样内参。D. 通过TF敲除分析表明,TF调控CD146的表达。
接下来,研究人员通过建立肿瘤模型进行实验(图2A),并发现巨噬细胞CD146条件性敲除小鼠(M-KO)的巨噬细胞主要通过招募髓源性抑制细胞(MDSCs)到TME来促进肿瘤的发展。之后通过进行体外转运(图2B)和RT-PCR等实验,发现CD146-KO巨噬细胞主要通过产生趋化因子来促进MDSC的招募。
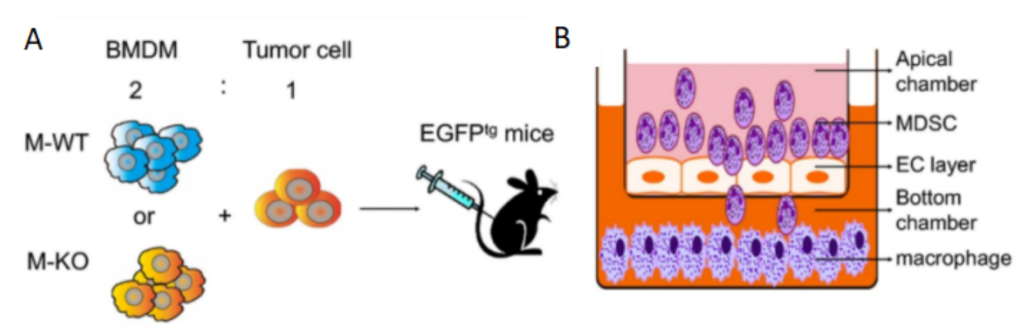
图 2 A. 共注射肿瘤模型。B. 体外MDSC迁移试验示意图。
然后,研究人员用TCM刺激巨噬细胞,并分析信号通路的激活情况,观察到对比起野生型,敲除CD146后TCM对JNK通路的活化能力增强(图3A,B)。且经实验发现,JNK抑制剂能阻断MDSCs的招募(图3C),表明巨噬细胞上的CD146下调或缺失能通过激活JNK通路,促进MDSC招募相关趋化因子的表达,从而增强肿瘤免疫抑制。
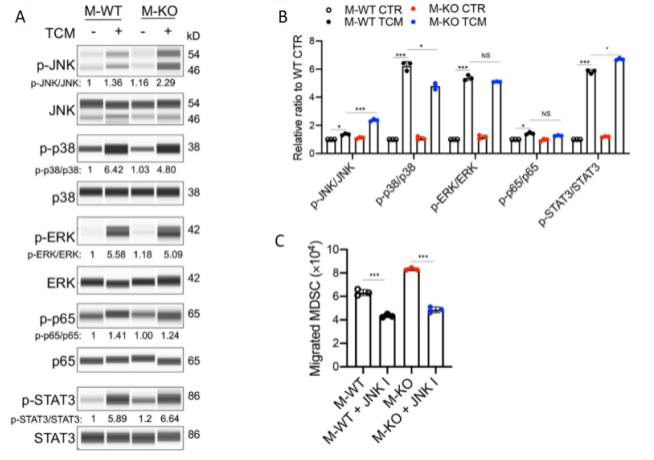
图 3 A. WB分析巨噬细胞中p-JNK、p-p38、p-ERK、p-p65和p-STAT3的水平。总JNK、p38、Erk、p65和STAT3蛋白作为对照。B. TCM刺激下巨噬细胞中p-JNK/JNK、p-p38/p38、p-ERK/ERK、p-p65/p65和p-STAT3/STAT3比率的定量分析(n = 3)。C. JNK抑制剂处理的巨噬细胞诱导的MDSC迁移(n = 3)。
通过蛋白质组学分析,发现跨膜蛋白176B(TMEM176B)在M-KO巨噬细胞中明显上调(图4A)。同时TMEM176B也被报道能抑制Caspase-1的活化和IL-1β的成熟,且两者都是炎症小体活化的标志。因此,研究人员测量了野生型小鼠(WT)和CD146-KO巨噬细胞中相关指标(如图4B),发现CD146的缺失能上调TMEM176B的表达并抑制NLRP3的激活。
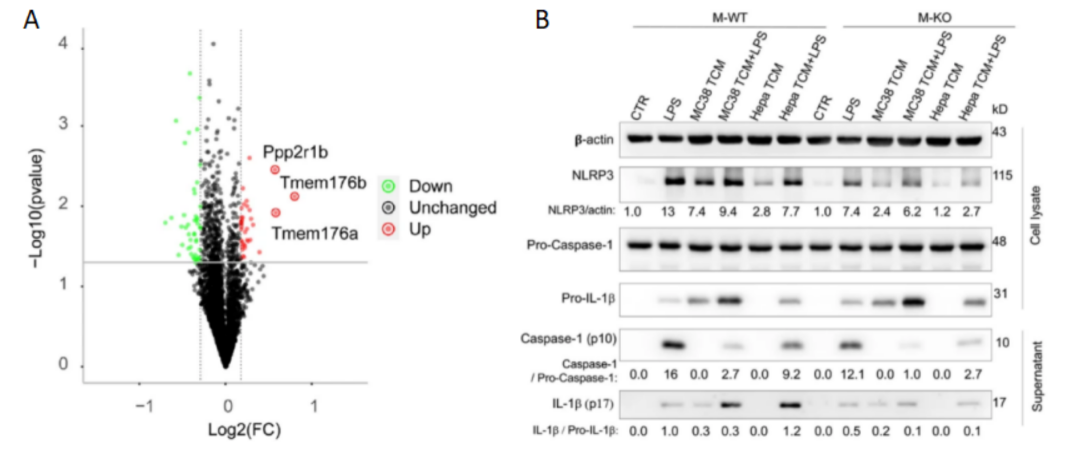
图 4 A. 比较Hepa-TCM处理的M-WT和M-KO巨噬细胞蛋白质表达水平的火山图。B. 用LPS(10 ng/ml)和/或TCM刺激M-WT或M-KO巨噬细胞12 h,然后用5 mM ATP刺激1.5 h,对细胞裂解液或上清液中的actin、NLRP3、pro-IL-1β、pro-Caspase-1、IL-1β和Caspase-1进行WB分析。
之后研究人员使用Bayk8644抑制TMEM176B,并用ELISA对趋化因子的水平进行检测,发现抑制TMEN176B可以减少部分相关趋化因子的分泌(图5A)。由此得出结论:TAMs中CD146的下调能通过促进JNK信号的激活,从而上调TMEM176B和MDSC招募相关趋化因子的表达,进而加速肿瘤的发展(图5B)。
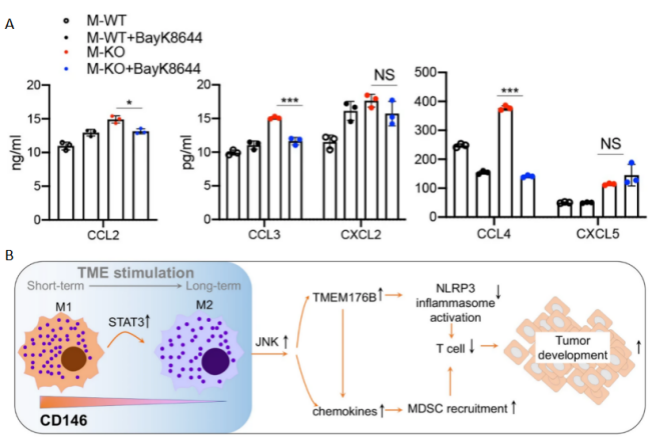
图 5 A. 在BayK8644存在的情况下,使用ELISA 检测TCM刺激巨噬细胞72小时后上清液中的CCL2、CCL3、CCL4、CXCL2以及CXCL5。B. CD146+巨噬细胞在肿瘤发生中的作用机制示意图。
最后将TMEM176B抑制剂和抗CD146抗体AA98联合应用于肿瘤治疗,发现联合使用是一种很有前景的肿瘤治疗策略。并且STAT3抑制剂能进一步提高抗肿瘤效率(图6A-C)。总之,调节TAMs的功能可以提高抗CD146抗体在肿瘤治疗中的效率,为基于TAMs的肿瘤治疗提供了一种新策略。
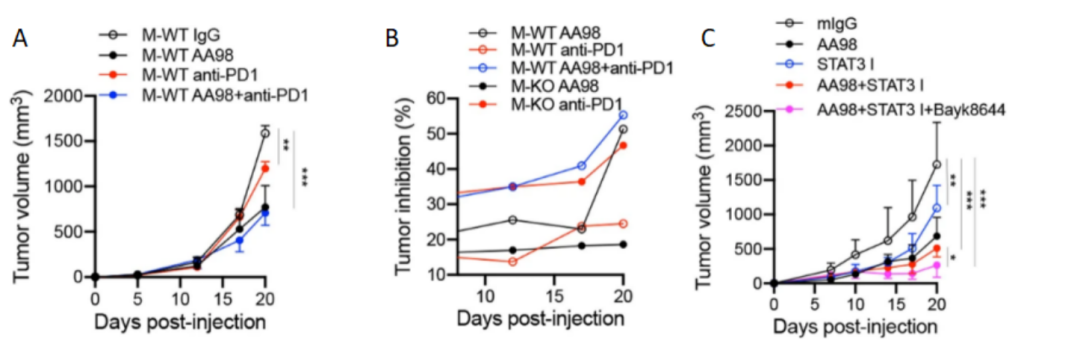
图 6 A-B 给药PD-1抗体的M-WT和M-KO小鼠以及给药AA98和/或PD-1抗体的 WT小鼠(A)中MC38肿瘤生长和抑制(B)(n = 5)。C. 每周两次给药AA98、STAT3抑制剂(STAT3 I)和/或BayK8644的C57小鼠中MC38肿瘤生长情况(n = 5)。
该研究使用了购自AbMole的Stattic(M3032)和Bayk8644(M5073)两种产品,其中Stattic是一种有效的 STAT3 抑制剂,而Bayk8644是免疫调节阳离子通道TMEM176B的抑制剂。
通过使用Stattic处理小鼠,发现肿瘤CD146+巨噬细胞的比例增加(图7A)。为了测试Stattic的抗肿瘤活性是否取决于巨噬细胞上的CD146表达,又用Stattic处理了带瘤的M-WT或KO小鼠。如图7B,C所示,Stattic对M-WT小鼠的肿瘤生长的抑制率约为50%,对M-KO小鼠的抑制率约为30%。这些数据表明,巨噬细胞CD146的表达至少部分受到TCM诱导的STAT3信号转导的控制,并证明了STAT3抑制剂可以通过抑制巨噬细胞中CD146的下调,从而维持巨噬细胞的抗肿瘤活性,为在癌症研究中靶向STAT3提供了证据。
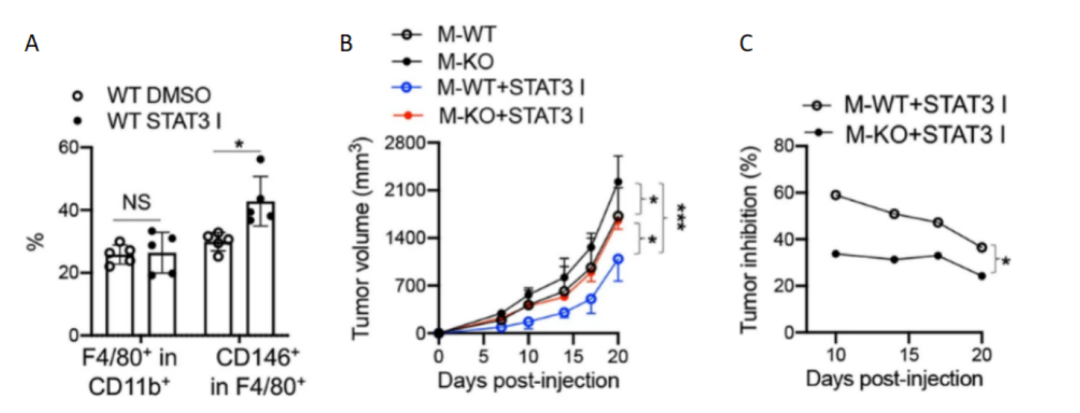
图 7 A. FACS分析STAT3抑制剂处理小鼠和对照小鼠(n = 5)的F4/80+或CD146+ F4/80+细胞百分比。B. 各组Hepa1-6肿瘤发生情况(n = 5)。C. STAT3抑制剂对M-WT或M-KO小鼠肿瘤的抑制作用(n = 5)。
此外,实验中多次使用TMEM176B抑制剂BayK8644,通过用BayK8644处理M-KO小鼠,发现BayK8644能显著增加Caspase-1活化和IL-1β成熟(图8)。与其他实验结果共同表明CD146参与了炎症小体的激活,且至少部分通过TMEM176B发挥作用。
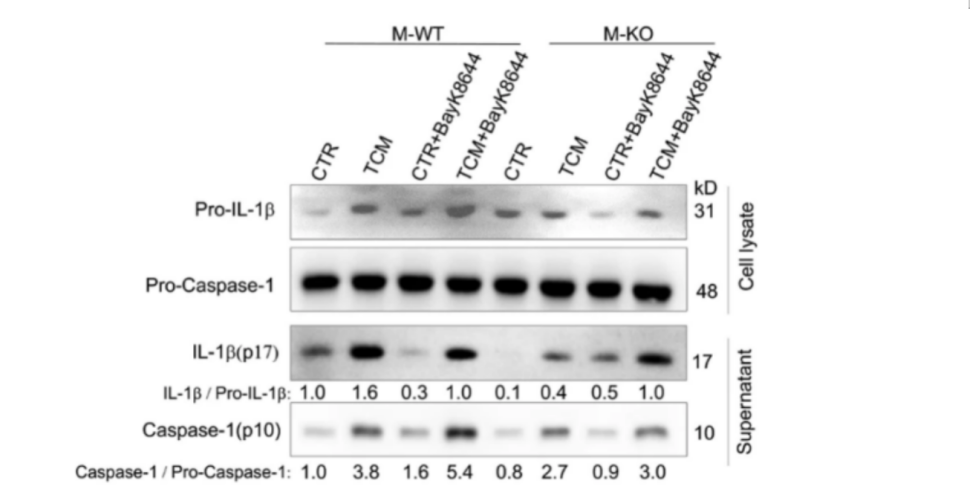
图 8 在Bayk8644存在的情况下,用TCM刺激BMDMs 12 h,WB分析细胞裂解液或上清液中的pro-IL-1β、pro-Caspase-1、IL-1β和Caspase-1。
接下来通过使用ELISA来评估TMEM176B抑制后的趋化因子水平,发现巨噬细胞中CD146的缺失会上调TMEM176B和一些趋化因子(如CXCL2和CXCL5)的表达,同时TMEM176B的表达也会控制其他趋化因子(如CCL2、CCL3和CCL4)的表达(图9A),且Bayk8644也能部分阻断体外M-KO诱导的MDSC转运(图9B)。
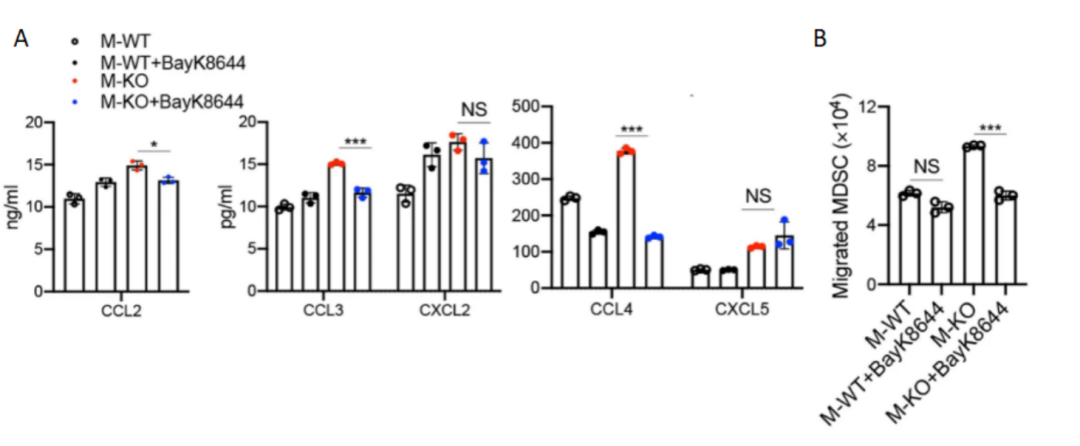
图 9 A. 在BayK8644存在下,用TCM刺激巨噬细胞72小时的上清液进行ELISA实验,检测CCL2、CCL3、CCL4、CXCL2和CXCL5。B 在BayK8644存在下巨噬细胞趋化诱导的MDSC迁移(n = 3)。
此外,研究人员还建立了M-WT和M-KO小鼠的肿瘤模型,通过给药BayK8644(图10 A,B),并用流式细胞术(FCM)进行分析(图10C),发现M-KO小鼠的肿瘤发展至少部分依赖于TMEM176B的表达。
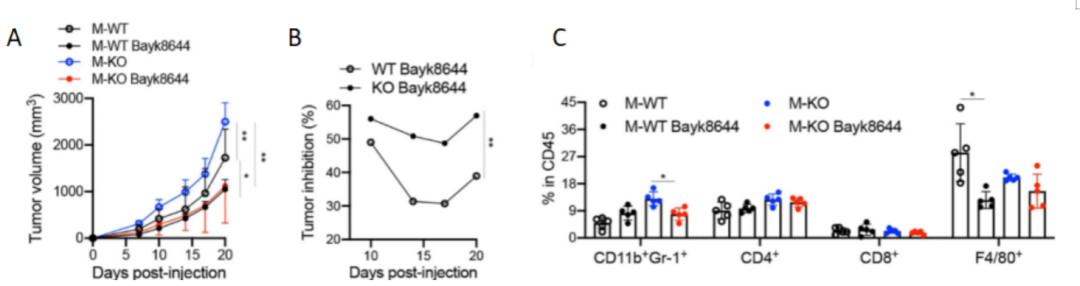
图 10 A-B BayK8644对携带MC38肿瘤的M-WT或M-KO小鼠(n = 5)中肿瘤生长(A)或抑制(B)情况。C. 用BayK8644处理或不处理的M-WT和M-KO小鼠肿瘤中CD11b+Gr-1+、CD4+、CD8+和F4/80+细胞群的FACS分析(n = 5)。
由于CD146+巨噬细胞在肿瘤预防中起着重要作用,而巨噬细胞上CD146的缺失会上调TMEM176B的表达,因此研究人员将TMEM176B抑制剂和CD146抗体AA98联合应用。如图11A,B所示,AA98+BayK8644联合应用可抑制80%的肿瘤生长。且CD11c+细胞的比例在联合治疗组明显增加(图11C,D),表明抗CD146抗体和TMEM176B抑制剂的联合应用是一种很有前景的肿瘤治疗策略。并且STAT3抑制剂Stattic能进一步提高单独使用AA98或AA98+TMEM176B抑制剂的抗肿瘤效率(图6C)。总之,这些数据表明,调节TAMs的功能可以提高抗CD146抗体在肿瘤免疫中的效率。
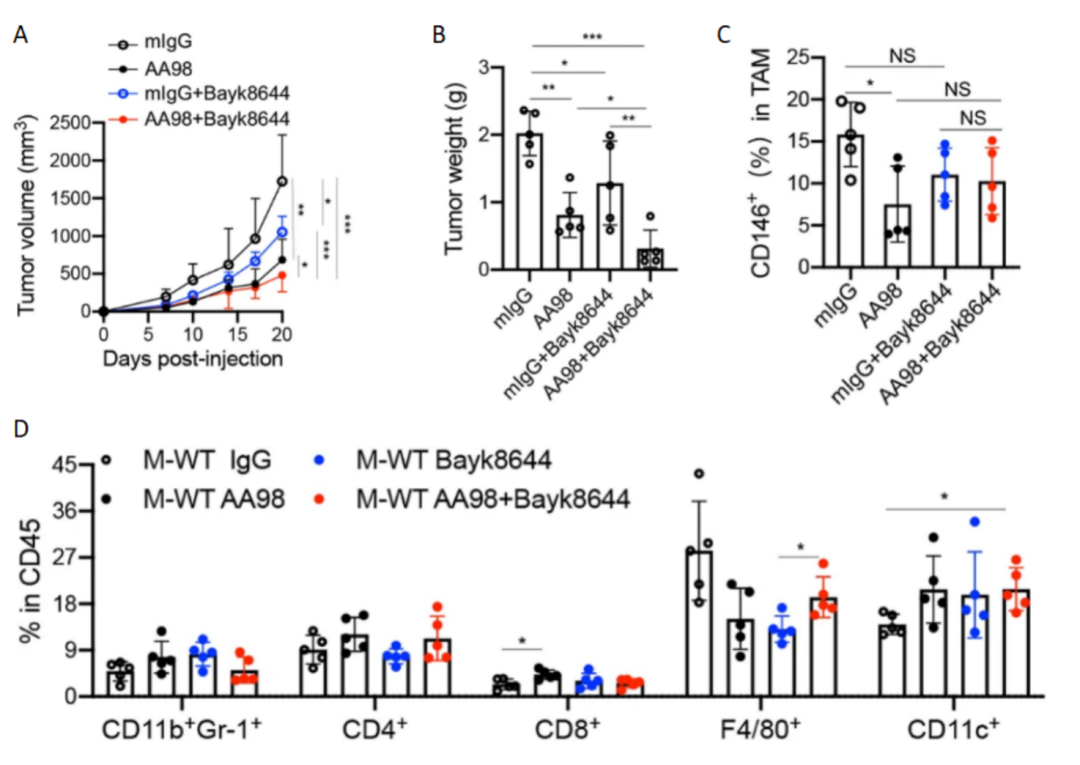
图 11 A-B每周两次给药AA98和/或BayK8644(1 mg/kg)的C57小鼠中,MC38肿瘤的体积(A)和重量(B)(n = 5)。C-D FCM分析CD146+ TAMs(C)和MDSCs、CD4+、CD8+ CD11b+F4/80+和CD11b+CD11c+在从肿瘤分离的CD45+白细胞总数中的百分比(D)(n = 5)。
在该研究中,研究人员阐明了TAMs重塑TME的机制,揭示了CD146+ TAMs的关键抗肿瘤作用,为癌症免疫治疗的TAMs靶向策略提供了新的见解。
鸣谢:Jing L, An Y, Cai T, et al. Cell Mol Immunol (2023). https://doi.org/10.1038/s41423-023-01047-4
更多内容请访问:AbMole官网(www.abmole.cn)





















 775
775











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








