Automatic multiorgan segmentation in thorax CT images using U-net-GAN
使用U-net-GAN在胸部CT图像中的自动多器官分割
发表期刊:Medical Physics(医学3区)
发表时间:2019年
Abstract
Purpose: 准确及时的风险器官 (OAR) 分割是高效和高质量放射治疗计划的关键。 这项工作的目的是开发一种基于深度学习的方法,在胸部计算机断层扫描 (CT) 上自动分割多个胸部 OAR,用于放射治疗计划。
Methods: 我们提出了一种对抗性训练策略来训练深度神经网络,以在胸部 CT 图像上分割多个器官。提出的对抗网络设计,称为 U-Net 生成对抗网络 (U-Net-GAN),联合训练一组 U-Net 作为生成器和完全卷积网络 (FCN) 作为鉴别器。具体来说,由 UNet 组成的生成器通过从 CT 图像学习到多器官分割 OAR 的端到端映射,生成多个器官的图像分割图。鉴别器,结构为 FCN,区分ground truth和生成器产生的分割 OAR。生成器和鉴别器在对抗学习过程中相互竞争,以产生多个器官的最佳分割图。我们的分割结果与手动分割的 OAR(ground truth)进行了比较,以通过研究 20 个立体定向体放射治疗 (SBRT) 肺部计划中的剂量体积直方图来定量评估几何差异以及剂量学性能。
Results: 这种分割技术被应用于使用 35 名患者的胸部 CT 来描绘左右肺、脊髓、食道和心脏。上述五种 OAR 的平均Dice相似系数分别为 0.97、0.97、0.90、0.75 和 0.87。在所有 35 名患者中,使用所提出的方法获得的 5 个 OAR 的平均表面距离平均在 0.4 和 1.5 mm 之间。 5 个 OAR 的 20 个 SBRT 肺计划的平均剂量差异为 0.001 至 0.155 Gy。
Conclusion:
我们研究了一种新颖的基于深度学习的方法,该方法采用 GAN 策略,使用胸部 CT 图像分割胸部中的多个 OAR,并证明了其可行性和可靠性。这是提高胸部放射治疗计划效率的潜在有价值的方法。
Keywords
chest segmentation, CT, deep learning
Introduction
肺癌是第二种最常见的癌症,也是男性和女性癌症死亡的主要原因。根据分期和癌症类型,30% 至 60% 的肺癌患者在治疗期间接受放射治疗. 放射治疗也是某些肺癌的标准治疗。放射治疗的成功很大程度上取决于对危险器官 (OAR) 的辐射暴露的控制,例如正常的肺、食道、脊髓和心脏等。因此,准确的正常组织描绘对于放射治疗的结果至关重要,尤其是高度适形的放射治疗,如调强放射治疗 (IMRT)、质子治疗和立体定向体部放射治疗 (SBRT)。这些高度适形的治疗旨在塑造目标体积的辐射剂量,同时节省 OAR 的剂量,并且通常计划有急剧的剂量下降。轻微的错误划分可能会导致对器官的灾难性高剂量。在当前的临床实践中,通常由临床医生在计算机断层扫描 (CT) 图像上手动描绘目标和风险器官,这是繁琐,耗时且费力的。CT图像为不均匀性校正提供了准确的几何信息和电子密度,但软组织对比度低。这使得软组织 (例如食道) 的手动描绘特别困难,并且容易因观察者间和观察者内的变化而产生错误。在过去的几十年中,研究人员和临床医生花费了巨大的精力来开发自动轮廓方法以提供准确且一致的器官描绘。
基于图集的方法是一种直接的自动分割方法,可用于多种商业产品。该方法将包含预轮廓结构的图集模板与要分割的图像一起配准,并将预轮廓结构传播到新图像。该技术的分割精度很大程度上取决于图像配准的精度。由于器官形态、患者之间的变异性和图像伪影,并不总是能保证准确的配准。这个问题可以通过更大和更多变量的图集数据集来缓解。然而,肿瘤形状的不可预测性使得很难在模板中包含所有可能的病例。 此外,可变形图像配准的计算成本很高,并且大量的图集模板会随着计算成本的飙升而提高分割精度。 基于模型的方法利用统计形状模型进行自动分割。这些方法的准确性取决于模型的可靠性。 虽然模型是基于已建立数据集的解剖学知识构建的,但广义模型在不规则图像上的表现有限。
深度学习在计算机视觉显示巨大的潜力。这个数据驱动的方法探讨了数以百万计的图像特性来促进各种视觉任务,如图像分类、对象检测和分割。观察到深度学习在计算机视觉中的成功,研究人员将基于深度学习的技术扩展到医学成像,并开发了自动分割技术。 Ibragimov 和 Xing 提出了一种基于卷积神经网络 (CNN) 的算法来分割头部的 OAR和颈部区域。利用传统的CNN和马尔可夫随机场的后处理,他们获得了与最先进的自动分割算法相似的分割精度。Roth等人用粗到精的方案修改了传统的CNN,并将其应用于胰腺分割。传统的CNN架构通常由多个隐藏的卷积层组成,每个卷积层后都有整流线性单元 (remu) 和池化层。然后,将这些隐藏层获得的深层特征馈送到完全连接的层中,以生成输出。Long等人提出了一种全卷积网络 (FCN) 体系结构,该体系结构实现了端到端训练和像素到像素分割,即相等大小的输入图像patch和输出分割patch。FCNs用上采样层代替了常规CNN中的完全连接层。FCNs将下采样层的输出与上采样输出相结合,可以通过更精确的定位信息来提高输出分辨率。Ronneberger等人基于FCN开发了U-Net,其中包含从下采样层获得的更多上下文信息和从上采样层获得的更多结构信息。
自 2014 年推出以来,生成对抗网络 (GAN) 在生成图像建模方面取得了显著成功,并在众多应用中表现出出色的性能。生成对抗网络的架构集成了两个竞争网络,一个生成网络和一个判别网络,整合到一个框架中。生成器将给定数据映射到合成样本,鉴别器将生成的合成样本与真实样本区分开来。这两个网络以竞争的方式依次迭代训练,以提高另一个网络的性能,最终目标是生成无法与真实样本区分的合成样本。
在这项工作中,我们采用GAN策略,U-Net作为生成器,FCN作为鉴别器,并实现了优于或与最新方法相当的分割精度。据我们所知,该方法是第一种利用GAN技术的胸部CT自动分割方法。
Materials and Methods
提出的多个 OAR 的分割算法由训练阶段和分割阶段组成。 图 1 概述了我们的分割方法的工作流程示意图。 对于给定的一组胸部 CT 图像及其相应的手动分割的 OAR,包括心脏、左肺、右肺、脊髓和食道,手动轮廓被用作胸部 CT 图像的深度学习目标。由于脊髓和食道比心脏和肺小得多,因此仅使用一种分割模型很难同时分割所有轮廓。 为了解决这个问题,我们首先训练一个基于三标签的分割模型来同时分割心脏、左肺和右肺。 分割模型的每个标签代表一个参考区域。 分割模型由一个 2.5D 端到端的基于patch的 GAN 模型实现,该模型以四个连续的 CT 图像切片作为输入patch,即补丁大小为 512×512×4,并输出相等的 大小的心脏、左肺和右肺分割。食管和脊髓分割分别在裁剪的感兴趣区域(ROI)patch上进行训练。这些ROI是根据食道和脊髓与肺的相对位置获得的。我们首先定位包含肺总体积最大的切片,并将食管ROI的中心设为总肺的质心(所有点的平均位置)。同样,将脊髓ROI的中心设为同一切片上左肺和右肺最后两个点的中点。ROI大小设置为64×64 ,以确保食道或脊髓包含在所有CT切片的裁剪区域中,作为ROI提取的第一个网络的解剖异常值或潜在错误的缓冲。用于食管和脊髓分割的 3D GAN 模型采用相同的架构,以 64×64×64 个 CT patch作为输入和输出等大小的二进制分割。对于 2.5 D 和 3D GAN 模型,输入patch都是通过步长为1×1×2的patch裁剪获得的,即每两个相邻的块有两个重叠的切片。
在分割阶段,首先从新的CT图像中提取由四个连续切片组成的patch,并将其送入第一分割模型中,以获得心脏,左肺和右肺轮廓。然后,根据第一个模型生成的肺轮廓裁剪食道和脊髓的ROIs。将3D ROIpatch输入训练有素的第二和第三分割模型中,分别获得端到端食道和脊髓轮廓分割。最后,所有分割都根据原始CTpatch的空间信息确定了各自的位置。通过patch融合重建OAR轮廓,并通过轮廓细化 (例如填充孔,侵蚀和扩张操作) 进行细化。

Fig.1 提出的胸部计算机断层扫描 (CT) 多器官分割算法的示意性流程图。上部 (白色) 显示了所提出方法的训练阶段,该阶段由三个生成对抗网络 (GAN) 组成。下部 (浅蓝色) 显示分割阶段。在分割阶段,将CT切片送入三个训练有素的模型中,以进行危险器官分割。[彩色图形可在wileyonlinelibrary.c om查看]
Data
本研究中使用的 35 组胸部 CT 图像来自 2017 年 AAPM 胸部自动分割挑战赛。每次扫描都包含整个胸部区域,并根据 RTOG1106 指南描绘手动轮廓。数据集的详细描述可以在参考资料中找到。
Generative adversarial network
由于 CT 图像的对比度限制,手动轮廓,尤其是器官边界周围的轮廓,容易出现观察者间的差异。由于手动轮廓作为分割网络的目标,轮廓可变性导致端到端网络模型(例如 U-Net)的不稳定。 GAN 模型将端到端网络作为生成器,并通过判别器引入额外的判断,以帮助生成器找到最佳解决方案。如图2所示,基于GAN的分割模型由一个生成器网络和一个鉴别器网络组成。这两个网络在零和博弈框架下依次进行了优化。生成器的训练目标是增加鉴别网络的判断误差(即,通过产生与手动轮廓难以区分的新的分割轮廓来“愚弄”鉴别器)。鉴别器的训练目标是减少鉴别器网络的判断错误,增强区分真假的能力。在两个网络中都应用了反向传播,因此生成器产生了更逼真的分割,而鉴别器变得更加熟练地将分割的轮廓与手动轮廓进行区分。因此,我们在算法中应用了这个众所周知的GAN网络。

Fig.2 一个示例说明了生成对抗网络的过程。
所提出的 GAN 模型的细节如下所示。 CT patch被输入生成器网络 U-Net,以获得端到端的分割轮廓。如图 1 的生成器架构部分所示,生成器网络由压缩路径(左侧)、解压缩路径(右侧)和连接这两条路径的桥接路径(中间)组成。压缩路径由两个卷积层和一个池化层组成,以降低分辨率。在每个卷积层中,可以通过 3D 卷积提取特征表示,然后是参数整流线性单元 (PReLU)。解压路径由两个卷积层和一个反卷积层构成,以提高分辨率。解压路径与压缩路径的结构类似,只是压缩路径没有跨步卷积。解压缩路径使用桥接路径来连接来自相同大小的压缩和解压缩路径的特征。具有这种拼接的 U-Net,即密集块网络,鼓励每条路径同时获得高频信息(如纹理信息)和低频信息(如结构信息)来表示图像块。== 为了输出相等大小的分割轮廓概率图,使用了 2×2×2 步长的反卷积。 在生成器的最后,使用 soft-max 算子生成轮廓的概率图==。阈值用于将概率图二值化为轮廓的二进制掩码,称为生成的轮廓。 然后,如鉴别器架构部分所示,鉴别器用于判断生成的轮廓与参考手动轮廓的真实性。 判别器是一个典型的基于分类的 FCN,它由几个卷积层组成,每个卷积层后面跟着一个池化层。 鉴别器输出一个 1×1×1 的变量,其中 1 表示真,0 表示假。
生成器损失计算为“残差”图像的均方误差 (MSE) 和轮廓图像的二进制交叉熵损失之和。 “残差”图像计算为原始 CT patch与生成轮廓的概率图的逐元素相乘,参考“残差”图像计算为 CT patch和手动轮廓生成的分割掩模的乘积。二元交叉熵用作鉴别器损失。应用梯度下降的 Adam 优化器来最小化这两个损失。生成器和判别器是使用 TensorFlow python 工具箱实现的。 2.5D 网络的批量大小设置为 40,3D 网络的批量大小设置为 20。三个 GAN 的训练运行了 180 个 epoch,在 Titan XP 12 GB GPU 上,第一个网络需要 2 小时,第二个和第三个网络需要 3.5 小时。网络训练通常在 100 个 epoch 后收敛,我们增加了更多的 epoch 以提高鲁棒性。
Residual loss for generator optimization
在训练期间,传统的生成器使用相似性或相异性损失函数,例如二元交叉熵或 Dice 损失来计算生成器损失。 但是,由于不同标签之间的区域大小通常不同,因此将它们放在一起损失是不公平的。因此,我们建议使用残差损失来应对这种不公平。 “残差”图像是通过计算生成轮廓的概率图和原始 CT patch的元素乘法来生成的。 “残差”图像的 MSE 与轮廓图像的二进制交叉熵损失相结合,以计算生成器损失。
Evaluation
我们在 35 组胸部 CT 图像上实施了所提出的方法,并进行了留一交叉验证。换句话说,我们有 34 组图像用于训练和验证,剩下的一组用于测试。提议的网络运行了 35 次,生成了 35 组测试结果。所提出方法的性能通过六个指标进行量化:Dice相似系数 (DSC)、灵敏度、特异性、95% Hausdorff 距离 (HD95)、平均表面距离 (MSD) 和残余均方偏差 (RMSD)。 DSC 计算ground truth轮廓和使用所提出方法生成的轮廓的重叠,

其中X和Y分别是ground truth 轮廓和用所提出的方法获得的轮廓。敏感性和特异性量化了ground truth体积内外的重叠率

灵敏度和特异性量化了ground truth体积内外的重叠率,其中“X”和“Y”分别是ground truth轮廓和自动分割轮廓外的体积。平均表面距离 (MSD) 计算两个有向平均表面距离的平均值,

其中,有向平均表面距离为
,计算X中点到Y中最近邻居的平均距离。定向95% 豪斯多夫距离测量X中的点与Y中最近的点之间的所有距离的第95百分位距离,

HD95计算为两个有向95% Hausdorff距离的平均值

残差均方偏差计算分割轮廓和手动轮廓之间的残差均方距离。 RMSD 计算为

为了评估所提出的自动分割方法的剂量学影响,我们制作了 20 个肺 SBRT 计划,这些计划具有在每个 CT 图像数据集的肺部异常点上定义的ground truth轮廓和规划目标体积 (PTV)。 然后,我们计算了ground truth轮廓和自动分割轮廓之间的剂量体积直方图 (DVH) 差异。 与传统的分割放射治疗相比,SBRT 通常表现出更剧烈的剂量下降,因此需要更高的勾画精度。因此,评估计划是根据 SBRT 指导制定的。 所有 20 个计划均规定为 10 Gy,每次分 5 次,并标准化为 100% 处方剂量至 PTV 体积的 95%。 我们计算了ground truth轮廓和自动分割轮廓之间的 Dmean、D95、D50、D5、Dmin 和 Dmax 差异,以访问所提出方法的临床可行性。 对于全肺,我们还计算了更多临床相关的剂量指标,D1000 cc 和 D1500 cc。
Results
图 3 和图 4 显示了使用所提出的 U-Net-GAN 方法对一名患者进行的 2D 和 3D 分割结果。所提出的方法分割双侧肺、心脏和脊髓,并成功描绘了食道。使用我们的方法获得的 OAR 与ground truth轮廓非常相似。

Fig.3 (a) 一名患者的三个横向计算机断层扫描切片,以及从(b)手动轮廓(ground truth)和(c)所提出的方法中获得的相应风险器官轮廓。

Fig.4 通过(a)手动轮廓和(b)所提出的方法获得的图 3 中同一患者的风险器官轮廓的 3D 可视化。
定量评估结果总结在图 5 和表 I 中。图 5 显示了对所有 35 名患者进行计算的六个评估指标——DSC、敏感性、特异性、HD95、MSD 和 RMSD,其平均值和标准差列于表中 I. 如图 5 和表 I 所示,所提出的方法在左肺、右肺和脊髓上实现了优异的分割精度,分别为 0.97、0.97 和 0.90 的平均 DSC,平均 HD95 为 2.07、2.50 和 1.19 毫米,所有平均 MSD 小于 1 毫米。由于图像对比度降低,心脏分割不如肺和脊髓分割简单。定量评估表明,所提出的方法与心脏描绘的基本事实非常吻合。平均DSC为0.87,平均HD95为4.58 mm,平均MSD为1.49 mm。在CT图像上,食管是五个器官中对比度最低的,因此最难描绘。提出的方法在食道分割上获得0.75±0.08 DSC、4.52±3.81 mm HD95和1.05±0.66 mm MSD。灵敏性评估真实的OAR体积与从该方法获得的体积重叠,而特异性量化真实体积之外的重叠部分。该方法的平均分割灵敏度为0.74–0.97,双侧肺最高,食道最低。这五种器官的特性几乎是一致的。五个器官的平均RMSD范围为0.8至3.1 mm。

Fig.5 六个评估指标,(a) Dice相似系数,(b) 灵敏度,© 特异性,(d) 95% Hausdorff 距离,(e) 平均表面距离和 (f) 对 35 名患者的五个风险器官计算的残余均方偏差-。
Table.1 DSC、灵敏度、特异性、HD95、MSD 和 RMSD 的平均值和标准差。 括号中列出了最小值和最大值。

图 6 显示了ground truth与五个 OAR 体积的建议方法之间的线性回归分析。线性相关性 R2 大于 0.84,并且所有 P < 0.001,这表明ground truth体积与使用所提出方法获得的体积之间存在很强的统计相关性。

Fig.6 线性回归分析通过手动轮廓(ground truth)和提议的方法获得的(a)食管,(b)心脏,(c)左肺,(d)右肺,以及(e)脊髓体积。蓝色圆圈表示个体患者的测量,红色虚线表示回归线。
我们还评估了使用所提出的自动分割方法获得的轮廓的剂量影响。如图 7 所示,从手动轮廓获得的示例患者的所有五个 OAR 的 DVH 与所提出的方法匹配良好。 我们计算了从手动轮廓获得的所有五个 OAR 的 Dmean、D95、D50、D5、Dmin 和 Dmax 差异以及所有 20 个计划的建议方法。表 II 总结了基于真实 OAR 剂量和自动分割 OAR 剂量计算的剂量差异的平均值、标准偏差和相应的 P 值。所有 32 个剂量学指标中有 26 个显示 P > 0.05,表明ground truth OAR 和自动分割 OAR 之间没有统计学上显著的剂量差异。所有五个 OAR 的 Dmean、D95、D50、D5 和 Dmin 的平均差异均小于 0.7 Gy。平均 Dmax 差异范围为 0.06 至 1.5 Gy。 全肺D1000 cc和D1500cc的平均剂量差异均小于0.02 Gy,均P>0.05。
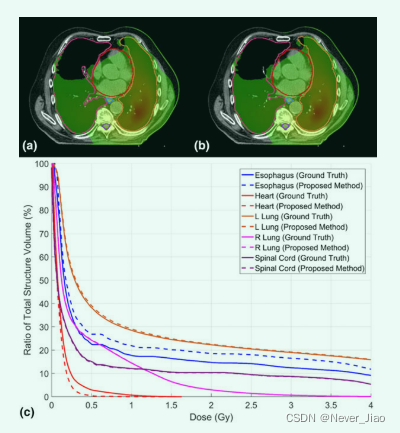
Fig.7 一名患者的剂量分布(a)ground truth 轮廓和(b)自动分割轮廓,以及(c)相应的剂量体积直方图。 (a) 和 (b) 的窗口宽度:0.1-1 Gy。
Table2. 在20个立体定向身体放射治疗计划中,使用ground truth危险器官 (OARs) 剂量和自动确定的OARs剂量计算的剂量差异和p值的平均值和标准偏差 (SD)

Discussion
靶点和 OAR 的勾画是治疗计划的先决条件,特别是对于高度适形放射治疗,因为这些治疗计划是根据靶点和 OAR 的剂量限制进行优化和评估的。 勾画的准确性直接影响治疗计划的质量。手动轮廓受到臭名昭著的观察者间和观察者内部可变性的影响,轮廓质量高度依赖于临床医生的专业知识和经验。所提出的自动分割方法提供了独立于观察者的准确和一致的器官描绘。虽然手动轮廓通常需要大约半小时到几个小时,具体取决于解剖部位,但训练有素的自动分割方法可以在几秒钟内完成多个 OAR 轮廓。这大大缩短了治疗计划的准备过程,节省的时间既可以用于获得更好的治疗计划,也可以加速快速生长的肿瘤的治疗。 自动分割还显示了促进在线自适应放射治疗 (ART) 的潜力。 在线 ART 适应患者的日常变化。 整个过程,从日常成像到器官轮廓、重新规划和规划 QA,需要在 10-20 分钟内结束,因此,希望尽量减少每个步骤的处理时间。 所提出的方法在具有 12 GB 内存的 NVIDIA TITAN XP GPU 上执行,并在 6 秒内分割所有五个器官。 在更强大的 GPU 的帮助下,可以进一步减少分割时间。
U-Net-GAN 通过引入鉴别器改进了 U-Net 方法。为了提供具体的改进展示,我们进行了一个留一法实验来比较 U-Net 在有和没有对抗性网络的情况下产生的结果,如表 III 所示。 UNet 的所有参数都是根据提供最佳性能的参数设置的。如表所示,在对抗网络的帮助下,大多数评估指标都得到了改善(DSC、Specificity 和 Sensitivity 增加;HD95、MSD 和 RMSD 减少)。
Table3. U-Net 和 U-Net 生成对抗网络 (U-Net-GAN) 之间的分割比较,所提出的方法,具有Dice相似系数 (DSC)、灵敏度、特异性、95% Hausdorff 距离的均值和标准差 ( HD95)、平均表面距离 (MSD) 和剩余均方偏差 (RMSD)。

这项工作中使用的数据集是2017年AAPM胸部自动分割挑战获得的。参考文献 [35] 显示了来自七个研究所的细分结果。七个研究所中有五个开发了基于深度学习的方法,另外两个 (研究所 #4和 #6) 使用了基于多图谱的方法。我们将使用我们提出的方法的分割结果与七个组的结果进行了比较,并在表IV中列出了比较结果。我们的方法在双侧肺,心脏和脊髓上产生相似的DSC,但在食道分割方面优于所有七种方法。用所提出的方法获得的MSD和HD95在所有五个器官上均优于所有七种方法。
为了评估自动分割轮廓的剂量学影响,我们制作了 20 个具有真实轮廓的肺 SBRT 计划,并比较了手动轮廓和自动轮廓的 OAR 剂量。 在 32 个评估剂量指标中,29 个指标计算出的平均剂量差小于 0.5 Gy,24 个计算出的差值小于 0.1 Gy。 32 个指标中有 26 个的 P 值大于 0.05,表明差异无统计学意义。 对于 P 值小于 0.05 的六个剂量指标,表 V 列出了它们在ground truth轮廓和自动分割轮廓上的平均剂量值。 ground truth轮廓和自动分割轮廓上的食管 Dmin、D95、D50、Dmean 和左肺 D95 均小于 1.4 Gy,剂量差异小于 0.2 Gy。尽管 P 值小于 0.05,但 0.03-0.2 Gy 的剂量差异很小。右肺的平均 Dmax 差异为 1.527 Gy,P 值为 0.03。 Dmax 对轮廓边缘敏感,尤其是当 OAR 位于剂量急剧下降区域时。 20 个计划中有 16 个 PTV 位于右肺,因此,可以预期右肺的 Dmax 和 Dmax 差异大于其他 OAR 的差异。如表 V 所示,右肺平均 Dmax 为 44.4,1.5 Gy 计数仅为 3.4% 相对差异。此外,临床医生在评估 SBRT 计划时更加重视 D1000 cc 和 D1500 cc 全肺,这两个指标显示出非常小的差异(<0.02 Gy,P > 0.05)。
Table4. 所提出的方法与七种方法的分割比较参加了 2017 年 AAPM 胸部自动分割挑战赛。

Table5. ground truth轮廓和自动分割轮廓上的平均剂量,以及表 II 中列出的 P < 0.05 的六个剂量体积直方图 (DVH) 指标的相应差异。

与基于图谱和基于模型的方法相比,基于深度学习的方法是在具有大量特征的大量数据上开发的,因此有可能为变化较大的问题提供更好的解决方案。在将计算机视觉中已建立的图像分割方法应用于医学成像时,第一个挑战是缺乏训练数据。这些已建立的方法建立在几千到几百万个训练样本上,这对于医学成像来说是不切实际的。 在这项工作中,通过留一法交叉验证,只有 34 组胸部 CT 可用于训练。 为了补充训练数据,我们在可用 CT 图像上应用了数据增强技术,例如移位、镜像、翻转、缩放和旋转。 通过强化增强,当超过 20 组 CT 时,所提方法的性能趋于稳定 数据用于训练。 这种方法也有现实的迹象。 患者运动,如平移和旋转,不会改变器官之间的相对位置。 包括转换后的数据可以帮助避免过度拟合并帮助分割算法学习这种不变的属性。
值得注意的是,所提出的方法在所有 35 名患者中的表现并不统一。 某些患者(例如患者 #11、#17 和 #33)的分割准确度低于其他患者。 11 号患者左肺塌陷,右肺延伸到中线。 所提出的方法将右肺的一部分错误地标记为左肺。 17 号和 33 号患者有较大的肺部病变,所提出的方法对病变进行了不同于手动轮廓的标记。 如前所述,当存在异常结构时,所提议的网络往往会错误地标记器官。 这个问题可以通过包含更多样化和可变的训练数据来缓解。
由于患者之间的尺寸差异和变异,很难平衡四个器官之间的损失函数。 将所有分割集成到一个网络中会使训练过程复杂化并降低分割精度。 为了简化该方法,我们将相似尺寸的 OAR 分组,并利用三个子网络进行分割,一个用于肺和心脏,另一个用于食道和脊髓。 这种方法以计算效率为代价提高了分割精度。 如果我们想应用所提出的方法来分割更多的 OAR,这可能是一个问题。 未来,我们将探索在单个网络中进行多器官分割的可能性。
手动轮廓绘制的不确定性会导致计划优化中的错误,并导致非最优或不可接受的计划。 菲奥里诺等人 对前列腺和精囊描绘的观察者内部和观察者之间的变化进行了研究,发现 2-3 毫米的轮廓变化导致膀胱和直肠的平均剂量变化 4% 和 12%,接受 95% 处方剂量的量有 10% 的不确定性。 Nelms 等人还观察到由于 OAR 轮廓变化对头部和颈部患者的显著剂量影响,其中平均剂量范围为- 289% 至 56%,最大剂量范围为 22% 至 35%。 观察到近距离放射治疗的类似不确定性,其中 OAR 轮廓 变异导致 D2 cc.39 中有 10% 的不确定性。在这项工作中,我们评估了使用自动分割轮廓来评估治疗计划的可行性。 为了进一步验证所提出方法的日常临床实施,我们将使用自动分割轮廓评估治疗计划的可靠性。
Conclusion
我们研究了一种新的基于深度学习的方法,该方法采用 GAN 策略,使用胸部 CT 图像分割胸部中的多个 OAR。已经进行了实验验证以证明其临床可行性和可靠性。这种多重 OAR 分割可能是提高肺部放射治疗计划效率的有用工具。



























 2010
2010

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








