推荐阅读:
1.ips细胞治疗糖尿病研究进展综述
2.iPS细胞重编程实验相关实验材料
现在有几种新的方法可以诱导产生诱导多潜能干细胞(induced pluripotent stem cells, iPS),通过这些方法产生的iPS细胞可以降低产生插入突变的风险。
尽管iPS细胞有着诱人的临床应用前景,但目前还存在着几个重要的难关需要克服。其中最重大的挑战来自于目前诱导产生iPS细胞的方法。现在诱导产生iPS细胞的方法是通过借助逆转录病毒为载体,将几种癌基因转入分化细胞诱导其成为iPS细胞,而这种方法就有可能会因为外源基因插入细胞基因组,干扰了内源基因的表达,从而诱发癌症。现在,有三项研究结果表明可以通过其它的小分子基因转染方法来克服上述这个困难。
Stadtfeld等人在《科学》(science)上发表文章介绍了他们使用腺病毒载体(adenoviral vectors)诱导小鼠iPS细胞产生的过程,而Okita等人则使用转染质粒(plasmid)的方法成功构建了小鼠iPS细胞。本文介绍了Huangfu等人的另一项工作成果,他们发现在诱导人iPS细胞产生的过程中,可以用一种小分子物质代替以往使用的一种癌基因,也就是说现在只需要转染两个基因就可以成功得到iPS细胞。
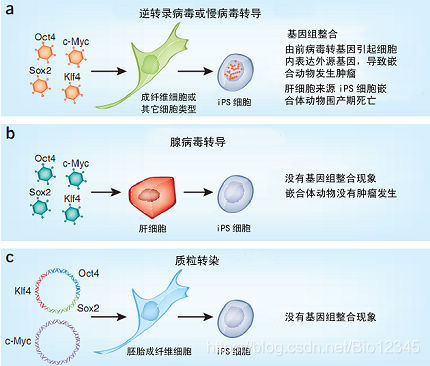
体细胞通过大量表达一些在胚胎干细胞中高表达的基因会重编程为胚胎样细胞,这种产生iPS细胞的方法被称作“Yamanaka”法(见文后小词典1),因为该方法是由Shinya Yamanaka建立的。现在已经有好几种基于“Yamanaka”法这种“鸡尾酒”式方法(因为该方法要将几种癌基因转染到细胞中)的改良方法出现了,不过所有这些方法使用的载体都一样,全是具有整合功能的逆转录病毒载体,包括慢病毒(lentiviruses),见图1a。体细胞被转入这些“重编程因子”(reprogramming factor)之后,会激活本来只会在胚胎干细胞中才表达的内源基因的表达,同时也会抑制“细胞分化机制”的表达,结果体细胞就变成了与胚胎干细胞表型和功能类似的iPS细胞。尽管目前还不清楚细胞发生这种转变的机制,但实践已经证明,“Yamanaka”法可以将多种体细胞转变成iPS细胞。
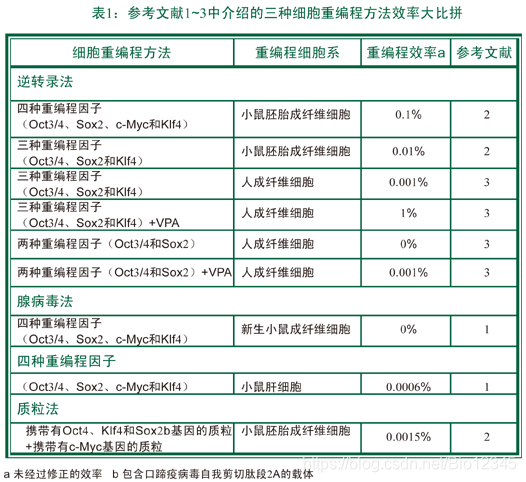
最近发表的三篇论文则展示了另外一种策略——无需逆转录病毒载体的策略——来诱导产生iPS细胞,因此也就避免了使用逆转录病毒载体所带来的基因插入、整合、突变等问题。腺病毒基因组不会整合入宿主细胞基因组中,实际上,Stadtfeld等人使用PCR和Southern blotting等方法也没有在试验中发现腺病毒基因组整合到宿主细胞基因组之中去的迹象,见图1b。Stadtfeld小组使用腺病毒载体重复感染小鼠肝细胞(hepatocytes),成功地将小鼠肝细胞重编程为iPS细胞,不过使用腺病毒载体相比使用逆转录病毒载体来说,成功的几率要小得多,见表1。可能的原因是因为腺病毒载体无法在细胞内进行复制,因此它所携带的外源基因在细胞内也就只能表达3~8天,所以成功率低。如果要将小鼠成纤维细胞(fibroblasts)重编程为iPS细胞,那么外源基因在细胞内至少要能表达8天,也就是说使用腺病毒载体重编程成纤维细胞几乎不可能。
Stadtfeld等人通过试验发现,小鼠成纤维细胞这种最常用作重编程iPS细胞的体细胞,如果含有哪怕一个拷贝的Oct4转基因成分,就能通过腺病毒载体,只将Sox2、c-Myc和Klf4这三个基因(而不是“Yamanaka”法中使用的四个基因)转入小鼠成纤维细胞即能成功诱导出iPS细胞。Stadtfeld使用的腺病毒载体来自于人类腺病毒血清型5型,该病毒可以通过柯萨奇病毒(coxsackievirus)受体或腺病毒(adenovirus receptor, CAR)受体感染人类上皮细胞(epithelial cells),这也提示我们使用腺病毒载体可以重编程表达CAR的任何人类体细胞。不过不能有效地与小鼠腺病毒受体结合,因此不能有效感染小鼠细胞。最近发现在体内,腺病毒通过与某些血液因子(例如凝血因子、补体因子等)结合感染肝细胞,该机制在人体内与小鼠内都存在。这也就能解释为什么Stadtfeld等人能用腺病毒有效地重编程小鼠肝细胞而不能有效重编程小鼠成纤维细胞。当然也有其它的原因存在,例如小鼠肝细胞相比小鼠成纤维细胞而言,它的表型(epigenetic)与转录谱更接近于小鼠胚胎干细胞,这也有可能是小鼠肝细胞更容易重编程为iPS细胞的原因之一。
Okita等人则完全不使用病毒载体,只简单使用质粒来转染细胞,见图1c。他们使用了两个质粒,一个质粒携带有Oct4、Klf4和Sox2基因,另一个质粒携带c-Myc基因,重复转染小鼠胚胎成纤维细胞7天,他们取得了令人吃惊的成果。不过就像使用腺病毒载体一样,使用质粒载体的效率相比逆转录病毒载体来说也是非常低,见表1。当然使用质粒载体也会出现外源基因随机整合入细胞基因组的情况。尽管概率非常低,Okita小组还是借助PCR和Southern blotting发现,有少部分细胞克隆中发生了随机插入的事件。
以前的研究发现前病毒(proviral)特异性整合位点对于重编程来说并不重要,因为到目前为止我们得到的iPS细胞中都还没有发现特别明显的通过整合位点将外源基因整合到细胞基因组的现象。Stadtfeld研究小组和Okita团队的研究成果告诉我们,不借助逆转录病毒整合细胞基因组的功能,即不“打扰”细胞基因组,我们也能重编程体细胞获得iPS细胞。而且不论是使用腺病毒载体或质粒载体,瞬时过表达Oct3/4、Sox2、c-Myc和Klf4这四个基因都有可能避免重编程导致的诱导肿瘤发生或iPS细胞嵌合小鼠围产期死亡(perinatal death)的发生,过去认为这两种现象都是由于表达Oct3/4、Sox2、c-Myc 和Klf4这四个外源基因造成的,见图1。不过要重编程人类成纤维细胞还需要相当长的一段时间,因为使用腺病毒或质粒载体重编程人类细胞的方法还需要进一步的优化。
还有一种避免逆转录病毒导致细胞基因组插入突变的办法就是使用小分子来替代细胞重编程过程中使用的转基因的办法。这些小分子物质还要能提高转染的效率,得到没有细胞基因组插入的人类iPS细胞。Huangfu等人仔细研究了常用的逆转录病毒转染办法之后决定,要开发一种小分子物质来取代一个或更多的重编程因子。他们发现只转染两个因子Oct4和Sox2,再加上组蛋白脱乙酰基酶抑制剂(histone deacetylase inhibitor)——丙戊酸(valproic acid, VPA),就完全能够将人类成纤维细胞重编程为胚胎样细胞。现在,人们通过试验发现不论是在人类细胞试验中还是在小鼠细胞试验中,不论是和两个、三个或四个基因共转染,VPA都可以极大地提高重编程的效率。这一试验结果也强调了细胞重编程过程中目前机制尚不明确但功能非常重要的染色质重构(chromatin remodeling)过程的作用。
研究VPA与腺病毒或质粒载体联用是否能够提高重编程的成功率将是一件非常有意思的工作。将Stadtfeld和Okita的研究成果放在一起进行综合分析我们可以发现,重编程的基本原理与采用何种转基因方式根本无关,因此,VPA与腺病毒联用或者与质粒联用,效果应该是一样的。也许最终我们会发现,只需要一些小分子物质,根本不需要转基因,也能将体细胞重编程为iPS细胞。不过由于我们对体细胞重编程过程及其机制还不清楚,所以现在也不能下结论说使用化学小分子进行重编程就不会带来副作用,就一定会比使用逆转录病毒载体或瞬时表达癌基因方法更安全。不过使用腺病毒载体或质粒载体瞬时表达Oct3/4、Sox2、c-Myc和Klf4这四个基因进行细胞重编程的方法将有望为按照《良好组织规范》(Good Tissue Practice,见文后小词典2)生产供临床使用的人类iPS细胞系提供有益的借鉴。
不通过逆转录病毒整合入细胞基因组的方法来诱导产生小鼠iPS细胞这种新的细胞重编程方法还存在许多有趣的问题需要去研究和探索。不需要基因组插入的细胞重编程方法能用于人体细胞吗?这些重编程因子的作用机制是怎样的?细胞重编程过程会给细胞基因组带来明显的改变或者造成基因组不稳定吗?这些外源性的重编程因子会让某些细胞更容易进行重编程吗?iPS细胞和胚胎干细胞在功能上以及分子水平上有什么不同吗?各种向细胞中转入重编程因子的方法以及其使用的“试验材料”会给最终得到的iPS细胞功能上带来什么影响吗?如果上面这些问题都还没有弄清楚,那么iPS细胞就不应该应用到临床上。
YORK/编译
William E. Lowry, Kathrin Plath/原文作者
William E. Lowry工作于美国加利福尼亚大学洛杉矶分校分子细胞发育生物学系,e-mail:blowry@ucla.edu。
Kathrin Plath工作于美国加利福尼亚大学洛杉矶分校David Geffen医学院生物化学系,e-
mail:kplath@mednet.ucla.edu。
参考文献:
1 Stadtfeld, M., Nagaya, M., Utikal, J., Weir, G. & Hochedlinger, K. Science published online, doi: 10.1126/science. 1162494 (25 September 2008).
2 Okita, K., Nakagawa, M., Hyenjong, H., Ichisaka, T. & Yamanaka, S. Science published online, doi: 10.1126/ science. 1164270 (9 October 2008).
3 Huangfu, D. et al. Nat Biotechnol. 26, 1269-1275 (2008).
4 Takahashi, K. et al. Cell 131, 861-872 (2007).
5 Takahashi, K. & Yamanaka, S. Cell 126, 663-676 (2006).
6 Yu, J. et al. Science318, 1917-1920(2007).
7 Yu, J. & Thomson, J.A. Genes Dev. 22, 1987-1997 (2008).
8 Aoi, T. etal. Science321, 699-702 (2008).
9 Stadtfeld, M., Maherali, N., Breault, D.T. & Hochedlinger, K. Cell Stem Cell 2, 230-240 (2008).
10 addington, S.N. et al. Cell 132, 397-409 (2008).
11 Okita, K., Ichisaka, T. & Yamanaka, S. Nature 448, 313-317(2007).
12 Huangfu, D. et al. Nat. Biotechnoi. 26, 795-797 (2008).























 1140
1140

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








