在创新药研发的快车道上,高效研发工具已成为趋势,高通量研究为新药研发提供了更清晰的探索。结合各种新型基因研究方法的384孔高通量电转染平台就是近年来加速新药开发和疾病机理研究的其中一种高效研发工具的代表。
2021年是Nucleofector™技术诞生20周年,这是一种被引用超过10,000次的非病毒细胞转染方法。自开发以来的20年里,Nucleofector™技术作为有效的非病毒细胞转染方法引领市场,且推动了流行病学、肿瘤免疫等领域的研究。
🤔这这这工具 可干大事儿
北京泽平Lonza384孔Nucleofector电转平台中国一级代理,请搜索“泽平科技”进入咨询。Nucleofector™技术是Lonza公司的专利创新技术,是一种改进的电穿孔技术。对于转染方法而言,兼顾转染效率、细胞活力、维持细胞的功能性、以及处理规模和速度尤为重要。Lonza 384-well Nucleofector™技术具有以下优势:
-
快速 - 在一分钟内处理一个384孔板,转盘能够处理两个板;
-
高性能兼顾低材料消耗 - 高通量核转染的细胞数量条件低至2x10^4个细胞;
-
易于使用 - 现有的96孔Shuttle™方案适用;
-
自动化兼容 - 无缝整合到自动化液体处理环境中;
-
可用于阵列cDNA、RNAi或CRISPR文库筛选。
下文分享了Lonza 384-well Nucleofector™ 在制药巨头葛兰素史克(GSK)的应用案例,以及这款电转仪在近期多种前沿应用中的文献科研风采。
➤ GSK应用案例
寻找新颖、经验证和可成药的靶点是当前药物发现的最大挑战之一。全基因组功能丧失筛选(Genome-wide Loss-of-Function Screening)是发现生物过程相关基因和途径的一种成熟而有力的方法。
基因组CRISPR筛选可用于确定参与特定疾病发生发展的途径,以及途径相关的特定基因,从而发现潜在的药物靶点,开发许多候选基因。高通量筛选有望改变当前医学领域的主要方式,从治疗疾病症状转向瞄准其基本机制。
为增强该领域的实力,2019年,GSK公司与加州大学的一项合作得到了业界的广泛关注。GSK与CRISPR技术先驱Jennifer Doudna教授,以及CRISPR筛选技术先驱——加州大学旧金山分校的Jonathan Weissman教授创建了基因组研究实验室(LGR)。旨在通过使用RNAi和CRISPR/Cas9全基因组筛选探索基因组功能,了解疾病机制,发现新的疗法,加快新药开发。
在SLAS2020国际会议与展览上,GSK分享了“在T细胞中进行阵列CRISPR-Cas9基因编辑筛选的384孔工作流程”的研发经验。
图片来源:SLAS2020
GSK使用CRISPR-Cas9在原代CD4+ T细胞中开发了一种高效的阵列基因组编辑筛选,用于确定细胞因子释放相关的基因。在基因组编辑之前,先对T细胞进行分离、纯化和扩增。随后,利用Lonza 384-well Nucleofector™ 递送由向导RNA(gRNA)、反式激活CRISPR RNA(tracrRNA)和Cas9酶组成的RNP复合物。在静息和激活状态下,对编辑后的细胞进行下游的多细胞因子释放和细胞活力检测。
基于这一用于T细胞筛选的小型、稳健的高通量电转染方案和分析,GSK成功解决了原代T细胞的转染难题,并展示了全基因组阵列CRISPR-Cas9筛选在原代细胞转染中的潜力。
Lonza 384-well Nucleofector™ 电转染平台提供384孔板的高通量转染,短至1分钟的板处理时间和高重复性使其成为筛选应用的理想工具。同时可高效转染传统方法难以转染的原代细胞、干细胞、神经元和细胞系,引领基因治疗、免疫治疗、细胞治疗等先进疗法的开发,为广泛疾病领域带来了新的机遇。
➤ 赋能高通量CRISPR筛选,用于新冠研究
新冠肺炎疫情肆虐至今,已经给全球人类健康带来重大威胁。虽然国内新冠疫情局势得以控制但却时有反复。为破译病毒、了解如何与病毒斗争,传染病的药物开发和致病机制的研究工作一直在进行着。对于争分夺秒的突发公共卫生事件,高效、快速的研究工具起到十分关键的作用。

加州大学旧金山分校的研究团队使用Lonza 384-well Nucleofector™ 来进行阵列CRISPR筛选,以识别增强或抑制新冠病毒感染的宿主蛋白。
该研究通过Lonza 384-well Nucleofector™ 递送RNP,敲除Caco-2细胞的相关基因,再对野生型和基因编辑后的Caco-2感染0.01 MOI的SARS-CoV-2。经分析,最终确定的宿主蛋白(Tom70等)代表了潜在的药物靶点,为进一步开发新的治疗方法,以及现有疗法的重新利用(repurpose)打下了重要基础。该研究于2020年12月发表于Science杂志。
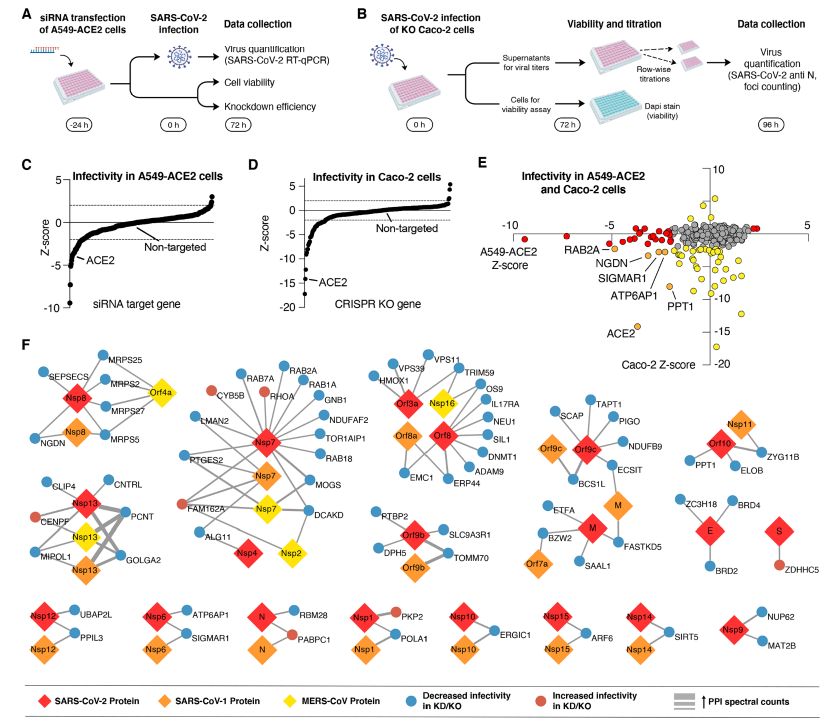
参考文献[1]

在近期发表的另一项研究中,巴斯德研究所的研究团队同样应用到了Lonza 384-well Nucleofector™ 系统进行高通量的CRISPR/Cas9筛选,评估了1905个ISG(IFN stimulated genes)在人肺上皮细胞中调节SARS-Cov-2复制的能力。
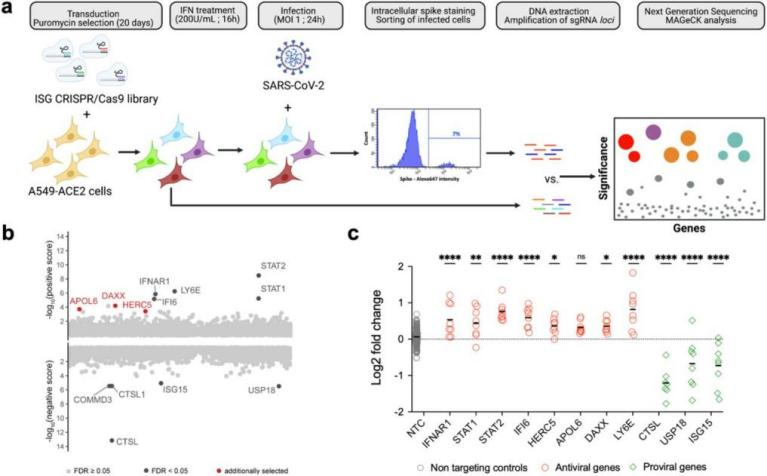
基于此,研究人员确定了一种限制SARS-CoV-2复制的抗病毒因子DAXX(death domain-associated protein,死亡结构域相关蛋白),为新冠研究带来了新思路。该研究于2021年5月发布在预印本bioRxiv平台上。
点击以上图片可阅读原文
[2]:https://www.biorxiv.org/content/10.1101/2021.05.06.442916v1
➤ 助力siRNA筛选靶点,开发脑瘤候选药物
自2020年CRISPR技术摘下诺奖桂冠以来,该领域的热度不断攀升;不过siRNA筛选仍是当前使用最为广泛的基因筛选方法。

丹麦癌症协会研究中心的研究人员基于Lonza 384-well Nucleofector™ 系统进行了高通量siRNA文库筛选,采用的siRNA库包含296个基因靶点,阳性对照(INCENP9)和阴性对照(siRNA的加扰对照),每个基因设计了3个independent siRNA。
基于此,研究人员发现了胶质母细胞瘤的潜在靶点——SPT6,并证实了SPT6丢失诱导的DNA双链断裂(DSB)是胶质母细胞瘤特异性的。该研究于2020年9月发布在Nature Communications上。

点击上图可直接阅读原文:
[3]:https://www.nature.com/articles/s41467-020-18549-8
➤ 解决原代细胞转染难题,揭示特发性肺纤维化治疗策略
除了高通量的基因筛选外,Lonza 384-well Nucleofector™ 系统对于难转染的细胞(例如原代细胞),还有着更多优势。
区别于细胞系,原代细胞具有正常细胞的形态,可更真实体现出细胞在生物体内的功能。然而原代细胞较难转染,如果使用脂质体或传统电转,转染效率往往较低。病毒转染也存在一些挑战,比如耗时长、包装尺寸有限、生物安全问题等。而Lonza 384-well Nucleofector™ 系统可以对不分裂的原代细胞进行高效的转染。

阿斯利康的科学家们采用了原代细胞Lonza IPF肺成纤维细胞,探索了IPF的关键疾病驱动机制。研究中,Lonza 384-well Nucleofector™ 系统成功对原代健康人类肺成纤维细胞的第2代细胞进行了CRISPR-Cas9 RNP电穿孔。
研究结果证明了PPP1R15A在调节肺间充质细胞中的主要作用,并且提示了特发性肺纤维化的一种新治疗策略。该研究于2021年11月3日在scientific reports上发表。
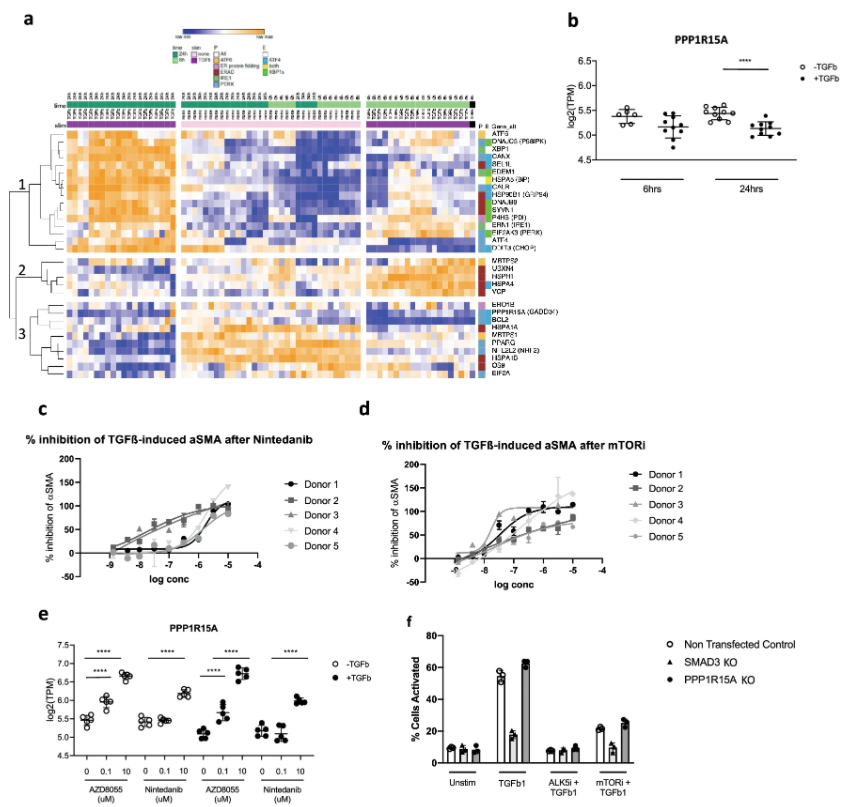
点击上图查看原文 [4]:https://www.nature.com/articles/s41598-021-00769-7#Sec30
➤ 多质粒的高通量电穿孔,优化CRISPR碱基编辑
CRISPR碱基编辑技术是设计细菌基因组的一种强有力的方法,不过,它的编辑仅限制于单核苷酸替换,这是该技术的一大瓶颈。

上海交通大学长聘教轨副教授童垚俊团队开发了一种基于CRISPR-Prime编辑技术的通用(无双链断裂)原核生物遗传操作工具箱,通过Lonza 384-well Nucleofector™ 系统进行高通量的多质粒电穿孔,实现了大肠杆菌的质粒和染色体的基因敲除、敲入、敲低、单碱基替换和组合编辑。该研究于2021年9月发表于Nature Communications。
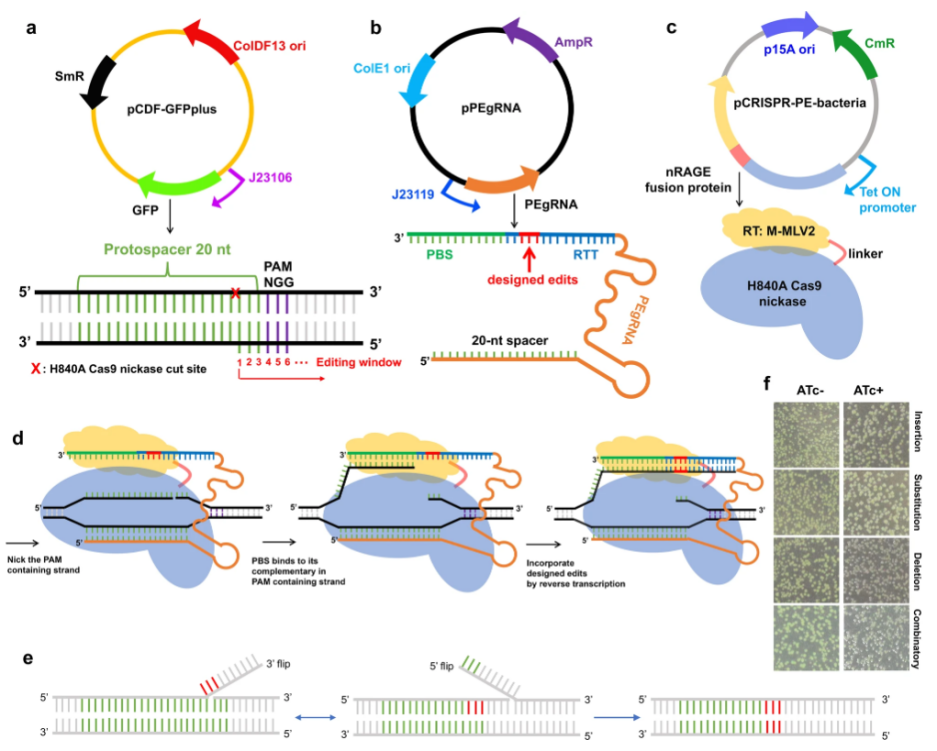
点击上图可查看原文 [5]:https://www.nature.com/articles/s41467-021-25541-3#Sec2
参考资料:
1. Gordon, D., Hiatt, J., Bouhaddou, M. et al. Comparative host-coronavirus protein interaction networks reveal pan-viral disease mechanisms. Science, 370, 6521 (2020). https://www.science.org/doi/10.1126/science.abe9403#F5
2. Mac Kain, A., Maarifi, G., Aicher, S. et al. 2021. Identification of DAXX As A Restriction Factor Of SARS-CoV-2 Through A CRISPR/Cas9 Screen. https://www.biorxiv.org/content/10.1101/2021.05.06.442916v1.full
3. Obara, E.A.A., Aguilar-Morante, D., Rasmussen, R.D. et al. SPT6-driven error-free DNA repair safeguards genomic stability of glioblastoma cancer stem-like cells. Nat Commun 11, 4709 (2020). https://doi.org/10.1038/s41467-020-18549-8
4. Monkley, S., Overed-Sayer, C., Parfrey, H. et al. Sensitization of the UPR by loss of PPP1R15A promotes fibrosis and senescence in IPF. Sci Rep 11, 21584 (2021). https://doi.org/10.1038/s41598-021-00769-7
5. Tong, Y., Jørgensen, T.S., Whitford, C.M. et al. A versatile genetic engineering toolkit for E. coli based on CRISPR-prime editing. Nat Commun 12, 5206 (2021). https://doi.org/10.1038/s41467-021-25541-3





















 665
665











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








