蛋白质相互作用是细胞生命活动的核心机制,其研究对揭示疾病发生机制及药物靶点发现具有重要意义。随着分子生物学技术的发展,研究者可选择的检测手段日益丰富,但每种技术都存在其独特的适用场景和局限性。本文将系统解析五种常见基础医学研究领域中蛋白质相互作用实验技术(Co-IP、GST pull-down、邻近标记、邻近连接、FRET)的原理特征,并对其应用价值进行横向比较。
 图1 蛋白互作应用及互作连接方式(Marchand et al., 2022)。
图1 蛋白互作应用及互作连接方式(Marchand et al., 2022)。
一、5种常见蛋白互作技术解析
01 免疫共沉淀(Co-IP)
Co-IP基于抗原-抗体特异性结合原理,通过诱饵蛋白抗体将蛋白复合物从细胞裂解液中沉淀富集。实验时使用表面偶联protein A/G的磁珠捕获抗体-抗原复合物,随后通过Western blot验证相互作用蛋白。
优点:
1.能够在细胞内自然条件下检测蛋白质相互作用,更接近生理状态;
2.基于IP抗体,可检测组织样本和细胞样本的蛋白互作;
3.可用于研究蛋白翻译后的修饰情况,可查看往期文章
缺点:
1.检测不到低亲和力和瞬时的互作;
2.不能判断直接互作或是间接互作;
3.需要特异的IP抗体;
4.可能存在非特异性吸附带来的假阳性结果。
02 GST pull-down
GST pull-down通过体外重组表达GST标签融合蛋白作为诱饵,与含有猎物蛋白的裂解液共孵育后,利用谷胱甘肽琼脂糖珠特异性捕获GST融合蛋白及其互作蛋白。通过SDS-PAGE和Western blot检测猎物蛋白。该方法适用于验证体外直接相互作用,往往与Co-IP验证结果相结合,体内体外互作来确定蛋白互作情况。
优点:
1.可验证蛋白质-蛋白质之间的直接互作反应。
2.GSH谷胱甘肽偶联球珠亲和力强,洗脱纯度高,能够分离出纯度更高的蛋白体系。
3.GST标记可把一些难溶蛋白变成可溶蛋白,使实验变得更易操作。
缺点:
1.验证蛋白质互作是在试管中进行的生化反应,不能够完全反映细胞内蛋白真实互作状态。
2.融合表达的GST标签肽链可能会改变原目的蛋白原有的折叠结构。
03 邻近标记(PL)
邻近标记技术通过基因工程将标记酶(如TurboID)与诱饵蛋白融合表达。当诱饵蛋白与猎物蛋白距离足够近时(通常<40nm),连接酶催化生物素共价标记邻近蛋白。通过链霉亲和素磁珠富集后质谱鉴定互作蛋白。关于邻近标记原理及应用请查看往期公众号文章
“邻近标记技术:研究蛋白互作的利器(一)”、“邻近标记技术:研究蛋白互作的利器(二)”、“邻近标记技术:研究蛋白互作的利器(三)”、“邻近标记技术:研究蛋白互作的利器(四)”、“邻近标记技术:研究蛋白互作的利器(五)”。
优点:
1.可以在细胞内检测蛋白质相互作用,更接近生理状态;
2.具有较高的灵敏度,能够检测到低亲和力和瞬时的蛋白质相互作用;
3.无需依赖特异性抗体。
缺点:
1.实验相对较为复杂,成本较高;
2.在医学基础研究中只适用于检测细胞,无法对组织样本的蛋白互作情况进行分析。

图2 邻近标记技术原理(Ummethum et al., 2020)。
04 邻近连接(PLA)
该技术使用特异性的抗体来识别并结合目标蛋白,再通过带有一段寡聚脱氧核苷酸(单链DNA)的PLA探针识别一抗并与之结合;当两个目标蛋白靠近时,两个目标蛋白的PLA探针的DNA就会配对互补,然后在连接酶的作用下,PLA探针上的DNA片段被连接在一起,会形成环状结构,通过滚环扩增(RCA)产生可检测的信号。该方法依赖于亲和探针可对近距离(<40 nm)目标分子的进行识别,并将蛋白质检测转变为DNA核酸序列的检测来实现对特殊蛋白质的检测、定量及定位。关于PLA技术的原理和应用请查看往期公众号文章“邻近连接技术:蛋白互作可视化的研究利器”。
优点:
1.具有较高的灵敏度和特异性,能够检测到低丰度和低亲和力的蛋白质相互作用;
2.可以在细胞内或组织切片中进行检测,具有较好的空间分辨率;
3.基于荧光强度,可直观感受互作强弱并可定量分析;
3.与其它maker相结合,分析蛋白互作的亚细胞水平位置;
缺点:
1.操作步骤相对繁琐,需要多种试剂和设备,成本较高;
2.检测结果可能受到抗体质量的影响,需要选择高质量的抗体。

图3 PLA技术检测FXR1蛋白与cMYC的mRNA互作情况(George et al., 2021)。
05 荧光共振能量转移(FRET)
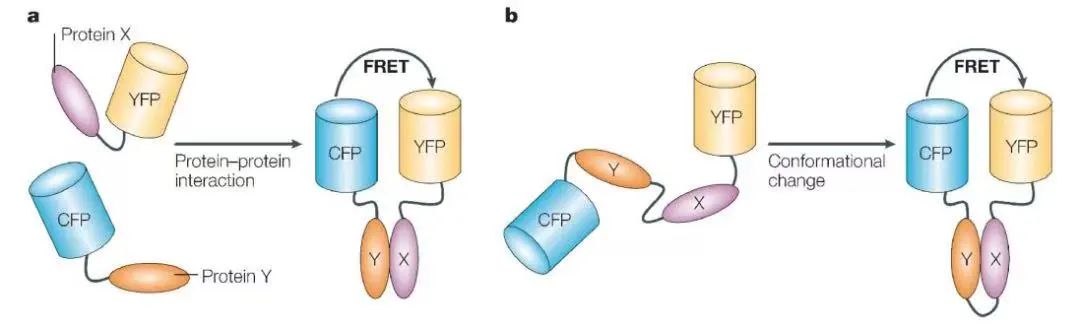
图4 分子间或分子内FRET作用示意图(Markova., 2008)。
FRET的实验原理:当供体荧光基团(如CFP)与受体荧光基团(如YFP)距离小于10nm时,能量通过非辐射方式转移导致受体发射特异性荧光,通过检测受体荧光强度变化可反映蛋白互作动态。具体关于FRET技术介绍及应用请查看往期公众号文章
“蛋白互作检测之FRET荧光共振能量转移:分子间距离的微妙舞者“、”蛋白互作检测之FRET荧光共振能量转移:分子间距离的微妙舞者(二)”、“荧光共振能量转移常用分析方法“。
优点:
1.可以在活细胞内实时检测蛋白质相互作用,能够动态观察蛋白质互作的变化;
2.空间分辨率高,能够精确检测蛋白质之间的距离变化;
3.适用于研究瞬时或动态的蛋白质相互作用。
缺点:
1.需要特殊成像设备,操作相对复杂,成本高;
2.荧光蛋白与目的蛋白融合表达,可能对目的蛋白的结构和功能产生一定的影响。
蛋白互作的常见技术对比如下:

二、技术选择策略
选择蛋白互作验证技术时应重点考虑以下因素:①研究目标(发现新互作/验证已知互作)②样本类型(细胞系/组织样本)③互作特征(稳定/动态)④分辨率需求。Co-IP与GST pull-down作为经典技术适用于初步验证,邻近标记适用于蛋白弱/瞬时互作;考虑到PLA和FRET成本较高,可在蛋白互作初步验证结果上,可运用PLA和FRET进一步观察蛋白互作位置或动态分析,让蛋白互作可视化。另外,PLA在临床样本检测中展现独特优势,FRET适合研究动态互作过程,而邻近标记技术则为大规模互作组学研究提供有力工具。邻近标记、邻近连接、FRET都属于新兴蛋白互作技术,随机相应的衍生技术开发,运用场景越来越广泛,不仅仅局限于蛋白互作。
关于以上蛋白互作技术,我司已经积累了丰富的技术经验,如想咨询相应技术可联系我司,针对具体研究背景给出合适的蛋白互作方案。
参考文献
George J, Li Y, Kadamberi I P, et al. RNA-binding protein FXR1 drives cMYC translation by recruiting eIF4F complex to the translation start site[J]. Cell reports, 2021, 37(5).
Marchand A, Van Hall-Beauvais A K, Correia B E. Computational design of novel protein–protein interactions–An overview on methodological approaches and applications[J]. Current Opinion in Structural Biology, 2022, 74: 102370.
Markova O .FLUORESCENT BIOSENSORS FOR LIVE CELLS ANALYSIS[J]. 2008.
Ummethum H, Hamperl S. Proximity labeling techniques to study chromatin[J]. Frontiers in Genetics, 2020, 11: 536839
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








